1株草地贪夜蛾寄生真菌的分离鉴定及活性测试
何俊烺 何景超 华宏伟 周易 程东美

摘要:为探明在玉米地被真菌感染的草地贪夜蛾(Spodoptera frugiperda)幼虫的致病菌种,丰富草地贪夜蛾病原真菌资源,为草地贪夜蛾生物防治研究以及生防菌剂的开发利用提供材料,对采集到的草地贪夜蛾僵虫体进行常规分离纯化,通过形态学和核糖体内转录区间(ITS-rDNA)序列分析对分离得到的病原真菌进行鉴定,并采用浸虫法研究病原真菌對2龄草地贪夜蛾幼虫的室内活性。经鉴定,从感病的草地贪夜蛾幼虫上分离获得的病原真菌菌株ZHKUMR1为莱氏绿僵菌(Metarhizium rileyi)。菌株ZHKUMR1接种草地贪夜蛾2龄虫后,幼虫的致死中浓度(LC50)为4.24×105 CFU/mL,最适致病浓度为5×108 CFU/mL,接菌9 d后幼虫半数致死时间(LT50)为4.39 d,累计校正死亡率达97.62%。自玉米地采集的草地贪夜蛾幼虫上分离得到的病原真菌为莱氏绿僵菌,该菌株对草地贪夜蛾幼虫具有高致病性,可作为对草地贪夜蛾的生防菌剂开发应用。
关键词:草地贪夜蛾;病原真菌;莱氏绿僵菌;致病力
中图分类号:S476.12 文献标志码: A
文章编号:1002-1302(2022)08-0032-05
草地贪夜蛾(Spodoptera frugiperda)别称秋黏虫,是一种原产于美洲的跨境迁飞性重大害虫,具有寄主范围广、繁殖能力强、迁飞扩散快、危害程度重和防控难度大等特点[1]。2019年1月,草地贪夜蛾首次入侵我国云南省,凭借极强的长距离迁飞能力迅速扩散至西南、华南、江南、长江中下游、黄淮、西北、华北等广大地区为害,累计发生面积达108万hm2,成为我国玉米上重大突发性、暴食性害虫,对我国粮食生产安全构成长期性威胁[2]。预计2021年将在西南、华南、长江中下游和江淮地区呈重发态势,须重点防控,西北、黄淮、华北和东北须加强防范,全国发生面积可能达133.33万hm2以上,防治面积200万hm2次以上[3]。在草地贪夜蛾侵入我国后,化学防治在控制草地贪夜蛾的暴发危害、减缓其快速传播、减轻玉米受害和保障粮食安全等方面发挥了重要作用[4],是当前的主要防控手段。除化学防治外,生产上还可采用生物防治、理化诱控、生态调控等综合措施进行防控。昆虫病原真菌是生物农药的重要组成部分,对多种重要农、林害虫具有较好的防治效果,同时在减少化学农药使用量、减缓害虫抗药性和保护生态环境方面发挥着重要作用,球孢白僵菌和金龟子绿僵菌是研究应用最广的种类,也是防治草地贪夜蛾的推荐药剂,也是我国最早获批登记的草地贪夜蛾防治药剂。Cruz-Avalos 等通过比较分离得到的14种真菌对草地贪夜蛾卵和幼虫的致病力发现,金龟子绿僵菌对草地贪夜蛾卵和幼虫的致病率均为100%,球孢白僵菌引起的卵致病率最高可达到92%,引起的幼虫死亡率最高为75%[5]。
莱氏绿僵菌(Metarhizium rileyi)是对鳞翅目幼虫极具生防潜能的虫生真菌,在适宜的环境条件下能引起害虫的病害流行,有效地防治害虫[6-7],是重要的昆虫病原真菌。Ruiz-Nájera等在墨西哥调查发现,莱氏绿僵菌可侵染草地贪夜蛾3~6龄幼虫,对3龄幼虫的侵染率最高[8]。草地贪夜蛾入侵我国云南省后,郑亚强等从当地感染幼虫上分离获得了高活性的莱氏绿僵菌菌株ZYSP190701,以1×108 CFU/mL 浓度处理3龄幼虫,7 d后的死亡率达100%[9]。雷妍圆等从广州分离的莱氏绿僵菌菌株对草地贪夜蛾2龄幼虫表现出较强的致病力[10]。本研究对从广州市从化区玉米田采集的草地贪夜蛾僵虫进行了致病菌的分离培养和种类鉴定,并测试了对草地贪夜蛾幼虫的致病力。
1 材料与方法
1.1 供试虫源及饲养
草地贪夜蛾幼虫由华南农业大学农药学系徐汉虹团队提供,并以人工饲料饲养至化蛹,待羽化产卵后作为实验室供试虫源。室内饲养条件为温度(28±1) ℃,相对湿度70%~90%,光—暗周期为16 h—8 h。
1.2 僵虫采集及致病菌分离培养
于2019年12月自广州从化地区玉米植株上采集草地贪夜蛾幼虫僵虫4头,1头绿色,3头白色。发现僵虫后,把僵虫保存于指形管,每管1头,以脱脂绵塞住瓶口,置于4 ℃冰箱保存备用。
用接种环挑取虫体上少量孢子,采用划线法将孢子接种于马铃薯葡萄糖琼脂(PDA)培养基上,于(25±1) ℃恒温培养箱中培养,待长出绒毛状菌丝后,切新生菌丝转移到水琼脂(WA)培养基,生长 1 d 后,用小手术刀挑取单根菌丝接在新麦芽糖沙氏培养基(SMAY)培养基上。纯化的菌株采用SMAY斜面培养基于4 ℃冰箱保存。由4头僵虫分离纯化获得4株真菌,经形态学初步鉴定,每一株真菌都具有十分相似的菌落形态和显微形态,将其视为同一种菌,并命名为ZHKUMR1。
1.3 菌落培养及形态观察
将分离并纯化得到的菌株分别接于SMAY培养基和PDA培养基上,置于(25±1) ℃、光—暗周期为16 h—8 h的恒温培养箱培养7~14 d,待菌落表面有孢子粉,记录菌落特征及其直径[11]。采用ICC50W光学显微镜(德国徕卡公司)观察产孢结构和分生孢子形态等显微结构,S-3000N扫描电镜(日本日立公司)观察超微结构。
1.4 菌株的毒力测定
ZHKUMR1菌株以SMAY培养基培养至产生大量橄榄色孢子后,用0.2%吐温-80无菌水配制成6个浓度的孢子悬浮液(1×106、5×106、1×107、5×107、1×108、5×108 CFU/mL ),用浸虫法进行毒力测定。将大小一致、健康的草地贪夜蛾2龄幼虫在供试孢子悬浮液中浸渍5 s后取出,置于滤纸上吸取多余水分,移至6孔细胞培养板以人工饲料饲养。从处理1 d后开始,连续观察9 d,将死亡幼虫移出,在(25±1) ℃、光—暗周期为16 h—8 h、相对湿度为85%条件下保湿培养,根据虫体是否长出目的菌确定各幼虫的死亡原因。每个处理重复3次,每次重复20头虫。
1.5 菌株的分子鉴定
DNA提取采用螯合树脂Chelex-100提取法[12]。挑取少量菌丝于装有10 L质量浓度为10%螯合树脂的指型管中,9 000 r/min振荡离心5 min,95 ℃水浴加热5 min,反复3次完成粗提DNA,取上清液备用。PCR反应体系:DNA模板1 μL、引物ITS1和ITS4 各1 μL、Taq PCR mix 12.5 μL、ddH2O 9.5 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,30个循环;72 ℃延伸10 min。用质量浓度为1%的琼脂糖凝胶电泳检测。PCR产物由广州天一辉远基因科技有限公司测序。
对分离获得菌株ITS-rDNA测序结果进行优化,提交到NCBI 网站(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对。下载与目的菌株具有同源性的多个菌株及其相关近缘属菌株的相应序列,使用MEGA 7.0邻接法(neighbor-joining method,简称NJ),应用最大似然法,运行1 000次自助法(bootstrap )验证,构建系统发育树,结合菌株形态生物学特征,确定菌株的系统分类地位。
1.6 统计分析
试验数据经Excel 2019整理后,使用DPS7.05进行统计分析,统计各处理幼虫的累计死亡率和累计校正死亡率,并对试验数据进行差异显著性分析。使用SPSS 26.0进行回归方程、半数致死时间(LT50)、致死中浓度(LC50)及相关系数的统计分析。累计死亡率=处理死亡总虫数/处理总虫数×100%;累计校正死亡率=(处理累计死亡率-对照累计死亡率)/(1-对照累计死亡率)×100%[10]。
2 结果与分析
2.1 幼蟲感染症状
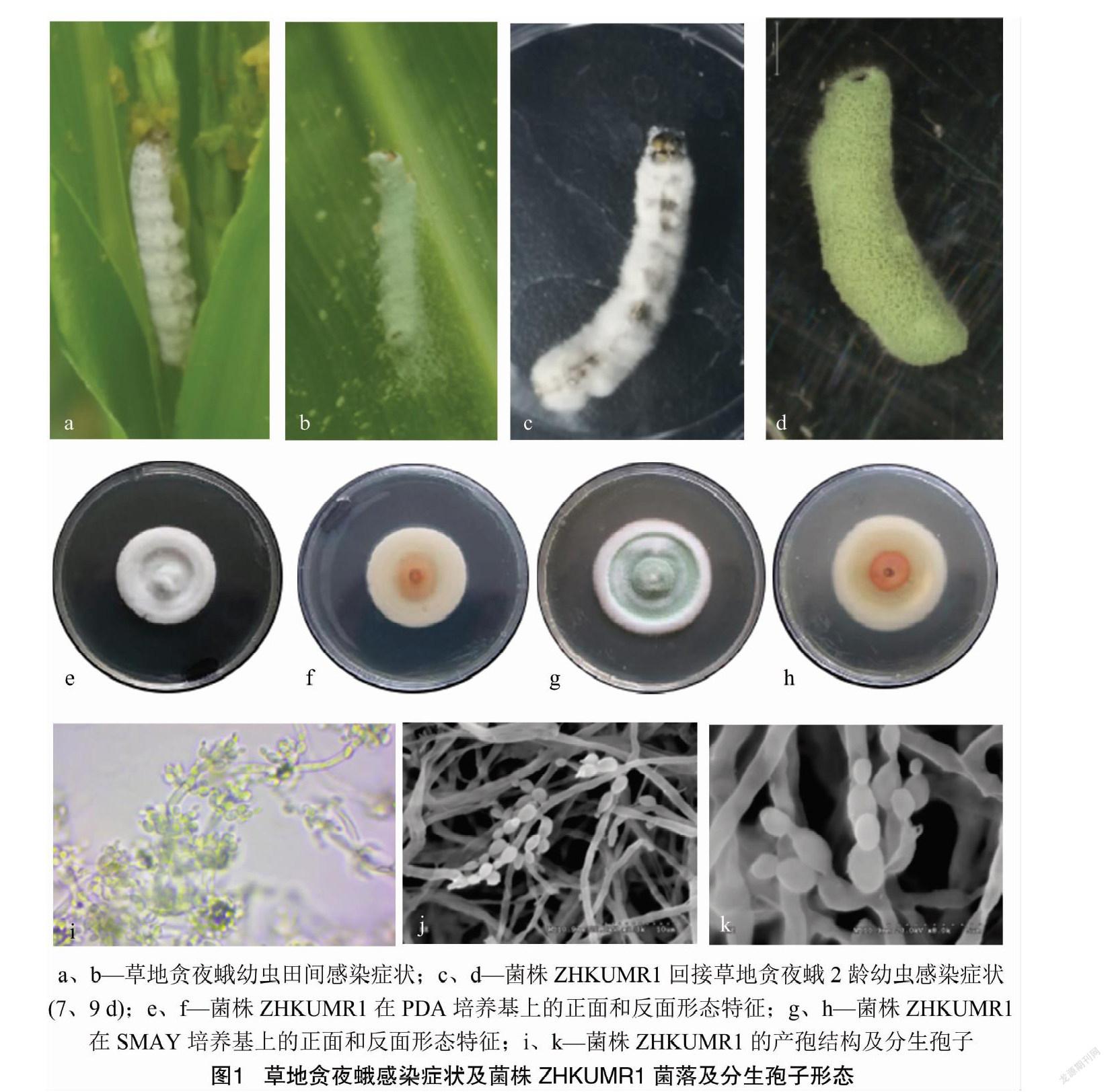
从玉米卷叶中发现的自然感染寄生真菌的草地贪夜蛾幼虫,感菌虫体早期被白色菌丝包裹(图1-a),中后期呈淡绿色,体表有大量橄榄绿色孢子粉(图1-b)。将菌株ZHKUMR1分离纯化培养14 d,菌落产生的孢子粉制备成孢子悬浮液,浓度为1×108 CFU/mL,接种到体型一致、健康的2龄草地贪夜蛾幼虫上。接菌2 d后,幼虫行动不活跃;4 d 后部分幼虫死亡,虫体颜色暗沉,变硬,7 d后虫体长出白色菌丝(图1-c);接菌25 d后,虫体干瘪,虫体外表有纤细菌丝和孢子粉包裹,孢子粉呈橄榄绿色(图1-d)。
2.2 菌株ZHKUMR1的形态鉴定
PDA培养基(图1-e至图1-f)和SMAY培养基(图1-g至图1-h)的菌株均能正常生长,形态特征相似,菌落直径、初产孢时间及产孢量有明显差异。在PDA培养基上,菌落正面乳白色,呈棉絮状凸起,背面淡黄棕色,培养20 d时的菌落直径为(36.63±0.22) mm,表面中心至边缘1/2处有环状凹陷,边缘菌丝呈辐射状分布;在SMAY培养基培养,菌落平均直径为(43.6±0.42) mm,正面大部分覆盖橄榄色孢子,近正圆形,菌落外缘为白色,边缘平整,背面为淡黄棕色和白色,界线分明。显微结果显示,菌丝光滑,有分隔,分生孢子梗着生在营养菌丝上,直径为1.3~1.5 μm,分生孢子梗上形成浓密的孢梗簇,其上着生4~5个瓶梗,圆柱形,基部较为膨大,顶部尖细;分生孢子成橄榄球状,长椭圆形,外表光滑,大小为(2.9~3.3) μm×(1.8~2.7) μm。
2.3 分子生物学鉴定结果
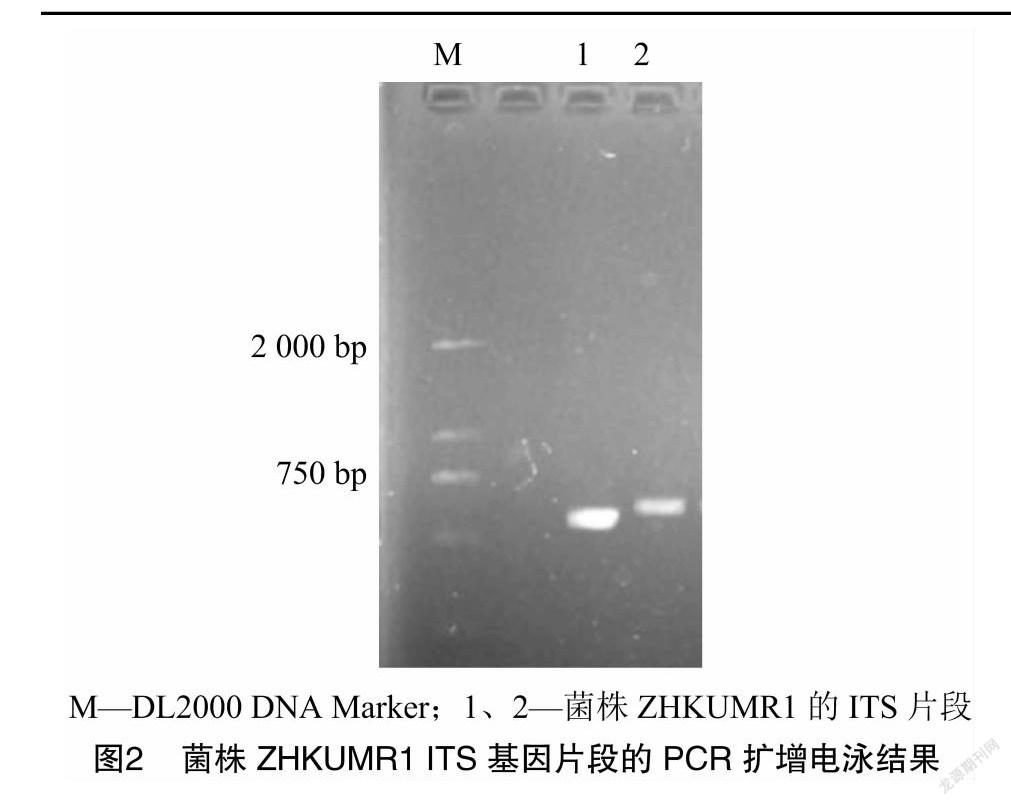
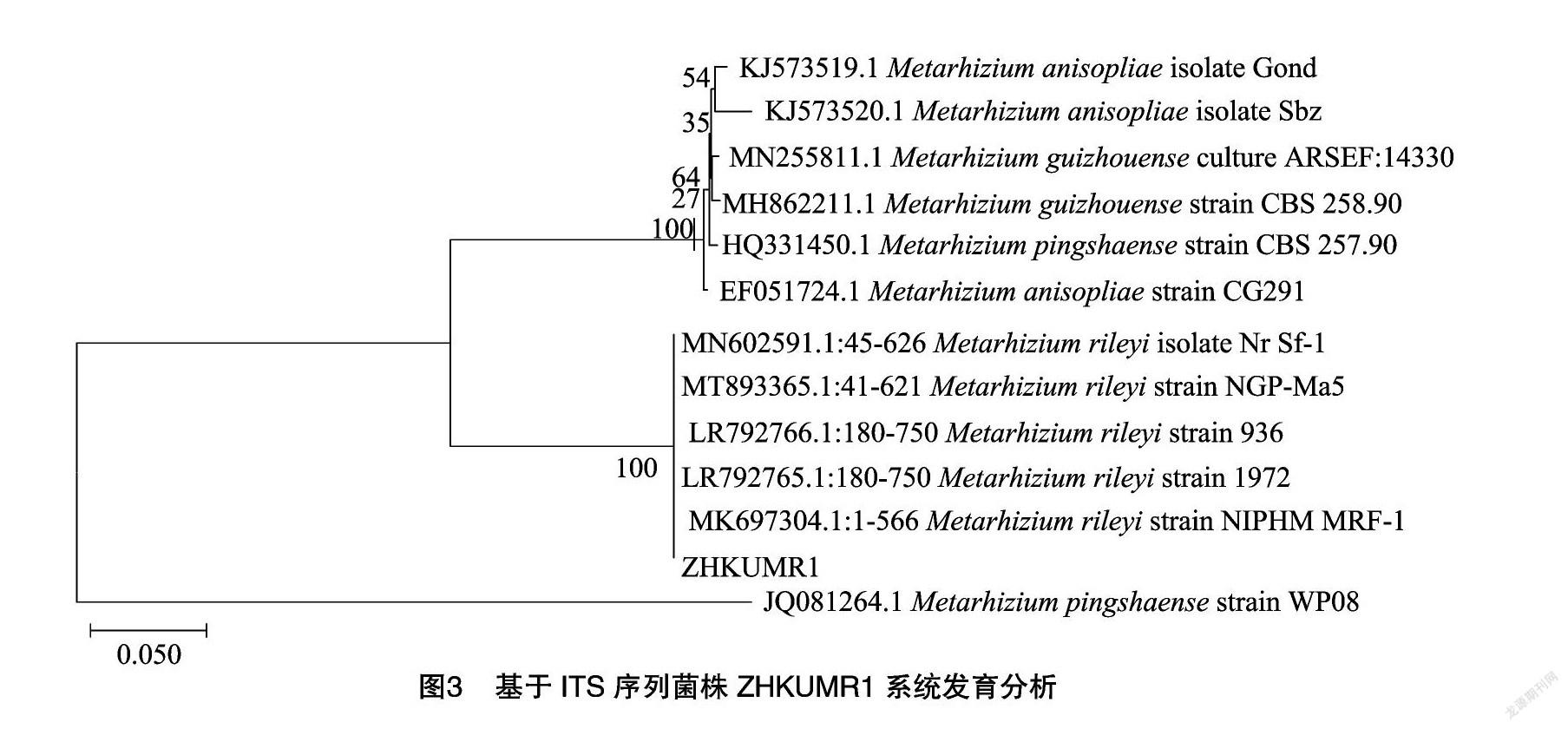
利用引物对目的菌株的ITS-rDNA进行PCR扩增,获得1条595 bp扩增片段(图2),将该序列(登录号:MZ151847)在GenBank数据库中进行BLAST比对,结果发现该菌株与NCBI数据库中的M. rileyi strain NIPHM MRF-1菌株同源性为100%。将其在NCBI数据库中比对得到的序列,上传至MEGA 7.0构建发育树(图3),结果表明,菌株ZHKUMR1与数据库中其他莱氏绿僵菌菌株聚为一大支,与MK697304亲缘关系最为相近。综合形态学鉴定和ITS序列相似性分析,鉴定此菌株ZHKUMR1为莱氏绿僵菌(M. rileyi)。
2.4 菌株ZHKUMR1对草地贪夜蛾幼虫的毒力
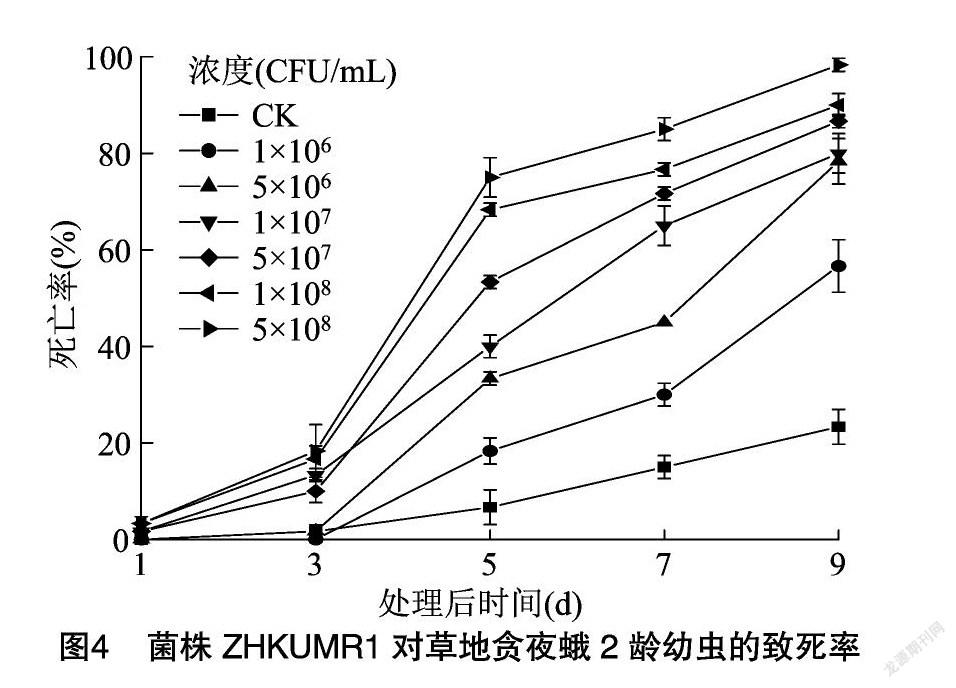
莱氏绿僵菌菌株ZHKUMR1对草地贪夜蛾2龄幼虫有较强的致病力,处理3 d后幼虫出现死亡,死亡率随孢子悬浮液浓度升高和处理时间的增加而增加,处理3~5 d草地贪夜蛾幼虫死亡率快速上升(图4)。处理9d后,不同浓度的孢子悬浮液对草地贪夜蛾幼虫均有致病力,浓度为5×108 CFU/mL的孢子悬浮液对草地贪夜蛾幼虫毒力最强,累计死亡率和校正死亡率分别为98.33%、97.62%,且LT50最短,为4.39 d(表1);9 d后菌株ZHKUMR1对草地贪夜蛾幼虫LC50为4.24×105 CFU/mL。综上所述,莱氏绿僵菌菌株ZHKUMR1的孢子悬浮液对草地贪夜蛾幼虫有较好的活性。
3 讨论与结论
昆虫病原真菌是指能够直接侵入健康昆虫体内、迅速增殖和导致昆虫死亡的真菌类群[9]。因其对环境友好,具有害虫不易产生抗性、易流行,被认为是最有可能替代化学农药的下一代新型生物农药,且在草地贪夜蛾防治中具有很大的应用潜力[13-14]。本研究从玉米地田间采集的草地贪夜蛾僵虫上分离得到1株病原真菌,经形态学和生物分子学分析,鉴定该菌株为莱氏绿僵菌。菌株ZHKUMR1对2龄草地贪夜蛾幼虫的致病力较强,在孢子悬浮液浓度为5×108 CFU/mL下,草地贪夜蛾的校正死亡率可达到97.62%,在4 d后出现半数试虫死亡,表明莱氏绿僵菌对草地贪夜蛾低龄幼虫具有较高的致死率,与郑亚强等的结论[9-10]一致。虽然莱氏绿僵菌对草地贪夜蛾具有良好的生防潜力,但相对于其他昆虫病原真菌,更容易受到环境因素的影响[15],其产孢需要的营养条件较为严格[16-18],加之真菌杀虫剂相对于化学农药见效慢、生产效率低、成本高、产品质量不稳定等问题,因此限制了该类菌剂的大规模生产[9]。然而,随着真菌杀虫剂的使用逐渐流行,真菌杀虫剂有可能在大田作物虫害综合防治(IPM)中发挥作用,以实现有效和相对安全的害虫管理。为了实现这一目标,须要采取积极的研究措施来改善它们在不良的环境条件下的性能,研制出具有持久性、更长的保质期和易于应用的配方,以及使之具有更强的毒力和更广的作用范围[19]。一些研究表明,低毒、高效化学农药与诸如球孢白僵菌、金龟子绿僵菌等昆虫病原真菌配合使用,能有效增强昆虫病原真菌对草地贪夜蛾的侵染致病性,提高真菌在虫体上的产孢量,并延缓化学农药对草地贪夜蛾的抗药性,减少杀虫剂对环境的影响[9,20]。本研究分离得到的莱氏绿僵菌菌株ZHKUMR1对草地贪夜蛾幼虫在室内适当的试验条件下具有较强的致病力,证明其具有一定的生防潜力,但是在实际应用中是否能够适应自然环境,从分离到应用在田间防治的过程中能否保持菌株毒力以及能否通过与化学药剂的混配从而降低化学药剂用药量的同时提高对不同龄期草地贪夜蛾的防治效果,因此,开展真菌生物农药与化学农药混用技术研究,对减少化学农药的用药量、保持菌株稳定性以及降低害虫对化学农药的抗药性具有重要的价值。
参考文献:
[1]吴孔明. 中国草地贪夜蛾的防控策略[J]. 植物保护,2020,46(2):1-5.
[2]齐国君,苏湘宁,章玉苹,等. 草地贪夜蛾监测预警与防控研究进展[J]. 广东农业科学,2020,47(12):109-121.
[3]梁宝忠. 预计2021年我国农作物主要病虫害仍维持重发态势[J]. 中国食品,2020(23):157-158.
[4]王登杰,任茂琼,姜继红,等. 草地贪夜蛾绿色防控技术研究进展[J]. 植物保护,2020,46(1):1-9.
[5]Cruz-Avalos A M,de los ngeles Bivián-Hernández M,Ibarra J E,et al. High virulence of Mexican entomopathogenic fungi against fall armyworm,(Lepidoptera:Noctuidae)[J]. Journal of Economic Entomology,2018,112(1):99-107.
[6]杜广祖,郑亚强,苏锦尧,等. 云南莱氏野村菌田间自然发生流行动态研究[J]. 环境昆虫学报,2018,40(5):1119-1127.
[7]Perinotto W M S,Terra A L M,Angelo I C,et al. Nomuraea rileyi as biological control agents of Rhipicephalus microplus tick[J]. Parasitology Research,2012,111(4):1743-1748.
[8]Ruiz-Nájera R E,Ruiz-Estudillo R A,Sánchez-Yáez J M,et al. Occurrence of entomopathogenic fungi and parasitic Nematodes on Spodoptera frugiperda(Lepidoptera:Noctuidae) larvae collected in central Chiapas,México[J]. Florida Entomologist,2013,96(2):498-503.
[9]郑亚强,胡惠芬,付玉飞,等. 草地贪夜蛾莱氏绿僵菌的分离鉴定[J]. 植物保护,2019,45(5):65-70.
[10]雷妍圆,王德森,薛志洪,等. 广州地区一株绿僵菌的鉴定及其对草地贪夜蛾的致病力测定[J]. 南方农业学报,2020,51(6):1265-1273.
[11]蒲蛰龙,李增智. 昆虫真菌学[M]. 合肥:安徽科学技术出版社,1996.
[12]陈吉良,黄小龙,吴安迪,等. 一种快速高效提取病原真菌DNA作为PCR模板的方法[J]. 菌物学报,2011,30(1):147-149.
[13]刘春来. 昆虫病原真菌在农林害虫生物防治中的应用[J]. 黑龙江农业科学,2017(3):68-73.
[14]张 维,彭国雄,夏玉先. 昆虫病原真菌防控草地贪夜蛾的现状、问题与展望[J]. 中国生物防治学报,2019,35(5):674-681.
[15]Grijalba E P,Espinel C,Cuartas P E,et al. Metarhizium rileyi biopesticide to control Spodoptera frugiperda:stability and insecticidal activity under glasshouse conditions[J]. Fungal Biology,2018,122(11):1069-1076.
[16]Edelstein J D,Lecuona R E,Trumper E V.Selection of culture media and in vitro assessment of temperature-dependent development of Nomuraea rileyi[J]. Neotropical Entomology,2004,33(6):737-742.
[17]楊新军,林华峰,李茂业,等. 莱氏野村菌Nr05菌株的培养性状及其对斜纹夜蛾的毒力[J]. 中国生物防治,2007,23(1):44-48.
[18]刘守柱,刘双双,姜武玲,等. 外源糖类和维生素对莱氏绿僵菌Metarhizium rileyi孢子萌发的促进作用[J]. 山东农业科学,2020,52(3):97-101.
[19]Um M,Galadima I,Gambo F,et al.A review on the use of entomopathogenic fungi in the management of insect pests of field crops[J]. Journal of Entomology and Zoology Studies,2018,6:27-32.
[20]Rivero-Borja M,Guzmán-Franco A W,Rodríguez-Leyva E,et al. Interaction of Beauveria bassiana and Metarhizium anisopliae with chlorpyrifos ethyl and spinosad in Spodoptera frugiperda larvae[J]. Pest Management Science,2018,74(9):2047-2052.

