植物根压研究进展
张周颖 郭雯 杨石建
摘要: 根壓是植物根部产生的一种静水压力,广泛存在于多种植物中。在蒸腾作用很弱的情况下,根压不但可驱动水分从根部流向冠层叶片,缓解因白天强烈蒸腾而导致的水分亏缺,而且在木质部导管栓塞修复方面具有重要作用。虽然国内外学者对根压的产生已有一些解释,普遍接受的观点有渗透理论、代谢理论和水分向上共同运输假说等,但根压产生的机制至今仍是科学家争议的焦点之一。根压的测定方法虽有直接和间接测定、损伤和无损伤测定之分,但较为先进的根压测定技术仍需进一步改善和提升。受水通道蛋白、遗传因素、生境等因素的影响,根压的大小存在差异,即使是较低的根压也会影响农作物生长。在促进转运蛋白质、酶、氨基酸、激素及钙元素等在农作物木质部和韧皮部之间流通方面,适当大小的根压发挥重要作用,且有助于提高农作物产量。因此,加深对植物根压的认识和理解具有重要的生物学意义。该文从根压的定义和产生机制、具有根压的植物类群、根压的测定方法和大小、影响根压的主要因素及根压在植物科学研究领域的意义和影响等多个方面分别进行了归纳总结,并结合当前研究热点和研究成果,针对植物根压研究过程中遇到的问题和后续研究趋势及方向进行了展望。
关键词: 根压, 静水压力, 木质部栓塞, 水分运输, 影响因素
中图分类号: Q945文献标识码: A文章编号: 1000-3142(2022)04-0714-14
Recent advances in research on root pressure of plants
ZHANG Zhouying GUO Wen YANG Shijian
( 1. College of Ecology & Environmental Science, Yunnan University, Kunming 650500, China;
2. Yunnan Key Laboratory of Plant
Reproductive Adaption and Evolutionary Ecology, Kunming 650500, China;
3. Laboratory of Ecology and Evolutionary
Biology, Yunnan University, Kunming 650500, China )
Abstract: Root pressure is a positive hydraulic pressure that generated by plant roots. As a common physiological phenomenon in many plants, root pressure can drive the sap flow from roots to canopy leaves, which alleviates plant water deficits caused by strong transpiration during the day. It also plays an important role in xylem embolism refilling. At present, there are many explanations for the generation of root pressure. The generally accepted views include the osmotic theory, the metabolic theory, and the uphill water co-transport hypothesis, but the mechanism of root pressure is still the focus of controversy among the plant scientists. There are direct and indirect methods for measuring root pressure, but the more advanced techniques of measuring root pressure still need to be improved. Under the influence of many factors such as aquaporin, genetic factors and habitats, there are differences in the magnitude of root pressure, and moderate root pressure has important significance for crops growth. Therefore, it is of great biological significance to deepen our understanding of root pressure. Here we discussed root pressure from the following perspectives: the definition and mechanism of root pressure generation; plant groups with root pressure; the methods for measuring root pressure; the main factors about influencing root pressure; the significance and implications of root pressure in various fields of plant science studies. Lastly, based on current research topics and some new results on root pressure, we discussed future perspectives on root pressure of plants.
Key words: root pressure, hydraulic pressure, xylem embolism, water transport, influence factors
水是一切生命活动必不可少的物质。植物通过根部吸收土壤水分后,由基部向顶部运输几米甚至是几十或上百米的高度,从而满足植物地上部分的用水需求。植物完成水分的吸收、运输、散失等过程均需要克服重力、原生质体和质外体运输阻力及土壤的毛细管力等多种阻力。若没有足够大的动力克服这些阻力,则植物无法完成正常的水分代谢过程(Dixon, 1914; 尚念科,2012)。在植物的水分运输过程中,除蒸腾拉力能由下往上拉动水分外,根压(root pressure)也能推动水分在导管或管胞中向上运输(Zachary, 2009)。由于植物根部生理活动,存在于皮层中的离子和可溶性有机物等不断通过内皮层进入中柱并使皮层内外产生渗透差。在渗透差梯度驱动下,水分从外界流入中柱内导管或管胞,从而积累并产生了正的静水压力(Taiz et al., 2015)。叶片吐水或茎干伤流均是根压存在的有力证明(Singh, 2016a)。
目前,已有大量研究发现根压是植物常见的一种生理活动,不仅广泛存在于多种植物中,而且是木质部栓塞修复的一种重要动力(Sperry et al., 1987; Yang et al., 2012; Leng et al., 2013)。在蒸腾作用很弱的条件下,根部产生正的木质部压力不仅可推动水分沿导管或管胞向上运输,还可使气泡溶解或水分再填充修复已发生栓塞的导管,缓解因白天强烈蒸腾而导致植物组织的水分亏缺,并为第二天的蒸腾耗水进行水分储存(Yang et al., 2012; Zhao et al., 2017; Nardini et al., 2018)。除修复植物木质部栓塞和补充茎干水分外,根压在植物生态学、植物生理学、农学、园艺学等多个植物科学研究领域均具有重要生物学意义。根压的产生及大小会受水通道蛋白、遗传因素、土壤和其他诸如光合有效辐射、饱和水汽压差及降雨等环境因素的影响(Frank, 2006; 田新立,2008; 郭建荣,2016; Sun et al., 2018)。然而,目前关于根压产生的生理机制并无确切的科学解释。从植物分子水平的角度分析水通道蛋白对根压的影响、较为先进的根压测定技术的研发以及在农艺学方面根压的实际应用等诸多方面都需要进行深入挖掘和提升。因此,本文对前人在植物根压方面的研究进行了归纳和总结,并结合当前的研究热点和一些研究成果提出观点,对植物根压的后续研究进行展望。
1根压的定义和产生机制
由根系木质部产生,且导致被切割的茎干(或小枝)表面渗出汁液和/或未受伤的叶片边缘吐水的静水压力被称为根压(Kramer & Kozlowski,1979; Kramer & Boyer, 1995)。该静水压力的形成与根部形态解剖结构(根毛-皮层-内皮层-中柱-导管或管胞)和生理活动密切相关。在正常情况下,因根部细胞生理活动,木质部皮层细胞中的矿质离子和有机物等在水势梯度下通过皮层细胞进入中柱,导致中柱内渗透势和水势降低,促使中柱继续向皮层吸收水分进而产生正的静水压力(潘瑞炽,2012)。随蒸腾速率增加,水分通过木质部运输并迅速流失至大气中,较大的蒸腾拉力导致木质部不会因离子等主动吸收而表现出正的压力。根压被假定认为是在渗透和能量的共同驱动下,水分通过木质部薄壁组织的细胞膜,可能利用了离子和糖的自由能梯度向上运输而产生的静水压 (Wegner, 2014)。根压的产生并不仅仅受由自由能梯度驱动水分穿过木质部薄壁细胞质膜的影响,根系的凯氏带结构和生理活动所引起的主动吸水也起了重要作用(Enstone et al., 2003)。
根不但能固定植株,而且能从土壤中吸收水分和溶解于水中的矿质营养等以供植物生长,其中根毛区是根吸收水分的主要区域(Kramer & Boyer, 1995)。水分被植物根毛吸收后,通过三条途径 [质外体途径(apoplast pathway)、共质体途径(symplast pathway)和跨膜途径(transmembrane pathway)]进入木质部的导管或管胞。水分经以上三条途径整合后在进入根系木质部导管或管胞的过程中可能会产生根压(Knipfer & Fricke, 2010; 潘瑞炽,2012; Scharwies & Dinneny, 2019)。Pickard(2003a, b)通过结合胞间连丝由静水压力驱动的水流,提出了一种根系水分流动的相关模型。如果内皮层细胞内的膨压在其他植物细胞的压力范围之内(0.4~1 MPa),则在中柱/木质部与内皮层之间应该存在一种靜水压力梯度,并且使得水分流向木质部。尽管我们不能排除这种水流是细胞间传递的一部分,不一定由水通道蛋白介导,但是水通道蛋白是根系径向水分运输控制位点的现象已被证实(Knipfer & Fricke, 2010)。
虽然已有很多理论可解释根压的产生,但根压产生的机制至今仍是科学家争议的焦点之一。目前,普遍接受的观点有渗透理论、代谢理论和水分向上共同运输假说。
1.1 渗透理论
当夜晚蒸腾作用很弱或没有时,根系输导组织周围的活细胞通过新陈代谢不断向导管或管胞的管腔内泵入矿质离子和可溶性有机物(如天冬氨酰、谷氨酰胺等),这些物质的积累导致管腔内溶液的水势下降,而附近活细胞的水势较高,所以水分就会沿水势差不断流入管腔。同时,外界土壤水分也随水势差从根毛、皮层、内皮层进入到木质部,产生了正的静水压力,进而推动木质部汁液向上运输(董忠民,2003; Singh, 2016b)。在此过程中,根系起了渗透计的作用。水分从水势较高的土壤,经过根系内皮层细胞组成的半透膜,进入水势较低的木质部管腔 (董忠民,2003)。因为内皮层细胞壁上的凯氏带环绕在内皮层径向壁和横向壁上,而细胞质牢牢地附着在凯氏带上,所以水分既不能作径向运动,也不能在细胞壁和质膜之间移动,只能由水通道蛋白(aquaporin, AQP)运输并通过内皮层的原生质体。因此,根系内皮层则具有半透膜的作用(潘瑞炽,2012; Logvenkov & Stein, 2013)。
对根压产生的解释,曾被普遍接受的观点是基于根系细胞溶质主动积聚并被分泌到木质部,随后沿水势梯度进行水分渗透移动。因此,“渗透计模型”是把木质部汁液与外部介质分开的内皮层视为半透膜。多细胞的根系组织就像半透膜一样,通过响应溶质的积累,在木质部中建立了正的静水压力。当蒸腾作用很弱时,根系细胞继续将溶质泵入木质部,而内外皮层有助于防止溶质泄露。持续积累的溶质降低了中柱的水势,水分从根系皮层不断流入所产生的静水压力推动木质部汁液流动。虽然内皮层薄壁组织的结构有限制,但只要木质部传导系统渗透梯度持续存在,静水压力就可以促使水和溶质进入木质部并在管腔中向上移动。根压的产生似乎是伴随着无机盐向木质部传导系统的主动运输。
1.2 代谢理论
继渗透理论提出后,Zholkevich等(1991)提出代谢理论(Dustmamatov & Zholkevich,2008)。他们认为根系内部的水流与外界土壤溶液及根桩分泌渗出液之间存在渗透梯度,为代谢过程参与根压产生奠定了基础。1966年,有研究学者提出植物体内发生的水分主动运输是以代谢能量为代价 (Oertli, 1966)。后来研究学者借鉴了前人探究根系径向输水的方法,提出了植物的水分主动运输既涉及渗透成分,也涉及非渗透成分,并提出两者区别在于是否涉及代谢过程(Patlak et al., 1963)。目前,已有研究表明在递质的刺激作用下,由G蛋白引发的代谢过程参与了产生根压的水分主动运输 (Dustmamatov & Zholkevich, 2008)。
由木质部管腔中溶质渗透势产生的根压不但与内皮层内外的水势差有关,而且与根系的生理代谢有关。为了持续维持水分流动所需的溶质梯度,根系通过木质部薄壁组织中细胞膜驱动着溶质和水分的联合转运,溶质还需要根系代谢能量来补充(Wegner, 2014)。这一水分主动运输过程所需要的腺苷三磷酸(ATP)是由植物呼吸代谢提供,故呼吸代谢在根系吸收水分过程中具有关键作用(Wilson & Kramer, 1949)。除作为渗透物质直接调节渗透梯度外,可溶性有机物还可通过影响呼吸代谢而影响矿质离子的吸收、积累和转运(Kramer & Boyer, 1995)。
1.3 水分向上共同运输假说
大量研究表明,细胞膜上存在着运输阳离子、阴离子及水分子的多种共同转运体(co-transporters)(Gamba, 2005; Zeuthen, 2010)。当木质部薄壁细胞的膜电位低于K+的能斯特電位时,水分子被水通道蛋白运输进入细胞质基质,少数固定数量的水分子则会与K+、Cl-相互耦合,由K+和氯化物的共同转运体(potassium-chloride co-transporter type, KCC type)运出至薄壁细胞并释放水分和溶质。随后K+通过K+内流通道,H+和Cl-通过Cl-2H+协同转运体分别又进入细胞质基质补充溶质。需要注意的是,在Cl-通过Cl--2H+协同转运体转运时,H+的运转需要消耗1分子ATP,且为保证整个过程不断循环,需要激活的H+-ATP酶来维持H+的梯度(Wegner, 2014),这是Wegner基于水分共同运输模型(Zeuthen, 2010)提出的水分向上共同运输假说(uphill water co-transport hypothesis),它整合了渗透和代谢理论,认为当有离子和可溶性糖的自由能梯度时,水通道蛋白能促进水分在木质部薄壁细胞内运输,积极主动地驱动水分向上转运。由于水分通过薄壁组织的细胞膜时依靠渗透势,而渗透势的维持需要不断地消耗代谢能量补充溶质,从而保持水分进入膜内时所需的溶质梯度(Dustmamatov et al., 2004; Zholkevich et al., 2007; Wegner, 2014)。因此,该假说强调在解释根压产生的机制时需考虑水分和溶质进入植物根部的需求(Wegner, 2014; Singh, 2016b)。
Singh在该模型的基础上作了一些修改,并提出了当木质部薄壁细胞的膜电位低于K+的能斯特电位时,1个水分子与1个K+紧紧耦合,通过K+内流通道进入细胞质基质;而当木质部薄壁细胞的膜电位高于K+的能斯特电位时,3个水分子与1个K+紧紧耦合,通过K+外流通道进入木质部薄壁细胞,从而实现水分移动。在整个过程中,K+内流通道和K+外流通道的功能可通过膜电位振荡的协调实现相互转换。当膜电位被质子泵的活性超极化时,K+的循环会消耗代谢能量,从而驱动净水流从细胞质基质进入质外体,促使水分移动(Singh, 2016b)。在水分向上共同运输假说提出之前,渗透理论已被人们相对普遍接受,但它并没有得到所有学者的认可(Kramer & Boyer, 1995)。基于前人研究,水分向上共同运输假说是目前解释根压产生机制的最新理论,然而该理论仍需在不同生境、不同生长状态的植物中进行严格的检验或验证(Singh, 2016b)。
2产生根压的植物类群
作为一种常见的生理现象,根压广泛存在于多种植物中(Zachary, 2009)。例如在木本植物中,具有明显根压的物种有糖枫(Acer saccharum)(Sperry et al., 1988)、桦树(Betula lenta和B. populifolia) (Sperry, 1993)、胡杨(Populus euphratica)(司建华等,2007)、栎树(Quercus robur)(Steudle & Meshcheryakov, 1996)、核桃(Juglans regia)(Améglio et al., 2001)。一些重要的农业经济作物,如番茄(Solanum lycopersicum)(White, 1938)、葡萄(Vitis vinifera)(Sperry et al., 1987)、向日葵(Helianthus annuus)(Dustmamatov et al., 2004)、猕猴桃属(Actinidia)(Clearwater et al., 2007)植物等也具有根压。Fisher等(1997)研究发现热带109种藤本植物中有61种具有根压,且15种具有黎明前吐水现象;王华芳(2015)也发现云南西双版纳热带雨林常见的32种木质藤本均具有根压,这表明根压是藤本植物中常见的生理现象。在草本植物中,香蕉(Musa nana)(Davis, 1961)、非洲虎尾草(Chloris gayana)、梯牧草(Phleum pratense) (Ogata et al., 1985)、蕨类(Pentagramma triangularis和Pellaea andromedifolia) (Holmlund et al., 2020)、甘蔗(Saccharum officinarum)(Neufeld et al., 1992)、草甸羊茅(Festuca pratensis)、玉米(Zea mays)(Lu et al., 2002)、水稻(Oryza sativa)(Stiller et al., 2003)等存在根压,特别是在缺乏次生生长且木质化程度较高的一些草本植物(如棕榈、竹子)中,根压较为明显(Davis, 1961; Wang et al., 2011; Cao et al., 2012;Yang et al.,2015)。
3根压的测定方法
目前根压的测定方法有多种(表1),我们可以将其归纳为直接和间接两种测定方式。其中,直接测定包括损伤和非损伤的测定技术;间接测定是通过非损伤技术测定叶片厚度或夜间茎干直径的微小变化程度,然后利用相关模型将实际测量值与预测值进行比较,从而计算得出根压大小。
3.1 直接测定
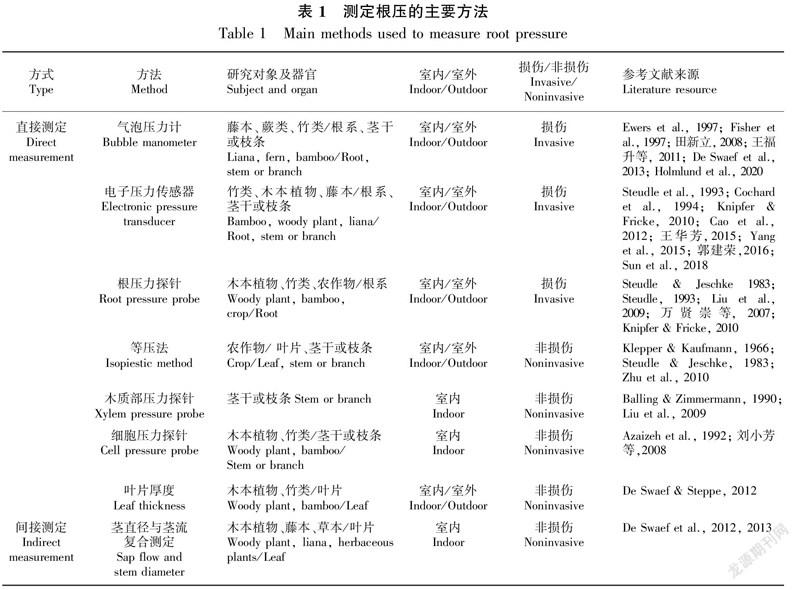
3.1.1 损伤测定技术损伤测定包括压力计法、根压力探针技术以及根压力室技术等。压力计法可通过气泡压力计(bubble manometer)直接测定枝条桩或离体根段的压力(田新立, 2008; 王福升等, 2011; De Swaef et al., 2013)。具体操作方法:用酒精灯将玻璃毛细管的一端封死,注蒸馏水至该毛细管内的1/3处,并套紧硅胶软管后再将毛细管注满水,做成简易气泡压力计。于前一天太阳落山后,将选取好样本的枝条或茎干截去,截面用单面刀片削平整后选取大小合适的硅胶软管套紧在枝条桩或茎干桩上,最后向这个硅胶软管注满蒸馏水并将气泡压力计连接该软管(图1)。在该装置连接一个夜晚后,在第二天日出前用“T”字型短尺分别测量与大气压平衡前后玻璃毛细管内气泡的长短(长度),计算公式(Ewers et al., 1997; Singh, 2016b)如下:
P= 100×[( L/ L)-1]。
式中:P表示根压或样本木质部压力的大小(kPa);L表示与外界大气平衡后玻璃毛细管内气泡的长度(mm);L表示与外界大气平衡前玻璃毛细管内气泡的长度(mm)。由于气泡压力计操作简单和成本较低,当研究物种较多时,它曾被广泛使用,但该方法具有一定的局限性,即只能测定凌晨时段的根压(Wang et al., 2011; 郭建荣,2016; Singh, 2016b)。
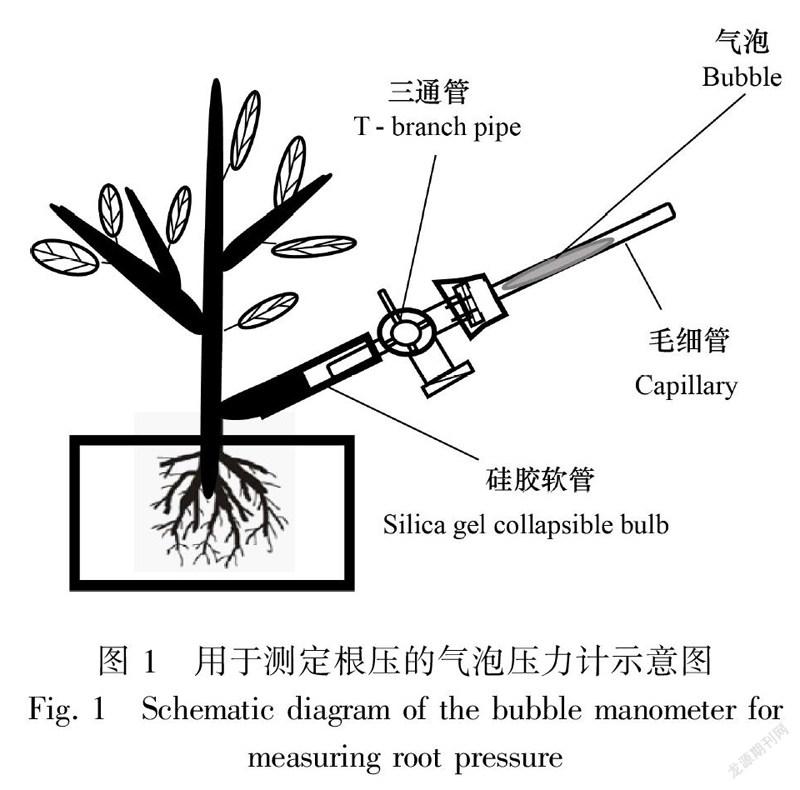
电子压力传感器的应用为连续测定根压带来极大便利(Cao et al., 2012; Yang et al., 2015)。先在植物茎干基部用枝剪剪断由茎干延伸的枝条,并对保留的枝条桩横切面用新单面刀片切割几次(用以去除被挤压变形的木质部),然后将枝条桩与盛满蒸馏水的硅胶软管连接,同时该软管通过三通管连接一个电子压力传感器(图2)(在连接使用前,压力传感器需在实验室进行相关系数的校准)。根压的测定将从前一天傍晚开始一直持续到第二天上午,同时需确保正确连接仪器和测定整个过程中装置内没有气泡且密闭性良好。由于白天蒸腾耗水强烈,即使傍晚光照强度较低,叶片很可能因没有完全停止气孔蒸腾导致枝条桩吸取硅胶软管内蒸馏水并产生气泡。因此,在连接好装置后,电子压力传感器的信号线需连上数据采集器查看数据是否正常。若发现异常,则需检查连接压力传感器的硅胶软管是否存在气泡;若有气泡,则需及时排除或重新连接。
根压力探针技术也可测定枝条或离体根段的木质部压力(Steudle et al., 1993; 万贤崇等, 2007; Knipfer & Fricke, 2010)。在测定枝条时,将枝条第一片叶片下方的枝条切断后,在剩下的枝条上固定一个压力探针,用橡胶密封住微型压力传感器,几小时后即可测定根压的大小(Steudle & Jeschke, 1983)。而在测定离体根段时,先在水下切除植物个体的根(确保根顶端部分未被损伤),将根通过一个不透气的硅胶密封连接带有压力传感器的测定设备,并使根部压力保持稳定,大约数小时后测定系统便建立起稳定的压力。另外,根系真空灌注法(Knipfer & Fricke, 2010)和外用气压法(Singh, 2016b)也属于根压力探针技术的范畴。虽然根压探针技术在野外操作不易,但能实时连续测定根压,因此,它是目前常用的方法之一(Steudle et al., 1993; Henzler et al., 1999)。
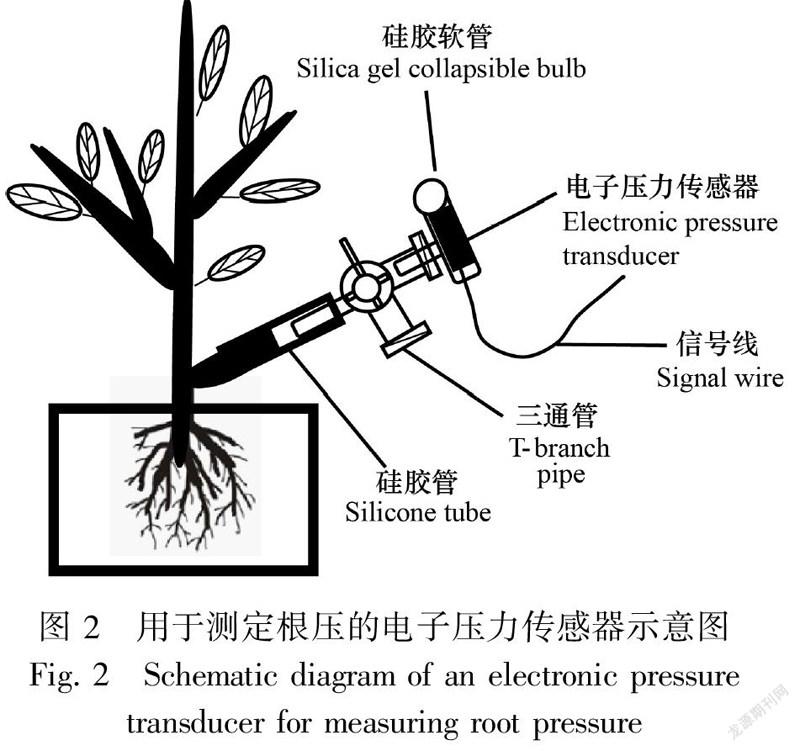
3.1.2 非损伤测定技术非损伤测定技术包括等压法、木质部压力探针技术、细胞压力探针技术等。等压法是将不同浓度的非渗透溶液分别加入带根的培养基中,观察吐水过程,当吐水结束时就可认为根压的大小与溶液渗透势的数值相等(Klepper & Kaufmann, 1966; Steudle & Jeschke, 1983; Zhu et al., 2010)。木质部压力探针技术可以直接测量植株木质部压力、液流和溶质组成的日变化和季节变化(Balling & Zimmermann, 1990; Liu et al., 2009)。Clearwater等(2007)通过安装在猕猴桃根系木质部中的压力传感器测定根压。由一个压力传感器通过一个有机玻璃腔体连接到一个尖端通过高温拉制而成的锥形玻璃毛细管(直径为10 μm),毛细管及腔内充满除去气泡的蒸馏水。测定时,将毛细管尖端在显微镜下刺入植物根系的木质部导管后即可开始记录导管内汁液的压力变化(图3)。
细胞压力探针技术把压力传感器和金属杆密封连接到充满硅油的微型压力室,然后把毛细管装满硅油也连接到微型压力室,使探针插入到单个细胞中。通过螺旋钮操纵金属杆来改变弯月面位置可以引起膨压变化从而形成压力梯度(Azaizeh et al., 1992; 刘小芳等,2008)。该方法具有一定的局限性,即在整个安装过程中不仅要确保整个密封系统内没有气泡,并选取大小适合的根系细胞作为测定对象,而且还要防止压力探针被堵塞和刺穿细胞等。
3.2 间接测定
根压的间接测定是应用其他非损伤的测定技术。有学者提出将实际测量得到的叶片厚度或茎干直径的微小变化程度与相关模型预测的值进行比较。他们认为若夜间叶片厚度或茎干直径大小的测量值高于相关模型的预测值,则认为是植物产生的根压造成了叶片厚度或茎干直径在预测值和测量值之间的差值(De Swaef & Steppe, 2012; De Swaef et al., 2012, 2013)。目前,已有的叶片膜片钳压力探针技术和精确度较高的线性变量位移传感器(LVDTs)可用来分别测定叶片厚度和茎干直径的微变化(De Swaef & Steppe, 2012)。研究者们根据相关模型可以通过这两项技术间接获得植物根压的大小。然而,由于叶片厚度或茎干直径大小的微小变化不一定都能被仪器设备所检测到,因此,该方法的實际应用也存在一定的局限性(Singh, 2016b)。
综上所述,目前还没有任何一种技术能够完全满足所有条件,并且简单而准确地测定植物的根压。因此,Singh(2016b)提出需要综合考虑植物的不同类型、年龄结构特征或生存策略的差异,开发一种简易操作、价格低廉、测定结果可靠且适用于所有情况的根压的非损伤测定技术。
4根压的大小
与蒸腾拉力相比,根压造成的水流相对较小,尤其是在蒸腾拉力较高的情况下,当溶质被流入木质部的水分稀释后,根压则倾向于消失但并不是不存在(Singh, 2016b)。除此之外,当空气或土壤相对温暖湿润、早春时节的植物叶片还未展开时,根压会很明显,但当叶片展开后,植物体内的水分快速流动,根压就无法被直接检测到(Singh, 2016b)。之前有学者研究植物吐水或伤流的速率或体积,发现许多植物的根部在某些特定条件下会产生大小不同的根压,并显示不同的日间或季节差异(Kramer & Kozlowski,1979; Kundt & Gruber,2006)。這些大小差异也可能是根压测定技术的不同而造成的(Singh, 2016b),例如,利用根压探针技术测定根压大小范围在0~500 kPa之间,比利用压力室测定的根压大小范围偏大(Wei et al., 1999)。物种差异也在一定程度上影响了植物根压的大小。例如,孝顺竹(Bambusa multiplex)的最大根压为18.5 kPa,矢竹(Pseudosasa japonica)的最大根压为28.8 kPa,金镶玉竹(Phyllostachys aureosulcata)的最大根压为8.0 kPa(王福升等,2011)。除根压测定技术及植物种间差异外,有研究提出了在探讨根压的大小时还需要考虑植株自身的高度。例如,在高度为18 m的Doliocarpus brevipedicellatus茎干基部附近测得根压为64 kPa,而64 kPa的根压只能将水分推送到7.1 m的高度,因此,在该植株7.1 m处及以上位置高度处测得的木质部压力趋于零(Scholander et al., 1957; Ewers et al., 1997)。总之,在不同地区、不同季节,根压的大小也会因不同物种而存在差异。例如,番茄的根压能达到600 kPa,某些禾草的根压高达1 000 kPa,某些沙漠植物的根压达到6 000 kPa (White et al., 1958; Kundt & Gruber, 2006)。由此可见,根压是常见的一种生理现象,其大小在空间和时间上均有所不同 (Scholander et al., 1957; Putz 1983; Cochard et al., 1994; Ewers et al., 1997; Tyree, 2003a, b; Kundt & Gruber, 2006; Zwieniecki & Holbrook, 2009; Wang et al., 2015)。
5影响根压的主要因素
内皮层细胞上的转运蛋白导致离子从质外体途径进入共质体途径,造成内外皮层存在渗透差,水分沿这种渗透差进入内皮层(Maurel et al., 2008; 潘瑞炽,2012)。水分运输除了依赖这种渗透差外,根压的产生也依赖这种内外皮层的渗透差,故任何影响转运蛋白的因素都会间接影响根压的有无及其大小。另外,有研究发现根压的产生和大小会因遗传因素、土壤因素及其他环境因子的变化而各不相同(White et al., 1958; Kundt & Gruber, 2006)。
5.1 水通道蛋白因素
就根系吸水调控而言,植物具有被称为AQP的水通道蛋白家族(major intrinsic protein, MIP)。AQP存在于植物的不同部位,根部70%~80%的水分由AQP来运输,因此,AQP是水分进入植物细胞的主要调控位点(于秋菊等,2002),其表达水平与根压大小显著相关(Sun et al., 2018)。大量研究表明,除受水分子动能的影响外,植物AQP活性还受水通道门控(gating)的调控(Quiroga et al., 2019)。直接影响水通道门控的因素有磷酸化、聚合调控、糖基化、甲基化、阳离子、渗透压和溶质梯度等(Maurel et al., 2008; Gheorghe, 2010)。
磷酸化是AQP活性调控的一种重要方式。活体试验、质谱分析及免疫检测均表明植物AQP的3个亚类,PIP、TIP和NIP都能够被磷酸化(Kaldenhoff & Fischer, 2006; 李红梅等, 2010; 张璐和杜相革,2014)。AQP单体发生异聚化也可调控AQP活性,例如在玉米(Heinen et al., 2009)、烟草(Nicotiana tabacum)(Gheorghe, 2010)、含羞草(Mimosa pudica)(李红梅等,2010)中都有研究发现不同质膜内在蛋白相互作用下形成的异源四聚体能增加膜对水分的渗透性。AQP的糖基化和甲基化作用也参与AQP活性调节。前人运用免疫荧光标记已经证明,甘露醇诱导的渗透胁迫可导致冰叶日中花(Mesembryanthemum crystallinum)水通道蛋白亚家族TIP的McTIP1;2在液泡膜上的重新分布且涉及它的糖基化和cAMP-依赖的信号转导(Vera-Estrella et al., 2004; 李红梅等,2010)。Ye & Wiera(2004)研究发现,高浓度渗透溶质控制水通道蛋白开关的机制可能是内聚力-张力模式,渗透溶质被排出通道从而引起通道孔内张力发生变化,蛋白变形后导致通道开关关闭。植物根系导水率会受AQP活性变化的影响,例如用HgCl2处理后根系导水率明显下降(Wan & Zwiazek, 1999; Javot & Maurel, 2002)。在AQP的NPA区域有对Hg2+敏感的保守Cys残基,Hg2+与之结合可改变蛋白空间构象,导致水通道受阻从而影响水分子的转运,抑制水分的跨膜流动(张璐和杜相革,2014)。另外,在植物木质部栓塞修复过程中,木质部周边薄壁细胞的AQP表达增加或活性增加可能有助于促进水分进入管腔并降低水势(Brodersen & Mcelrone, 2010)。尽管AQP与根系水分吸收有着密切联系(Baiges et al., 2002; Aroca et al., 2012),但是植物产生根压的过程是否涉及AQP基因的激活或相对表达水平的增加,仍有待进一步研究。
5.2 遗传因素
在自然界中,根压产生和调控的遗传因素对根压大小具有一定影响(Mitchell et al., 1991; Dorais et al., 2001; Lafitte & Courtois, 2002)。例如,对不同品种水稻幼苗吐水和伤流量的研究已表明晚熟水稻比早熟水稻吐水量多(Fujii & Tanaka, 1957)。郭建荣(2016)通过对比四种基因型的离体杨树苗木,发现不同基因型之间根压最大值也存在显著性差异。另外,Sun等(2018)在基因组与竹笋保持水分平衡关系的研究中提出相关基因参与了根压的调控,并用毛竹幼苗原位杂交实验证明了与根压有关的两个基因分别是PeTIP4;1和PeTIP4;2。
5.3 土壤因素
5.3.1 土壤温度和根系周围的温度如前所述,根压是一个与能量相关的过程,参与根系活动的酶类会受温度调控,通过影響根系呼吸代谢和水分运输而影响根压产生。土壤温度和根系周围的温度升高或降低是直接影响酶活性的重要因素。当土壤温度下降时,植株根系最大根压值会降低,且将根的温度从15 ℃冷却到4 ℃时,植物叶片会停止吐水,而将温度升高时,其吐水速率则会上升(Pedersen, 1993; Ewers et al., 2001; 郭建荣和万贤崇, 2017a,b)。因此,根压会受土壤温度和根系周围温度的影响(Singh, 2016b)。
5.3.2 土壤水分及矿质元素土壤水分变化会对根压的产生和大小造成一定的影响(Zarebanadkouki et al., 2018)。当植物受到干旱胁迫,水分含量低于45%时,生长在沙土中的锦紫苏(Coleus scutellarioides)、向日葵和番茄就不会再产生根压(Zaitseva & Minashina, 1998)。若复水,植物又开始产生根压(Singh, 2016b)。另外,水稻的吐水量会随叶片水势的升高而增加,这表明降低根部土壤水分可能会影响根系水通道蛋白的活性或是抑制水分进入内皮层细胞(Katsuhara et al., 2008; Heinen et al., 2009)。除土壤水分的影响外,土壤中矿质元素也是影响根压的另一重要因素。在研究核桃根压时,Ewers等(2001)发现土壤矿质元素尤其是硝酸盐减少时,核桃的木质部压力在60~100 kPa之间,而当增加硝酸盐浓度后的4 h内木质部压力便增至130 kPa。
5.4 其他环境因素
王华芳等(2015)对藤本植物的研究发现,当光合有效辐射在一定范围内升高时,增强的植物蒸腾作用所产生的负压会增加,导致根压快速下降,且与光合有效辐射升高几乎保持时间同步。当夜间饱和水汽压差和蒸腾速率处于最低水平且基本保持不变时,根压值会维持在较高水平,但正午时刻的饱和水汽压差达到最大时,根压值则基本处于最低状态。针对降雨量对根压的影响,前人的研究已表明藤竹(Rhipidocladum racemiflorum)的根压在降雨后会立即升高(Cochard et al., 1994),但王华芳(2015)研究发现降水对根压的影响甚微。因此,降雨对根压的影响程度还有待深入研究。
6根压的意义和影响
6.1 根压在生理生态学方面的意义和影响
在干旱地区,因降雨稀少产生的水分胁迫限制了植物的生长发育,严重时甚至会导致植物死亡。植物在水分胁迫时,木质部导管或管胞在巨大的张力作用下容易导致气泡进入管腔而形成气穴,严重的气穴则会形成栓塞,导致植物水分运输功能丧失,最终使得植物体内水分亏缺,蒸腾速率下降,气孔关闭等(Tyree & Zimmermann, 2002; Gullo, 2010; Klein et al., 2018)。根压已被证明是在水分亏缺时植物修复栓塞化导管的一种重要生理机制(Yang et al., 2012; Gleason et al., 2017; Holmlund et al., 2020; Cuneo et al., 2020)。例如:一些沙漠植物的根压(高达6 MPa)能够保障植物从干旱的土壤中吸收水分,并使其生态适应能力增强(White et al., 1958; Kundt & Gruber, 2006);竹子、棕榈等木质化程度较高的单子叶植物,由于其自身缺乏次生生长,当水力功能丧失时,并不能像其他木本植物一样,通过形成层产生新的木质部来替代栓塞化的导管,根压对此类植物修复因水分亏缺导致的栓塞化导管就显得尤为重要(Saha et al., 2009; Yang et al., 2012);Wang等(2011)监测了分布于热带和亚热带53种亚洲竹种的根压,结果表明监测的所有竹种均具有根压,其中一些竹种较大的根压能使叶片发生夜间吐水现象;竹子通过夜间根压能修复栓塞化的导管,使其水力功能保持完整,有助于植株在水分亏缺时仍能存活和生长(Cao et al., 2012; Yang et al., 2012)。
在温带森林中,冻融交替现象普遍存在,即低温使植物木质部导管或管胞内的汁液结冰,汁液内的气泡因不溶于冰而被析出,木质部管腔内就会产生气穴;当气温回升导致木质部冰晶融化时,气泡在木质部负压的作用下扩大体积,造成导管栓塞而威胁植物生长(Tyree & Sperry, 1989; Gullo, 2010; Choat et al., 2011)。已有研究发现根压是修复冻融交替导致的木质部栓塞的一种重要机制(Tyree & Yang, 1992)。例如,桦木(Betula papyrifera)在早春展叶前利用根压修复栓塞化的导管,恢复导管的水分传导功能(Hao et al., 2013)。又如针对长白山自然保护区常见的三类功能型(只产生根压、同时产生根压和茎压、不产生根压和茎压)温带散孔材和环孔材树种的水力结构特性进行研究,发现相比于不产生根压和茎压的树种,只产生根压和同时产生根压与茎压的树种均有较强的冻融疲劳抗性,更能修复冬季低温造成的栓塞化导管,但同时产生根压和茎压的树种水力导度较低,只产生根压的树种对干旱引起的气穴化抗性较低,这表明不同功能型树种应对木质部栓塞的策略不同,木质部导水安全性与高效性之间的权衡促使这三类功能型树种在冻融交替现象常见的温带地区能共存(Yin et al., 2018)。
已有研究发现木质藤本在热带森林中的空间分布范围比在温带森林中更为广泛,但造成木质藤本这种分布格局差异的原因仍不清楚(Gentry, 1991; Jiménez-Castillo & Lusk, 2013)。较大直径的木质部导管在温带地区更可能遭受冻融交替导致的栓塞(Cochard & Tyree, 1990; Sperry & Sullivan, 1992; Sperry et al., 1994),而热带地区的木质藤本具有较粗的导管(Ewers & Fisher, 1991)。目前,还不清楚热带藤本较粗的导管是否能通过茎干的生长或周期性的修复而避免栓塞(Cobb et al., 2007; Lens et al., 2013)。然而,如果木质藤本这类多年生的植物无法通过根压修复栓塞化的导管,则其分布可能会被限制在水分充足且没有结冰低温的生境中。就木质藤本的全球分布格局而言,其丰富度与纬度之间存在显著的负相关关系。因此,根压似乎对木质藤本植物生态适应及物种分布范围起一定的作用。
植物根系对矿质元素的主动吸收会造成渗透势,从而使水分发生定向流动并在根部产生根压。研究表明根压能够修复木质部的栓塞及补充植物茎干的水分(Zhao et al., 2017; Nardini et al., 2018; Yin et al., 2018)。在蒸腾作用没有或很弱的条件下,植物根系会产生正的木质部压力,推动水分沿着导管或管胞向上运输,使气泡溶解或水分再填充进而修复栓塞化导管。例如,根压是葡萄藤、竹子等植物在夜间修复栓塞化导管的主要机制(Yang et al., 2012; Knipfer et al., 2015; Brodersen et al., 2017)。像竹子这样相对高大的草本植物能依靠最大根压修复植株冠层输导组织的栓塞,进而影响植株茎秆的最大生长高度(Cao et al., 2012)。在发生栓塞的导管中,若根压不足以驱动水分到达冠层,则其针对栓塞的修复功能有限。例如,藤本植物的根压变化范围一般在2~148 kPa之间(Ewers et al., 1997; Fisher et al., 1997; Tibbetts & Ewers, 2000; 王华芳,2015),表明其最大根压只能将导管内部的水柱推到14 m的高度,而藤本植物的高度大多高于14 m,因此,推测根压对高于14 m的藤本植物中气穴化导管的修复作用有限(王华芳,2015)。另外,夜间根压被认为对水稻木质部栓塞化导管的修复很重要(Stiller et al., 2003)。因此,我们可以利用根压对栓塞化导管的修复能力来甄选耐旱的水稻品种,因为低的根压与水稻的干旱敏感性有关(Lafitte & Courtois, 2002)。
正的根压能积极地驱动水分向上运输,对白天因过度蒸腾而导致水分亏缺的储水组织进行水分补充(Yang et al., 2015; Zhao et al., 2017; Wu et al., 2019)。例如,正的根压是瓜多竹(Guadua angustifolia)水分运输和水分补充的一种主要驱动力(Zachary, 2009)。根压不但能为水稻等农作物的枝叶提供水分(Singh et al., 2009),而且能对因春季无叶片导致无蒸腾拉力的树木补充水分(Sperry et al., 1987)。因此,根压能够防止农作物和树木因水分亏缺而倒伏(Sperry et al., 1987; Clearwater et al., 2007)。
另外,根压还可用来追踪营养元素和激素在植物各器官中的转移和运输(Lafitte & Courtois, 2002; Lian et al., 2004; Singh & Singh, 2013),或者提高蛋白质、化感物质以及根部重金属鳌合物的重组和运输等(Komarnytsky et al., 2000; Xiao et al., 2006; Singh & Singh, 2013; Singh, 2016b)。例如,有学者通过检测具有根压的卷心菜,在其叶片吐水液中发现了钙离子的积累(Tibbitts, 1977)。在大麦的叶片尖端气孔保卫细胞上,发现有大量细菌聚集并存在于吐水液中,而这些吐水液除了含有无机盐外,还含有糖、氨基酸和维生素等(Dieffenbach et al., 1980)。
6.2 根压在农艺学方面的意义和影响
虽然根压对于较高的木本、藤本、竹类、落叶植物的栓塞修复可能存在着一定的局限性,但是,对于农业园艺作物,如植株矮小的核桃、番茄、莴苣(Lactuca sativa)等可能具有重要作用(Singh & Singh, 1989; Tanner & Beevers, 1999; Singh et al., 2009)。即使根压不能完全修复发生栓塞的导管,也可为这些农业及园艺作物的水分运输提供补充(Fisher et al., 1997; Zachary, 2009; Yang et al., 2015)。然而,随着当前全球气候变暖,减少能源使用已成为温室栽培中的重要问题之一。荷兰已是世界上最大的温室产业国,大约6 000家公司在10 500 hm2土地上实现了超过70亿欧元的产值,占其农业总产值的40%。荷兰每平方米的温室年均消耗约为40 m3的天然气,消耗总量为42亿m3的天然气,占据消费总额的10%。由此可见,能够控制温湿度的温室使用了大量能源(Heuvelink et al., 2008)。因此,很有必要發展新的节能策略和作物管理方式,并使温室栽培作物在适宜条件下产生最利于其生长的根压 (Jackson et al., 2000; Heuvelink et al., 2008; Singh, 2016b)。如果温室通过大量耗能的方式始终保持恒定的环境条件,根压的过度发生可能会影响农产品的收获量(Jackson et al., 2000; Heuvelink et al., 2008; Singh, 2016b)。根压也与植物的某些病害有关(Johnson, 1936)。例如,根压的增加可能会导致植物细胞的破裂,从而使病菌乘虚而入,逐渐扩散并造成植物组织受损(Johnson, 1936)。将压力较高的水分直接作用于植物,植株根系会在短时间内迅速出现不同程度的肿胀、吐水和浸泡的现象,使受到浸泡的番茄和烟草根系极易感染细菌(Johnson, 1936)。此外,过高的根压可能会使番茄或莴苣发生生理功能失调,影响水果蔬菜的品质(Maaswinkel & Welles, 1986; Dorais et al., 2001; De Swaef et al., 2013)。因此,需要研究并确定农作物所需要的根压适合范围(Singh, 2016b)。但到目前为止,对于大多数农作物所需要的根压适合范围和驱动及影响根压产生的诸多环境因子等问题还有待进一步研究。
7問题和展望
基于上述对植物根压研究的归纳和总结,根压的未来研究可从以下几个方面进行。
(1)改进根压的测定技术。目前,还没有任何一种技术能够完全满足所有条件的应用,能够简单且准确地测定根压大小。因此,需要针对植物的不同类型、生长特征和实际情况等,研发或改进出简单可靠且价格低廉的实用技术,从而实现连续动态的准确测定根压。
(2)阐明植物根压与栓塞修复机制的关系。由于干旱诱导和冻融交替会使某些植物面临输水系统中栓塞的威胁和水分亏缺,有根压存在的植物能够及时修复水力系统功能,恢复正常的水分供应,但没有根压的植物也能与产生根压的植物共存,这意味着根压可能与其他影响木质部栓塞抗性的因素共同决定着不同生态型植物类群的自然分布特性。
(3)揭示根压的临界阈值。未来气候变化会使温室栽培的可利用资源面临巨大挑战,如根压的过度发生将可能影响农作物收成。因此,需要研究并确定大多数农作物需要的根压适合范围或临界阈值,从而为未来创造农作物所需根压的发生环境、育种栽培及丰产丰收等提供重要参考依据。
参考文献:
AMEGLIO T, EWERS FW, COCHARD H, et al., 2001. Winter stem xylem pressure in walnut trees: effects of carbohydrates, cooling and freezing [J]. Tree Physiol, 21(6): 387-394.
AROCA R, PORCEL R, RUIZ-LOZANO JM, 2012. Regulation of root water uptake under abiotic stress conditions [J]. J Exp Bot, 63(1): 43-57.
AZAIZEH H, GUNSE B, STEUDLE E, 1992. Effects of NaCl and CaCl2 on water transport across root cells of maize (Zea mays L.) seedlings [J]. Plant Physiol, 99(3): 886-894.
BAIGES I, SCHAFFNER AR, AFFENZELLER MJ, et al., 2002. Plant aquaporins [J]. Physiol Plant, 115(2): 175-182.
BALLING A, ZIMMERMANN U, 1990. Comparative measurements of the xylem pressure of Nicotiana plants by means of the pressure bomb and pressure probe [J]. Planta, 182(3): 325-338.
BAI XF, ZHU JJ, 2013. Techniques and methods for the practical use of xylem pressure probes [J]. Plant Sci J, 31(6): 603-608. [柏新富, 朱建军, 2013. 植物木质部压力探针测定技术与方法 [J]. 植物科学学报, 31(6): 603-608.]
BRODERSEN CR, KNIPFER T, MCELRONE AJ, 2017. In vivo visualization of the final stages of xylem vessel refilling in grapevine (Vitis vinifera) stems [J]. New Phytol, 217(1): 117-126.
BRODERSEN CR, MCELRONE AJ, 2010. The dynamics of embolism repair in xylem: in vivo visualizations using high-resolution computed tomography [J]. Plant Physiol, 154(3): 1088-1095.
CAO KF, YANG SJ, ZHANG YJ, et al., 2012. The maximum height of grasses is determined by roots [J]. Eco Lett, 15(7): 666-672.
CHOAT B, MEDEK DE, STUART SA, et al., 2011. Xylem traits mediate a trade-off between resistance to freeze-thaw-induced embolism and photosynthetic capacity in overwintering evergreens [J]. New Phytol, 191(4): 996-1005.
CLEARWATER MJ, BLATTMANN P, LUO Z, et al., 2007. Control of scion vigour by kiwifruit rootstocks is correlated with spring root pressure phenology [J]. J Exp Bot, 58(7): 1741-1751.
COBB AR, CHOAT B, HOLBROOK NM, 2007. Dynamics of freeze-thaw embolism in Smilax rotundifolia (Smilacaceae) [J]. Am J Bot, 94(4): 640-649.
COCHARD H, EWERS FW, TYREE MT, 1994. Water relations of a tropical vine-like bamboo (Rhipidocladum racemiflorum): root pressures, vulnerability to cavitation and seasonal changes in embolism [J]. J Exp Bot, 45(277): 1085-1089.
COCHARD H, TYREE MT, 1990. Xylem dysfunction in Quercus: vessel sizes, tyloses, cavitation and seasonal changes in embolism [J]. Tree Physiol, 6(4): 393-407.
CUNEO IF, BARRIOS-MASIAS F, KNIPFER T, et al., 2020. Differences in grapevine rootstock sensitivity and recovery from drought are linked to fine root cortical lacunae and root tip function [J]. New Phytol, 229(1): 272-283.
DAVIS TA,1961. High root pressure in palms [J]. Nature, 192(4799): 227-228.
DE SWAEF T, HANSSENS J, CORNELIS A, et al., 2013. Non-destructive estimation of root pressure using sap flow, stem diameter measurements and mechanistic modeling [J]. Ann Bot, 111(2): 271-282.
DE SWAEF T, STEPPE K, 2012. Sap flow, stem diameter variations and mechanistic modelling have potential to assess root pressure [J]. Acta Hortic, 951(951): 111-115.
DE SWAEF T, VERBIST K, CORNELIS W, 2012. Tomato sap flow, stem and fruit growth in relation to water availability in rockwool growing medium [J]. Plant Soil, 350(1): 237-252.
DIEFFENBACH H, KRAMER D, LTTGE U, 1980. Release of guttation fluid from passive hydathodes of intact barley plants. I. structural and cytological aspects [J]. Ann Bot, 45(4): 397-401.
DIXON HH, 1914. Transpiration and the ascent of sap in plants [J]. Nature, 94(2360): 558-559.
DONG ZM, 2003. The nature of root pressure [J]. Acta Bot Boreal-Occident Sin, 23(7): 1098-1104. [董忠民, 2003. 根壓的本质 [J]. 西北植物学报, 23(7): 1098-1104.]
DORAIS M, PAPADOPOULOS AP, GOSSELIN A, 2001. Greenhouse tomato fruit quality [M]//JANICK J. Horticultural Reviews. New York: John Wiley & Sons, lnc, 26: 239-319.
DUSTMAMATOV AG, ZHOLKEVICH VN, 2008. Effects of HgCl2 on principal parameters of exudation from maize detached root systems [J]. Russ J Plant Physl, 55(6): 814-820.
DUSTMAMATOV AG, ZHOLKEVICH VN, KUZNETSOV VV, 2004. Water pumping activity of the root system in the process of cross-adaptation of sunflower plants to hyperthermia and water deficiency [J]. Russ J Plant Physl, 51(6): 822-826.
ENSTONE DE, PETERSON CA, MA F, 2003. Root endodermis and exodermis: structure, function, and responses to the environment [J]. J Plant Growth Regul, 21(4): 335-351.
EWERS FW, AMGLIO T, COCHARD H, et al., 2001. Seasonal variation in xylem pressure of walnut trees: root and stem pressures [J]. Tree Physiol, 21(15): 11-23.
EWERS FW, COCHARD H, TYREE MT, 1997. A survey of root pressures in vines of a tropical lowland forest [J]. Oecologia, 110(2): 191-196.
EWERS FW, FISHER JB, 1991. Why vines have narrow stems: histological trends in Bauhinia (Fabaceae) [J]. Oecologia, 88(2): 233-237.
FISHER JB, ANGELES GA, EWERS FW, et al., 1997. A survey of root pressure in tropical vines and woody species [J]. Int J Plant Sci, 158(1): 44-50.
FRANK WT, 2006. A unified hypothesis of mechanoperception in plants [J]. Am J Bot, 93(10): 1466-1476.
FUJII Y, TANAKA N,1957. Intensity of guttation in rice seedlings in relation to earliness or lateness of the variety [J]. Jpn J Crop Sci, 25(3): 131-132.
GAMBA G, 2005. Molecular physiology and pathophysiology of electroneutral cation-chloride cotransporters [J]. Physiol Rev, 85(2): 423-493.
GENTRY AH, 1991. The distribution and evolution of climbing plants [M]//PUTZ FE, MOONEY HA. The Biology of Vines. Cambridge: Cambridge University Press: 3-50.
GHEORGHE B, 2010. Water channel proteins (later called aquaporins) and relatives: past, present, and future [J]. Iubmb Life, 61(2): 112-133.
GLEASON SM, WIGGANS DR, BLISS CA, et al., 2017. Embolized stems recover overnight in Zea mays: the role of soil water, root pressure, and nighttime transpiration [J]. Front Plant Sci, 8: 662.
GULLO ML, 2010. Different vulnerabilities of Quercus ilex L. to freeze-thaw and summer drought-induced xylem embolism: an ecological interpretation [J]. Plant Cell Environ, 16(5): 511-519.
GUO JR, 2016. Researching of root pressure and its diurnal rhythm of 84K pupolar and the influencing factors [D]. Beijing: Chinese Academy of Forestry Sciences. [郭建榮, 2016. 木本植物银腺杨根压及其昼夜周期与影响因素的研究 [D]. 北京: 中国林业科学研究院.]
GUO JR, WAN XC, 2017a. Circadian rhythm of popular root pressure and the influencing factors [J]. Chin J Plant Ecol, 41(3): 369-377. [郭建荣, 万贤崇, 2017a. 杨树根压昼夜周期性及其影响因子 [J]. 植物生态学报, 41(3): 369-377.]
GUO JR, WAN XC, 2017b. Circadian rhythm of root pressure in intact poplar seedlings and the influencing factors [J]. Sci Silv Sin, 53(10): 22-28. [郭建荣, 万贤崇, 2017b. 杨树苗木完整植株根压的昼夜节律及其影响因素 [J]. 林业科学, 53(10): 22-28.]
HAO GY, WHEELER JK, HOLBROOK NM, et al., 2013. Investigating xylem embolism formation, refilling and water storage in tree trunks using frequency domain reflectometry [J]. J Exp Bot, 64(8): 2321-2332.
HEINEN RB, YE Q, CHAUMONT F, 2009. Role of aquaporins in leaf physiology [J]. J Exp Bot, 60(11): 2971-2985.
HENZLER T, WATERHOUSE RN, SMYTH AJ, et al., 1999. Diurnal variations in hydraulic conductivity and root pressure can be correlated with the expression of putative aquaporins in the roots of Lotus japonicus [J]. Planta, 210(1): 50-60.
HEUVELINK E, BAKKER MJ, MARCELIS LFM, et al., 2008. Climate and yield in a closed greenhouse [J]. Acta Hortic, 801(801): 1083-1092.
HOLMLUND HI, DAVIS SD,EWERS FW, et al., 2020. Positive root pressure is critical for whole-plant desiccation recovery in two species of terrestrial resurrection ferns [J]. J Exp Bot, 71(3): 1139-1150.
JACKSON RB, SPERRY JS, DAWSON TE, 2000. Root water uptake and transport: using physiological processes in global predictions [J]. Trends Plant Sci, 5(11): 482-488.
JAVOT H, MAUREL C, 2002. The role of aquaporins in root water uptake [J]. Ann Bot, 90(3): 301-313.
JOHNSON J, 1936. Relation of root pressure to plant disease [J]. Science, 84(2171): 135-136.
JIMNEZ-CASTILLO M, LUSK CH, 2013. Vascular performance of woody plants in a temperate rain forest: lianas suffer higher levels of freeze-thaw embolism than associated trees [J]. Funct Ecol, 27(2): 403-412.
KALDENHOFF R, FISCHER M,2006. Functional aquaporin diversity in plants [J]. Biochim Biophys Acta, 1758(8): 1134-1141.
KATSUHARA M, HANBA YT, SHIRATAKE K,et al., 2008. Expanding roles of plant aquaporins in plasma membranes and cell organelles [J]. Funct Plant Biol, 35(1): 1-14.
KLEIN T, ZEPPEL MJB, ANDEREGG WRL, et al., 2018. Xylem embolism refilling and resilience against drought-induced mortality in woody plants: processes and trade-offs [J]. Ecol Res, 33(5): 839-855.
KLEPPER B, KAUFMANN MR, 1966. Removal of salt from xylem sap by leaves and stems of guttating plants [J]. Plant Physiol, 41(10): 1743-1747.
KNIPFER TF, EUSTIS A, BRODERSEN C, et al., 2015. Grapevine species from varied native habitats exhibit differences in embolism formation/repair associated with leaf gas exchange and root pressure [J]. Plant Cell Environ, 38(8): 1503-1513.
KNIPFER TF, FRICKE W, 2010. Root pressure and a solute reflection coefficient close to unity exclude a purely apoplastic pathway of radial water transport in barley (Hordeum vulgare) [J]. New Phytol, 187(1): 159-170.
KOMARNYTSKY S, BORISJUK N, BORISJUK L, et al., 2000. Production of recombinant proteins in tobacco guttation fluid [J]. Plant Physiol, 124(3): 927-933.
KRAMER PJ, BOYER JS, 1995. Water relations of plants and soils [M]. Academic Press: Kaedinya: Australia.
KRAMER PJ, KOZLOWSKI TT, 1979. The physiology of woody plants [M]. Orlando: Academia.
KUNDT W, GRUBER E, 2006. The water circuit of the plants. Do plants have hearts? [J]. Quant Biol: 1-19.
LAFITTE HR, COURTOIS B, 2002. Interpreting cultivar × environment interactions for yield in upland rice: assigning value to drought-adaptive traits [J]. Crop Sci, 42(5): 1409-1420.
LENG HN, LU MZ, WAN XC, 2013. Variation in embolism occurrence and repair along the stem in drought-stressed and re-watered seedlings of a poplar clone [J]. Physiol Plant, 147(3): 329-339.
LENS F, TIXIER A, COCHARD H, et al., 2013. Embolism resistance as a key mechanism to understand adaptive plant strategies [J]. Curr Opin Plant Biol, 16(3): 287-292.
LI HM, WANG XR, HE SG, 2010. Recent advances in plant aquaporins [J]. Progr Biochem Biophys, 37(1): 31-37. [李红梅, 万小荣, 何生根, 2010. 植物水孔蛋白最新研究进展 [J]. 生物化学与生物物理进展, 37(1): 31-37.]
LIAN HL, YU X, YE Q, et al., 2004. The role of aquaporin RWC3 in drought avoidance in rice [J]. Plant Cell Physiol, 45(6): 481-489.
LIU BB, STEUDLE E, DENG XP,2009. Root pressure probe can be used to measure the hydraulic properties of whole root systems of corn (Zea mays L.) [J]. Bot Stud, 50(3): 303-310.
LIU XF, ZHANG SQ, YANG XQ, 2008. The pressure probe technique: principles and application in research of plant water relations [J]. Agric Res Arid Areas, 26(4): 172-179. [刘小芳, 张岁岐, 杨晓青, 2008. 压力探针技术原理及其在植物水分关系研究中的应用 [J]. 干旱地區农业研究, 26(4): 172-179.]
LOGVENKOV SA, STEIN AA, 2013. The effect of the casparian band permeability to water and solutes on the root pressure: mathematical modeling [J]. J Biomech, 17(4): 43-52.
LU P, WOO KC, LIU ZT, 2002. Estimation of whole-plant transpiration of bananas using sap flow measurements [J]. J Exp Bot, 53(375): 1771-1779.
MAASWINKEL RHM, WELLES GWH, 1986. Factors influencing glassiness in lettuce [J]. Neth J Agric Sci, 34(1): 57-65.
MAUREL C, VERDOUCQ L, LUU DT,et al., 2008. Plant aquaporins: membrane channels with multiple integrated functions [J]. Ann Rev Plant Biol, 59(1): 595-624.
MITCHELL JP, SHENNAN C, GRATTAN SR, et al., 1991. Tomato fruit yields and quality under water deficit and salinity [J]. J Am Soc Hortic Sci, 116(2): 215-221.
NARDINI A, SAVI T, TRIFIL P, et al., 2018. Drought stress and the recovery from xylem embolism in woody plants [J]. Progr in Bot, 79: 197-231.
NEUFELD HS, GRANTZ DA, MEINZER FC, et al., 1992. Genotypic variability in vulnerability of leaf xylem to cavitation in water-stressed and well-irrigated sugarcane [J]. Plant Physiol, 100(2): 1020-1028.
OERTLI JJ, 1966. Active water transport in plants [J]. Physiol Plant, 19(3): 809-817.
OGATA S, SANEOKA H, MATSUMOTO K,1985. Nutritional-physiological evaluation of drought resistance of warm season forage species: comparative studies on root development water and nutrient absorption of forage species at various soil moisture levels [J]. J Jpn Soc Grassl Sci, 31(1): 263-271.
PAN RC, 2012.Plant physiology [M]. 7th ed. Beijing: Higher Education Press. [潘瑞炽, 2012. 植物生理学 [M]. 7版. 北京: 高等教育出版社.]
PATLAK CS, GOLDSTEIN DA, HOFFMAN JF, 1963. The ow of solute and solvent across a two-membrane system [J]. J Theor Biol, 5(3): 426-442.
PEDERSEN O, 1993. Long-distance water transport in aquatic plants [J]. Plant Physiol, 103(4): 1369-1375.
PICKARD WF, 2003a. The riddle of root pressure. I. Putting Maxwell’ s demon to rest [J]. Funct Plant Biol, 30(2): 121-134.
PICKARD WF, 2003b. The riddle of root pressure. Ⅱ. Root exudation at extreme osmolalities [J]. Funct Plant Biol, 30(2): 135-141.
PUTZ FE, 1983. Liana biomass and leaf area of a “tierra firme” forest in the Rio Negro Basin,Venezuela [J]. Biotropica, 15:185-189.
QUIROGA G, ERICE G, DING L, et al., 2019. The arbuscular mycorrhizal symbiosis regulates aquaporins activity and improves root cell water permeability in maize plants subjected to water stress [J]. Plant Cell Environ, 42(7): 2274-2290.
SAHA S, HOLBROOK NM, MONTTI L, et al., 2009. Water relations of Chusquea ramosissima and Merostachys claussenii in Iguazu National Park, Argentina [J]. Plant Physiol, 149(4): 1992-1999.
SCHARWIES JD, DINNENY JOS R, 2019. Water transport, perception, and response in plants [J]. J Plant Res, 132(3): 311-324.
SCHOLANDER PS, RUUD B, LEIVESTAD H, 1957. The rise of sap in a tropical liana [J]. Plant Physiol, 32(1): 1-6.
SHANG NK, 2012. New opinions about plants, water absorbing power [J]. Shangdong For Sci Technol, 201(4): 108-110. [尚念科, 2012. 關于植物吸水动力的新见解 [J]. 山东林业科技, 201(4): 108-110.]
SI JH, FENG Q, ZHANG XY, et al., 2007. Sap flow of Populus euphratica in desert riparian forest in extreme arid region during the growing season [J]. J Desert Res, 27(3): 442-447. [司建华, 冯起, 张小由, 等, 2007. 极端干旱区荒漠河岸林胡杨生长季树干液流变化 [J]. 中国沙漠, 27(3): 442-447. ]
SINGH G, SINGH TN, 1989. Root-mediated water transport to the shoot of rice [J]. Curr Sci, 58(20): 1134-1138.
SINGH S, 2016a. Guttation: mechanism, momentum and modulation [J]. Bot Rev, 82(2): 149-182.
SINGH S, 2016b. Root pressure: getting to the root of pressure [M]. Springer International Publishing: Progress in Botany, 77: 106-142.
SINGH S, SINGH TN,2013. Guttation: chemistry, crop husbandry and molecular farming [J]. Phytochem Rev, 12(1): 147-172.
SINGH S, SINGH TN, CHAUHAN JS, 2009. Water transport in crop plants with special reference to rice: key to crop production under global water crisis [J]. J Crop Improv, 23(2): 194-212.
SPERRY JS, 1993. Winter xylem embolism and spring recovery in Betula cordifolia, Fagus grandifolia, Abies balsamea and Picea rubens [M] //BORGHETTI M, GRACE J, RASCHI A. Water transport in plants under climatic stress. Cambridge University Press: Cambridge: 87-98.
SPERRY JS, DONNELLY JR, TYREE MT, 1988. Seasonal occurrence of xylem embolism in sugar maple(Acer saccharum) [J]. Am J Bot, 75(8): 1212-1218.
SPERRY JS, HOLBROOK NM, ZIMMERMANN MH, et al., 1987. Spring filling of xylem vessels in wild grapevine [J]. Plant Physiol, 83(2): 414-417.
SPERRY JS, NICHOLS KL, SULLIVAN JEM, et al., 1994. Comparative studies of xylem embolism in ring-porous, diffuse-porous and coniferous trees of northern Utah and interior Alaska [J]. Ecology, 75(6): 1736-1752.
SPERRY JS, SULLIVAN JEM, 1992. Xylem embolism in response to freeze-thaw cycles and water stress in ring-porous, diffuse porous, and conifer species [J]. Plant Physiol, 100(2): 603-613.
STEUDLE E, MESHCHERYAKOV AB, 1996. Hydraulic and osmotic properties of oak roots [J]. J Exp Bot, 47(296): 387-401.
STEUDLE E, MURRMANN M, PETERSON CA, 1993. Transport of water and solutes across cornroots modified by puncturing the endodermis [J]. Plant Physiol, 103(2): 335-349.
STEUDLE E, JESCHKE WD, 1983. Water transport in barley roots [J]. Planta, 158(3): 237-248.
STILLER V, LAFITTE HR, SPERRY JS,2003. Hydraulic properties of rice and the response of gas exchange to water stress [J]. Plant Physiol, 132(3): 1698-1706.
SUN HY, WANG S, LOU YF, et al., 2018. Whole-genome and expression analyses of bamboo aquaporin genes reveal their functions involved in maintaining diurnal water balance in bamboo shoots [J]. Cells, 7(195): 1-19.
TAIZ L, ZEIGER E, MLLER IM,et al., 2015. Plant physiology and development [M]. Massachusetts: Sinauer Associates.
TANNER W, BEEVERS H,1999. Does transpiration have an essential function in long-distance ion transport in plants? [J]. Plant Cell Environ, 13(8): 745-750.
TIAN XL,2008. Physio-ecology relationship between root pressure and bamboo species under low temperature stressed [D]. Nanjing: Nanjing Forestry University. [田新立, 2008. 竹類植物的根压与低温胁迫下竹子生理生态关系的研究 [D]. 南京: 南京林业大学.]
TIBBITTS PTW, 1977. Evidence that root pressure flow is required for calcium transport to head leaves of cabbage [J]. Plant Physiol, 60(6): 854-856.
TIBBETTS TJ, EWERS FW,2000. Root pressure and specic conductivity in temperate lianas: exotic Celastrus orbiculatus (Celastraceae) vs. native Vitis riparia (Vitaceae) [J]. Am J Bot, 87(9): 1272-1278.
TYREE MT, 2003a. Plant hydraulics: the ascent of water [J]. Nature, 423(26): 923.
TYREE MT, 2003b. Hydraulic properties of roots [M]//KROON DH, VISSER EJW. Root ecology. Berlin: Springer: 125-150.
TYREE MT, SPERRY JS, 1989. Vulnerability of xylem to cavitation and embolism [J]. Ann Rev Plant Physiol Mol Biol, 40(1): 19-38.
TYREE MT, YANG S, 1992. Hydraulic conductivity recovery versus water pressure in xylem of Acer saccharum [J]. Plant Physiol, 100(2): 669-76.
TYREE MT, ZIMMERMANN MH, 2002. Xylem structure and the ascent of sap [J]. Science, 222(4623): 500-501.
VERA-ESTRELLA R, BARKLA BJ, BOHNERT HJ, et al., 2004. Novel regulation of aquaporins during osmotic stress [J]. Plant Physiol, 135(4): 2318-2329.
WAN XC, ZHANG SQ, ZHANG WH, 2007. Application of pressure probe technique in the study of plant water relationship [J]. J Plant Physiol Mol Biol, 33(6): 471-479. [万贤崇, 张岁岐, 张文浩, 2007. 压力探针技术在植物水分关系研究中的运用 [J]. 植物生理与分子生物学学报, 33(6): 471-479.]
WAN XC, ZWIAZEK JJ, 1999. Mercuric chloride effects on root water transport in aspen seedling [J]. Plant Physiol, 121(3): 939-946.
WANG FS, TIAN XL, DING YL, et al., 2011. A survey of root pressure in 53 Asian species of bamboo [J]. Ann For Sci, 68(4): 783-791.
WANG FS, TIAN XL, DING YL, et al., 2011. Drought and cold resistance of bamboo evaluated by the root pressure [J]. Sci Silv Sin, 47(8): 176-181. [王福升, 田新立, 丁雨龙, 等, 2011. 用根压法研究竹子的耐旱、耐寒性 [J]. 林业科学, 47(8): 176-181.]
WANG HF, 2015. Root pressure and its influencing factors of lianas in Xishuangbanna tropical rainforest [D]. Xishuangbanna: University of Chinese Academy of Sciences, Xishuangbanna Tropical Botanical Garden. [王华芳, 2015. 西双版纳热带雨林木质藤本的根压及影响因素 [D]. 西双版纳: 中国科学院大学,西双版纳热带植物园.]
WANG HF, YANG SJ, ZHANG JL, 2015. Root pressure of tropical lianas and their relationships with phylogeny and environments [J]. Plant Divers Resour, 37(6): 751-759. [王华芳, 杨石建, 张教林, 2015. 热带木质藤本的根压及其与系统发育和环境的关系 [J]. 植物分类与资源学报, 37(6): 751-759.]
WEGNER LH, 2014. Root pressure and beyond: energetically uphill water transport into xylem vessels? [J]. J Exp Bot, 65(2): 381-393.
WEI C, TYREE MT, STEUDLE E, 1999. Direct measurement of xylem pressure in leaves of intact maize plants. A test of the cohesion-tension theory taking hydraulic architecture into consideration [J]. Plant Physiol, 121(4): 1191-1205.
WHITE PR, 1938. “Root pressure” — an unappreciated force in sap movement [J]. Am J Bot, 25(3): 223-227.
WHITE PR, SCHUKER E, KERN JR,et al., 1958. “Root pressure” in gymnosperms [J]. Science, 128(3319): 308-309.
WILSON C, KRAMER P,1949. Relation between root respiration and absorption [J]. Plant Physiol, 24(1): 55-59.
WU SX, SUN XC, TAN QL, 2019. Molybdenum improves water uptake via extensive root morphology, aquaporin expressions and increased ionic concentrations in wheat under drought stress [J]. Environ Exp Bot, 157: 241-249.
XIAO HL, PENG SL, ZHENG YJ, et al., 2006. Interactive effects between plant allelochemicals, plant allelopathic potential and soil nutrients [J]. J Appl Ecol, 17(9): 1747-1750.
YANG SJ, ZHANG YJ, GOLDSTEIN G, et al., 2015. Determinants of water circulation in a woody bamboo species: afternoon use and night-time recharge of culm water storage [J]. Tree Physiol, 35(9): 964-974.
YANG SJ, ZHANG YJ, SUN M, et al., 2012. Recovery of diurnal depression of leaf hydraulic conductance in a subtropical woody bamboo species: embolism refilling by nocturnal root pressure [J]. Tree Physiol, 32(4): 414-422.
YE Q, WIERA B, 2004. A cohesion/tension mechanism explains the gating of water channels (aquaporins) in Chara internodes by high concentration [J]. J Exp Bot, 55(396): 449-461.
YIN XH, STERCK F, HAO GY, 2018. Divergent hydraulic strategies to cope with freezing in co-occurring temperate tree species with special reference to root and stem pressure generation [J]. New Phytol, 219(2): 530-541.
YU QJ, WU Q, LIN ZP, et al., 2002. Recent advances in plant aquaporins [J]. Acta Sci Nat Univ Peking, 38(6): 855-866. [于秋菊, 吳锜, 林忠平, 等, 2002. 植物水孔蛋白研究进展 [J]. 北京大学学报(自然科学版), 38(6): 855-866.]
ZACHARY M, 2009. Sap flow dynamics of a tropical, woody bamboo: deductions of physiology and hydraulics within Guadua angustifolia [D]. St. Louis: Washington University.
ZAITSEVA RI, MINASHINA NG, 1998. Sudnitsyn Ⅱ. Influence of capillary-sorptive and osmotic moisture pressure in chernozem on the growth and guttation of barley [J]. Eurasian Soil Sci, 31(10): 1075-1082.
ZAREBANADKOUKI M, AHMED M, HEDWIG C, et al., 2018. Rhizosphere hydrophobicity limits root water uptake after drying and subsequent rewetting [J]. Plant Soil, 428:265-277.
ZEUTHEN T, 2010. Water-transporting proteins [J]. J Membrane Biol, 234(2): 57-73.
ZHANG L, DU XG, 2014. Recent advances in plant aquaporins [J]. Plant Sci J, 32(3): 304-314. [张璐, 杜相革, 2014. 植物水孔蛋白研究进展 [J]. 植物科学学报, 32(3): 304-314.]
ZHAO XH, ZHAO P, ZHANG ZZ, et al., 2017. Culm age and rhizome affects night-time water recharge in the bamboo Phyllostachys pubescens [J]. Front Plant Sci, 8: 1928.
ZHOLKEVICH VN, 1991. Root Pressure [M]//WAISEL Y, ESHEL A, KAFKAFI U. Plant roots, the hidden half. New York: Marcel Dekker: 589-603.
ZHOLKEVICH VN, POPOVA MS, ZHUKOVSKAYA NV, 2007. Stimulatory effects of adrenalin and noradrenalin on root water-pumping activity and the involvement of G-proteins [J]. Russ J Plant Physl, 54(6): 790-796.
ZHU JJ, ZIMMERMANN UF, HAASE A, 2010. Xylem pressure response in maize roots subjected to osmotic stress-determination of radial reflection coefficients by use of the xylem pressure probe [J]. Plant Cell Environ, 18(8): 906-912.
ZWIENIECKI MA, HOLBROOK NM, 2009. Confronting Maxwell’s demon: biophysics of xylem embolism repair [J]. Trends Plant Sci, 14(10): 530-534.
(責任编辑李莉)

