18F-FDG PET/CT诊断肝细胞癌及胆管细胞癌的准确性比较
陈萍 周和平 朱亚男
原发性肝癌主要包括胆管细胞癌(CC)、肝细胞癌(HCC)、未分化癌、胆管囊腺瘤等,其中HCC最常见(占90%以上),其次为CC(约占5%)[1-2]。目前,临床诊断肝癌多采用磁共振成像、CT、B超等方式,但这些诊断方式只能提供解剖图像[3]。PET的功能代谢影像可从分子水平显示病灶信息,PET/CT在显示肿瘤的形态同时明显反应肿瘤代谢特征,有利于肿瘤分型和分期[4-5]。本研究回顾分析18F-FDG PET/CT诊断HCC和CC的应用,为临床诊断鉴别提供依据。
资料与方法
一、一般资料
分析安康市中心医院肝癌患者132例的资料,入选时间为2018年3月至2021年3月,其中HCC患者90例,CC患者42例,患者均经手术、穿刺病理组织活检及临床随访证实。HCC患者男、女分别为72、18例,年龄24~78(52.46±5.12)岁;CC患者男、女分别为23、19例,年龄23~78(55.26±5.16)岁。本研究经院医学伦理审核。
二、研究方法
(一)18F-FDG PET/CT检查 首先回旋加速器(美国GE公司)合成18F-FDG,放化产物纯度在95%以上。检查前常规禁食,经三通管静脉注18F-FDG(5.5 MBq/kg),静卧1 h待检。PET/CT扫描仪扫描,设置管电压、电流以及螺距、层厚、球管单圈旋转时间分别为140 kV、160~200 mA、0.75 mm、5 mm、0.8 s。二维采集线PET发射扫描,OSEM法重建PET图像,图像衰减校正并标准法重建CT图像,完成以上操作后W和Xeleris工作站对PET和CT图像进行帧间图像融合。
(二)影像学分析 由1名影像学医师和1名核医学医师采用双盲法CT图像、PET图像和PET/PET融合图像进行分析,意见不统一经协商确定,首先,用视觉法判断正常病变、正常生理摄取和伪影,观察病变的形态、密度和位置,然后通过半定量分析勾画出感兴趣区域(ROI),并计算该区域的最大标准摄取量(SUVmax),对于多发病灶,用CT图像勾勒出所有可分辨的ROI,对于CT上密度相等、18F-FDG浓度不明显的病灶,联合增强扫描勾画出ROI,将病灶18F-FDG浓度高于周围正常肝组织病灶诊断为阳性,反之则诊断为阴性。
三、统计学分析
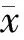
结 果
一、两组SUVmax值比较
HCC患者SUVmax值为(5.12±2.03)较CC患者(7.64±2.14)显著低(t=6.529,P=0.000)。
二、18F-FDG PET/CT检查结果
HCC检查出18F-FDG PET/CT阳性52例,其中单发病灶35例,多发病灶17例;病变位于左、右叶13、30例,弥漫性9例;42例CC患者阳性39例,其中单、多发病灶分别24、15例;病变位于左、右叶及弥漫性分别16、15、8例。
三、HCC诊断结果
HCC的诊断结果见表1,诊断一致性差(Kappa值0.307)。
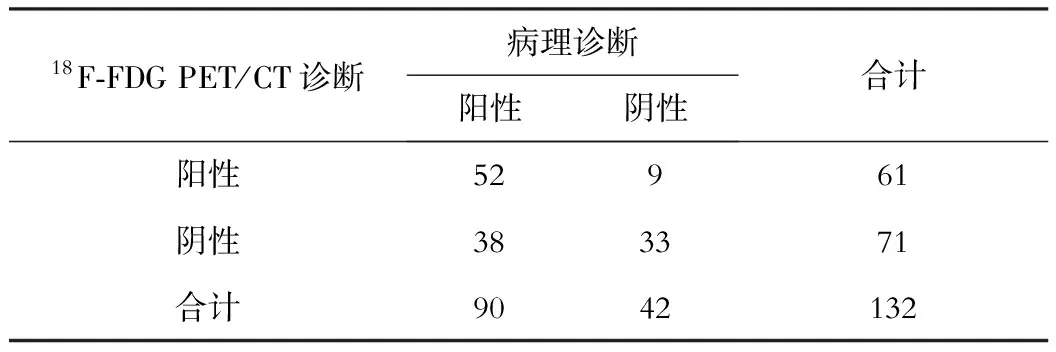
表1 HCC诊断结果
四、CC诊断结果CC的诊断结果见表2,Kappa值为0.912,一致性好。
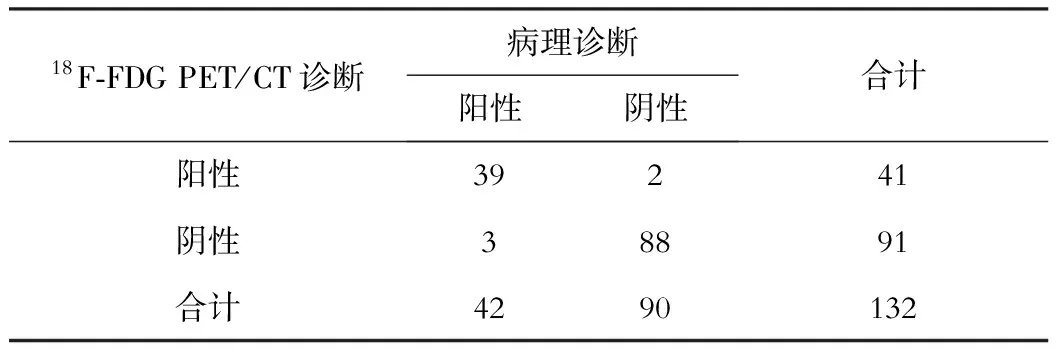
表2 CCC诊断结果
讨 论
由于基因作用相同,正常细胞癌变后其代谢情况会出现明显差异,18F-FDG PET/CT能反映组织的糖代谢情况,其对肿瘤的诊断就依据病变位置与正常组织糖代谢活性的差异[6]。
18F-FDG与葡萄糖有相似的结构及代谢特征,注入后随血液流遍全身,Glut转运至细胞并与HK发生反应成为FDG-6磷酸盐,正常葡萄糖被HK硫酸化为葡萄糖-6-磷酸,可进行下一步反应进入循环[7-8],但18F-FDG代谢产物FDG-6磷酸盐由于酶底物不匹配使其滞留于细胞内,肿瘤细胞中Glut mRNA表达高,HK表达增加,对18F-FDG再摄取强,表现为高浓度18F-FDG[9-10]。HCC患者SUVmax值为(5.12±2.03)显著低于CC患者(7.64±2.14),表明二者对18F-FDG再摄取存在差异。
本研究中CC经18F-FDG PET/CT诊断灵敏、特异度均较高,达90%以上,Kappa为0.912,一致性强。18F-FDG PET/CT诊断HCC检出率仅为57.78%,准确率为0.644,显著低于CC检出率92.86%及准确率0.962。其原因分析如下:高分化HCC具有较强的葡萄糖-6-磷酸酶活性,可加速游离18F-FDG生成。游离18F-FDG可穿过细胞膜离开肿瘤细胞,肿瘤内18F-FDG脱离,表现为假阴性[11-12]。同时,HCC肿瘤细胞膜外Glut-1、Glut-3降低,其对18F-FDG再摄取变弱,导致假阴性出现[13]。而大部分CCC分化程度较低,假阴性结果的可能性较小,且CCC肿瘤细胞中葡萄糖-6-磷酸酶酶含量接近0,Glut-1、Glut-3水平比周围正常肝组织明显要高,对18F-FDG有较强的再摄取能力,故18F-FDG PET/CT诊断CCC准确率相较于HCC明显提高[14-15]。
综上,HCC的SUVmax值显著低于CC,18F-FDG PET/CT诊断HCC准确率高,在诊断HCC特别高分化HCC时可能有假阴性,应结合影像学检查及实验室指标综合分析,避免漏诊。

