HBV相关肝癌与非病毒相关肝癌临床特征对比分析
李建 成警花 田杰 李囿萱 廖德仲 徐静
根据最新全球癌症统计数据显示,在所有癌症中原发性肝癌(primary liver cancer,PLC)发病率(4.7%)排名第六,死亡率(8.3%)排在第三,而在中国其发病率及死亡率更是排在第五和第二[1-2]。尽管PLC目前已有多种治疗手段,但其5年净存活率仍仅有5%~30%,因此而造成的疾病负担仍在继续加重[3-5]。乙型肝炎病毒(hepatitis B virus,HBV)感染、丙型肝炎病毒(hepatitis C virus,HCV)感染、肝硬化等是该病常见的致病因素[6]。近年来随着生活质量的提高,肥胖和糖尿病等非感染性PLC增加,但在亚洲这些慢性乙肝流行的地区,特别是中国,HBV感染仍是PLC的最主要致病因素[7-9]。而不同致病因素导致的PLC临床特点有所差异,为此,本研究将对HBV-PLC与NBNC-PLC的临床特征进行对比分析,并探讨差异部分背后的原因,以期为HBV-PLC、NBNC-PLC的临床诊治及相关研究提供参考。
资料与方法
一、研究对象
选取从2018年3月至2021年3月在贵州中医药大学第二附属医院肿瘤内科住院的47例PLC患者,其中HBV-PLC 28例、NBNC-PLC19例。
二、纳入、排除及分组标准
纳入标准:①参照《原发性肝癌诊疗规范(2019年版)》[10]诊断标准,确诊为PLC;②近3个月未接受过系统抗肿瘤治疗。排除标准:①合并其他原发性肿瘤的患者;②合并HCV感染的患者。分组标准:入院血清HBsAg阳性和(或)HBV-DNA阳性患者纳入HBV-PLC组,HBsAg阴性和HBV -DNA阴性患者纳入 NBNC-PLC组。
三、数据收集
为避免治疗带来影响,所有临床数据收集于患者入院第一天给予治疗前;部分患者影像学及病理资料欠缺(具体见统计结果),1名患者缺失血生化检查,余数据均完整。
四、统计学分析
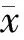
结 果
一、两组性别、发病年龄、肿瘤分期以及影像学、病理资料比较
两组性别无统计学差异,而HBV-PLC患者[(60.97±12.18)岁]发病年龄比NBNC-PLC患者[(69.28±11.73)岁]年轻约10岁,差异有统计学意义(P<0.05)。影像学上两组在肿瘤个数、门静脉癌栓形成、肿瘤大体病理分型以及淋巴转移方面无统计学差异(P>0.05),但在肿瘤病灶位置上,HBV-PLC明显好发于肝右叶(79.2%),NBNC-PLC倾向于肝左叶(50%)(P<0.05),且HBV-PLC比NBNC-PLC更容易发生远处转移(P<0.05)。组织病理分型上HBV-PLC倾向于HCC(92.9%),而NBNC-PLC倾向于CC(58.3%)(P<0.05),但在分化程度上两组无统计学差异(P>0.05)。在TNM、BCLC分期上两组没有统计学差异(P>0.05)。见表1。

表1 两组患者一般资料比较
二、血生化指标
两组在TP、Alb、GLO、ALP、CHE、LDH上无显著差异(P>0.05),但HBV-PLC中AST、ALT、TBil、DBil、IBil、TBA、γ-GT更高,且Child-Pugh分级也更高,差异有统计学意义(P<0.05),HBV-PLC血生化指标相对较差。见表2。
三、肿瘤标志物
肿瘤标志物上两组的CEA、CA125、CA199、CA724没有统计学差异(P>0.05),而HBV-PLC血清AFP明显高于NBNC-PLC(P<0.05)。见表3。
四、凝血功能
凝血功能方面,HBV-PLC患者PT、INR、TT要更长,而PTA、FIB则相对较低(P<0.05),APTT上两者无统计学差异(P>0.05)。HBV-PLC患者的凝血功能更差。见表4。
讨 论
本研究患者中HBV-PLC组29名(61.7%),NBNC-PLC组18名(38.3%),说明在中国HBV是PLC的一个主要致病因素,也反映我国HBV感染形势仍然十分严峻。相关研究表明,截至2017年中国HBV感染率仍有6.89%,西部地区更是达到8.92%[11]。
本研究发现PLC男性发病率(87.2%)远高于女性(12.8%),但HBV-PLC与NBNC-PLC在性别上却无统计学差异。而在发病年龄上,HBV-PLC患者则比NBNC-PLC患者年轻约10岁,这与既往报道相似[12]。原因可能是HBV引起的肝炎有助于炎症-坏死-再生过程,或者是HBV的DNA可以直接插入肝细胞基因序列引起癌变,使得癌变的进程缩短[13-14]。
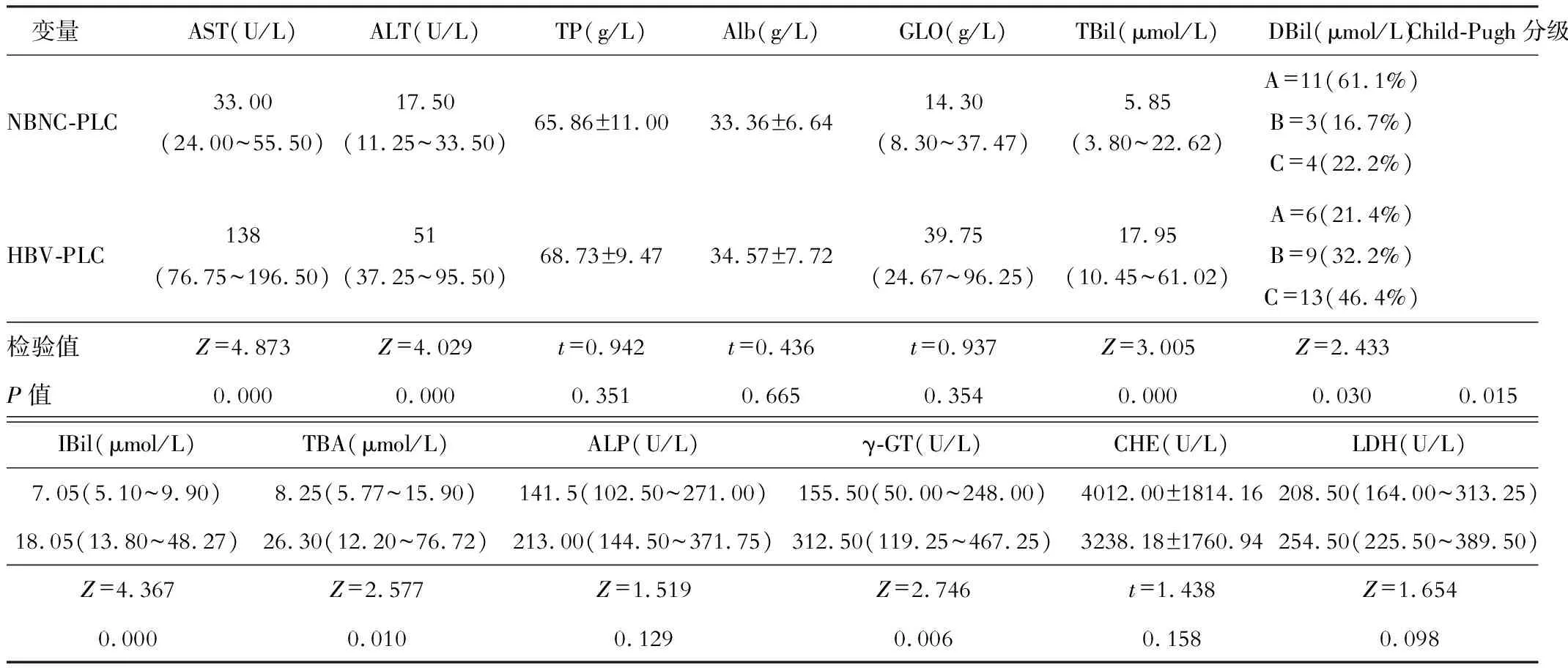
表2 两组患者血生化指标比较
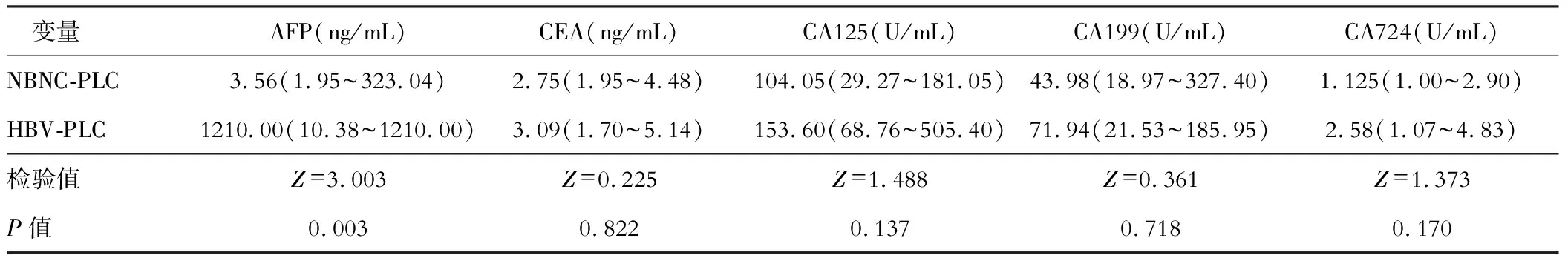
表3 肿瘤标志物比较
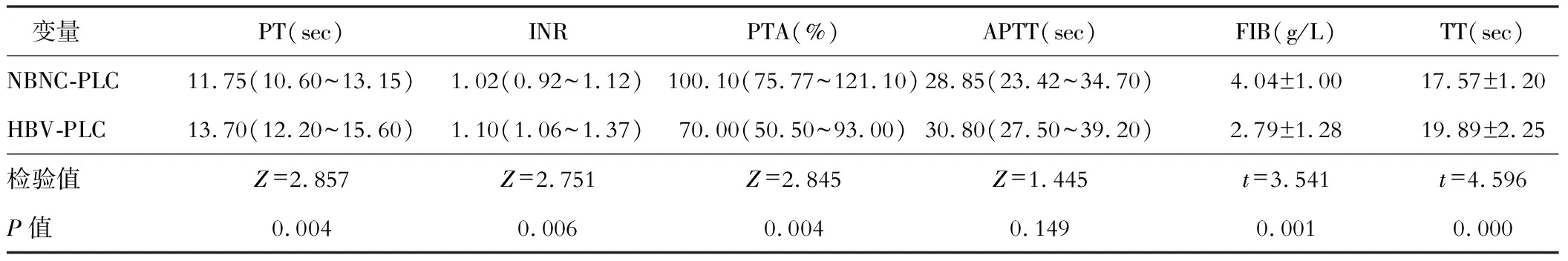
表4 凝血功能比较
本研究发现HBV-PLC更容易发生远处转移。这可能与HBV上调Twist1表达,促进上皮细胞-间充质转化,以及转化生长因子-β能激活乙肝病毒X蛋白(hepatitis B virus x protein,HBx)相关长链非编码RNA通过诱导自噬促进细胞侵袭和迁移有关[15-16]。而在肿瘤病灶位置上HBV-PLC明显好发于肝右叶,NBNC-PLC倾向于肝左叶,其余部位两者发生的概率都很小。既往很少关于PLC病因与病灶位置关系的报道,但段文斌等[17]发现CC、HCC分别好发于肝左叶和肝右叶。恰巧本研究中(表1)HBV-PLC、NBNC-PLC患者分别主要为HCC和CC,所以可能是不同病因导致了PLC不同的病理类型,从而在病灶位置也产生了差异,但具体机制尚不清楚。对HBV-PLC倾向于HCC型,NBNC-PLC比较倾向于CC型而言,可能是为HBV宿主范围狭窄,倾向于感染肝细胞,很少侵袭胆管细胞,导致了HBV-PLC多为HCC,而CC与糖尿病等非病毒感染的代谢性疾病相关,故NBNC-PLC比较倾向于CC型[18-19]。
既往研究表明,血生化指标越差PLC预后越不好[20]。本研究发现HBV-PLC中AST、ALT、TBil、DBil、IBil、TBA、γ-GT以及Child-Pugh分级都高于NBNC-PLC,表明其肝功能更差。转氨酶是肝细胞损伤的重要标志物,而HBV的感染会引起肝细胞损伤、死亡这就导致HBV-PLC患者转氨酶更高。与本研究相似,既往发现HBV感染PLC患者胆红素更高[21]。这是因为IBil首先要在肝细胞内与葡糖醛酸结合, 才能形成DBil,最终分泌入胆汁排泄[22],而当肝细胞感染HBV被破坏之后,处理IBil能力减弱,且肝细胞损伤后肝细胞肿胀会压迫小胆管,造成DBil排泄障碍,最终导致HBV-PLC患者胆红素更高。同样作为胆固醇在肝脏代谢的最终产物胆汁酸,也会因此造成代谢障碍,使血清TBA升高。然而对HBV-PLC中GGT更高的原因尚不明确,不过最近研究发现γ-GT对HBV-HCC有一定诊断价值,证明HBV与PLC中血清γ-GT有一定的联系[23]。以上各种血生化指标表明HBV-PLC肝功能更差,这也导致了HBV-PLC患者Child-Pugh级别更高。
AFP主要由胎儿肝细胞及卵黄囊合成,在成人血清中含量极低[24]。临床上AFP主要用于PLC的诊断及疗效监测。不过近些年发现它还能调控PTEN、caspase-3等促进肿瘤的发生发展[25-26]。本研究中HBV-PLC患者的血清AFP远高于NBNC-PLC。也许是因为p53基因能通过调控序列特异性DNA结合蛋白抑制AFP表达,而HBx能与DNA结合降低p53对AFP表达的抑制[27-28]。
肝脏是多种凝血因子的合成场所,当肝脏病变时凝血功能一般会发生异常。本研究中HBV-PLC患者PT、INR、TT要更长,而PTA、FIB则相对较低,而两组APTT无统计学差异。这反映HBV-PLC患者凝血功能更差,特别是外源性凝血途径上。既往相关研究也发现HBV-PLC患者FIB含量降低,PT、TT等不同程度的延长[29-30]。首先HBV感染损伤肝细胞会影响凝血因子合成,这是主要原因,其次可能HBx也会干扰凝血因子合成。
综上所述,HBV-PLC多为HCC,有发病较年轻、病灶好发于肝右叶、易发生远处转移、血清AFP高,且肝功能、凝血功能差的特点;而NBNC-PLC多为CC,发病年纪更大、病灶好发于肝左叶,不易发生远处转移、血清AFP低,肝功能及凝血较好。提示对于60岁左右(甚至更年轻)的HBV感染患者,应尽早予抗HBV治疗,能有效预防PLC,且当肝右叶以及肝功能、凝血功能异常时,更要及时筛查警惕HCC发生。同时HBV-PLC患者也应积极抗HBV,这或许能减少远处转移以及改善患者凝血和肝功能,且既往研究[31]表明还能改善其预后,即使是HBV-DNA以及转氨酶正常者。此外,临床上对HBV-PLC患者应注重保护肝功能,以及预防出血。而70岁左右伴有糖尿病等代谢性疾病的人群,要警惕CC的发生,特别当影像学发现肝左叶有异常时。由于肝左叶PLC患者术后复发风险更高,故左肝术后的PLC患者要积极监测预防复发[32]。
本研究纳入样本较少,且来自单个研究中心,部分病例缺乏影像学及病理学等临床资料,如有条件应进一步进行更高质量的多中心、大样本研究予以验证。

