含尿素饲粮中添加果寡糖对幼兔氮利用、血液尿素氮向盲肠微生物氮转移的影响
晓 敏 坂口英 弓 剑
(1.内蒙古师范大学生命科学与技术学院,内蒙古自治区高等学校生物多样性保护与可持续利用重点实验室,呼和浩特 010022;2.日本国冈山大学自然科学研究科,冈山 7008530)
兔子盲肠是一个复杂的厌氧环境,其中栖息着数量庞大且种类繁多的微生物,活菌数量高达1011个/g[1],其生长要求必需提供足够的氮源和能量。然而,仅有38%左右的内源性尿素进入消化道降解供盲肠微生物的增殖所利用[2],其余部分由宿主氮代谢生成的尿素和“终产物”提供,当这些物质提供的氮源不足时,盲肠微生物的增殖就被抑制。
众所周知,尿素是反刍动物重要的非蛋白氮源,大量的研究报道了其在反刍动物体内的代谢途径。饲粮中添加的尿素被消化道内的微生物脲酶迅速水解生成氨和二氧化碳,参与反刍动物[3]和非反刍动物[4]的蛋白质合成过程。然而尿素在家兔饲养上的应用效果并不稳定,兔盲肠中含有的脲酶活性较高,可有效分解尿素生成氨和二氧化碳[5]。采食低蛋白质饲粮的成年兔通过注射或口服尿素时,氮利用率极显著提高[6]。另有研究表明,低蛋白质饲粮中添加尿素对家兔没有产生任何效果[7]。研究发现,含尿素的低蛋白质饲粮中添加D-甘露醇可显著降低兔的尿氮排泄量,从而显著提高体内氮沉积[8]。由此推断,D-甘露醇能有效促进饲粮中添加的尿素的氮利用率。
果寡糖(fructooligosaccharides,FOS)在小肠内不易被消化或吸收,进入大肠后在肠道菌群的作用下迅速被发酵生成短链脂肪酸(short chain fatty acids,SCFA),为微生物增殖提供所需的能量。据报道,大鼠饲粮中添加FOS能有效刺激盲肠微生物利用血液循环中的尿素氮而增殖,有效降低尿氮排泄量[9-10]。已有的研究发现,兔饲粮中添加FOS能有效促进血液循环中的尿素氮进入大肠,供微生物氮合成利用,显著提高饲粮氮的利用率[11]。以上结果表明,饲粮中添加FOS可刺激盲肠微生物的增殖,血液循环中的尿素进入盲肠被微生物增殖所利用,进而导致粪便中微生物氮含量显著增加[12-13]。
如果含有尿素的饲粮中添加FOS能够刺激盲肠微生物的增殖,尿素将为盲肠微生物的增殖提供充足的氮源,则能有效补充内源性尿素的供给不足,盲肠微生物利用饲粮中的尿素合成微生物蛋白质,从而被家兔吸收利用。因此,本试验将利用15N-尿素检测FOS能否促进非蛋白氮源——尿素由血液向盲肠微生物氮转移及氮利用,旨在探索尿素能否有效转化为体内蛋白质,以期为兔饲粮中进一步利用尿素提供科学依据。
1 材料与方法
1.1 试验饲粮和饲养管理
在试验之前,试验动物均采食从市场上购买的基础饲粮(Labo R Stock,Nihon Nosan公司,日本)。饲粮营养水平为:粗蛋白质(CP)16.30%,酸性洗涤纤维(ADF)25.30%,粗灰分(Ash)9.30%,干物质(DM)91.30%,粗脂肪(EE)3.40%。试验之前,在温度[(25±1)℃]可控的房间内单笼饲养试验动物。
试验分为对照组和试验组。其中,对照组饲喂在基础饲粮中添加10 g/kg尿素和50 g/kg葡萄糖(Nacalai Tesque Inc.公司,日本)的试验饲粮,试验组饲喂基础饲粮中添加10 g/kg尿素和50 g/kg FOS(Nacalai Tesque Inc.公司,日本)的试验饲粮。试验饲粮制备:按比例将尿素和葡萄糖或尿素和FOS溶解于自来水中,用喷雾器喷洒在基础饲粮中,风干。试验期间试验动物自由采食和饮水,自然通风和光照。
试验在日本冈山大学自然科学研究科动物营养学研究室进行,是根据日本冈山大学试验动物护理委员会的准则批准进行的。
1.2 试验1设计及样品采集
选择10只3月龄左右、初始体重为(1.47±0.11)kg及健康状况良好的荷兰幼兔,按照体重随机分为2组,每组5个重复,每个重复1只。试验期8 d,其中预试期3 d,正试期5 d。试验饲粮以试验当天晨饲前活体重量的50 g/kg W0.75为标准供给。正试期每天09:00回收全部新鲜粪便和尿液。将收集到的粪便充分混匀后,于60 ℃通风干燥的烘箱中干燥24 h,再在空气中回潮24 h后称质量,粉粹并过1.0 mm筛,室温贮存待检。为防止氮的挥发,每天在接尿盘中添加1.5%的硼酸10 mL,收集到的尿液贮存于4 ℃冷藏室内,试验结束后所收集的全部尿液充分混匀后测定CP含量。
1.3 试验2设计及样品采集
选择12只3月龄左右、初始体重为(1.50±0.12)kg及健康状况良好的荷兰幼兔,按照体重随机分为2组,每组6个重复,每个重复1只。试验期为9 d,前8 d试验饲粮以试验当天晨饲前活体重量的50 g/kg W0.75为标准供给;第9天试验饲粮以试验当天晨饲前活体重量的50 g/kg W0.75再追加60 g供给。次日屠宰前2 h全部试验动物分别口服2 g葡萄糖或FOS与40 mg15N-尿酸(原子百分比为99.2%,SI Science公司,日本)混合的水溶液3 mL。所有的试验动物于08:00—09:00麻醉,并剖腹由肝脏门静脉抽取10 mL血液,随后由背大动脉抽取动脉血处死。将采取的门静脉血和动脉血于室温下静置30 min,并在4 ℃下3 000×g离心20 min制备血清,置于-30 ℃保存待检;在冰块上取出肝脏、小肠、盲肠、近端结肠、远端结肠和直肠,称鲜重后置于-30 ℃保存待检。
1.4 测定指标与方法
每天准确记录试验兔的活体重量,计算平均日增重(ADG);每天准确记录试验兔的投料量和剩料量,计算平均日采食量(ADFI);根据试验兔的平均日采食量和平均日增重计算料重比(F/G)。
饲粮和粪便样品的DM含量:准确称取待测样品,放入已知恒质量的清洁干燥并标记好的瓷杯中,置于135 ℃通风干燥的烘干箱内干燥2 h,干燥器内冷却30 min后称质量,每待测样品设2个重复。饲粮和粪便样品的Ash含量:准确称取待测样品,放入已知恒质量的清洁干燥并标记好的瓷杯中,置于550 ℃电磁炉内灰化8 h,干燥器内冷却30 min后称质量,每待测样品设2个重复;饲粮、粪便和尿液中的氮含量及饲粮和粪便中的ADF含量根据AOAC(1990)的方法进行分析测定。
营养物质表观消化率和氮沉积由以下公式计算:
改革开放40周年。40年风雨同舟,40年披荆斩棘,40年砥砺奋进,改革开放成为当代中国最显著的特征、最壮丽的气象。对这一伟大历史进程,习近平总书记用“十个始终坚持”高度概括了党引领亿万人民的奋斗历程和创造的人间奇迹。中国人民具有伟大梦想精神,中华民族充满变革和开放精神。实践深刻启示我们,伟大梦想不是等得来、喊得来的,而是拼出来、干出来的。改革开放已走过千山万水,但仍需跋山涉水,我们绝不能有半点骄傲自满、固步自封,也绝不能有丝毫犹豫不决、徘徊彷徨,必须统揽伟大斗争、伟大工程、伟大事业、伟大梦想,勇立潮头、奋勇搏击。
营养物质表观消化率=100×(摄入的
营养物质含量-粪便排泄的营养物质
含量)/摄入的营养物质含量;
氮沉积=摄入氮-(粪排泄氮+尿排泄氮);
基于摄入量的氮沉积=氮沉积/摄入氮;
基于表观消化量的氮沉积=氮沉积/
(摄入氮-粪排泄氮)。
获取的每节肠段样品解冻,取出内容物后将组织经生理盐水冲洗干净并用吸水纸吸取生理盐水后,准确称量每节肠段组织重;根据已知的每节肠段鲜重计算每节肠段内容物重量。每节肠段的内容物混均后采用数显pH计(Horiba公司,日本)测定pH。
采用高效液相色谱仪(Shimadzu公司,日本)测定盲肠内容物SCFA含量。
准确称取每节肠段内容物,在105 ℃通风干燥的烘干箱内干燥24 h,干燥器内冷却30 min后称质量,计算水分含量。
干燥后各肠段内容物采用CN分析仪(MT-700,Yanaco CN Corder公司,日本)测定总氮含量。
肝脏样品在生理盐水中匀浆。匀浆的肝脏样品、小肠、盲肠、近端结肠、远端结肠内容物样品和血清样品适量取出后,按约体积的1/5为标准添加三氯乙酸(trichloroacetic acid,TCA)溶液(500 g/L)处理,离心(4 ℃、12 000×g、20 min),仅回收盲肠内容物脱蛋白上清液,以备后续分析;将所有样品沉淀物继续用TCA溶液(50 g/L)洗涤2次[14],离心(4 ℃、12 000×g、20 min),回收沉淀物采用CN分析仪测定蛋白氮含量。
将盲肠内容物脱蛋白上清液适量取出后根据Obara等[15]描述的方法,通过脲酶(EC 3.5.1.5,Nacalai Tesque Inc.公司,日本)处理转化为氨。未用脲酶处理的盲肠内容物脱蛋白上清液和脲酶处理的盲肠内容物脱蛋白上清液中全部添加氧化镁或氢氧化钠之后进行蒸汽蒸馏,利用硼酸溶液捕获氨,并用硫酸溶液(0.05 mol/L)滴定,计算氨氮和尿素氮含量[16]。
分别准确称取盲肠、近端和远端结肠内容物样品适量添加生理盐水稀释,并4 ℃冰箱内静置24 h[17],随后4 ℃、500×g离心5 min获取的液体再4 ℃、20 000×g离心20 min获取微生物[18],使用CN分析仪测定微生物氮含量。
血清氨氮和尿素氮含量采用Wako Pure化学工业株式会社(日本)生产的试剂盒检测,根据说明书要求进行操作。采用质谱仪(MSI-150-MT-600 NC Model,日本)测定每种样品中的总氮、蛋白氮、微生物氮、尿素氮和氨氮中的15N含量。
15N过显现比例和15N过显现量由以下公式计算:
15N过显现比例=100/[2(14N14N/14N15N)+1]×
(原子百分比)-15N自然界丰度比例(0.366%);
15N过显现量=总氮含量×15N过显现比例。
1.5 统计处理
试验数据采用Excel 2007的Student’st-test函数分析处理,结果以平均值(mean)±标准差(SD)表示,以P<0.05为差异显著性判断标准。
2 结 果
2.1 试验1测定结果
由表1可知,含尿素饲粮中添加FOS对幼兔平均日采食量、平均日增重及料重比无显著影响(P>0.05)。此外,含尿素饲粮中添加FOS对幼兔营养物质表观消化率无显著影响(P>0.05)。含尿素饲粮中添加FOS对幼兔摄入氮、粪氮和尿氮均无显著影响(P>0.05)。试验组的氮沉积、基于摄入量的氮沉积和基于表观消化量的氮沉积均显著高于对照组(P<0.05)。

表1 含尿素饲粮中添加FOS对幼兔生长性能、营养物质表观消化率及氮平衡的影响(干物质基础)
2.2 试验2测定结果
由表2可知,试验组的盲肠内容物重量和盲肠内容物重量/体重显著高于对照组(P<0.05),试验组的远端结肠组织重量/体重比显著低于对照组(P<0.05)。2组之间胃、小肠、近端结肠、直肠的各项指标均无显著差异(P>0.05)。与对照组相比,试验组的肝脏重量有所降低,但是,2组之间肝脏重量和肝脏重量/体重无显著差异(P>0.05)。

表2 含尿素饲粮中添加FOS对幼兔肝脏重量和肠道发育的影响
由表3可知,试验组的盲肠内容物丙酸浓度显著高于对照组(P<0.05)。2组之间盲肠内容物pH和其他有机酸(琥珀酸、乳酸、甲酸、乙酸、丁酸、戊酸)浓度无显著差异(P>0.05)。试验组的盲肠内容物有机酸总量显著高于对照组(P<0.05)。2组之间盲肠内容物总SCFA浓度和SCFA摩尔比无显著差异(P>0.05)。
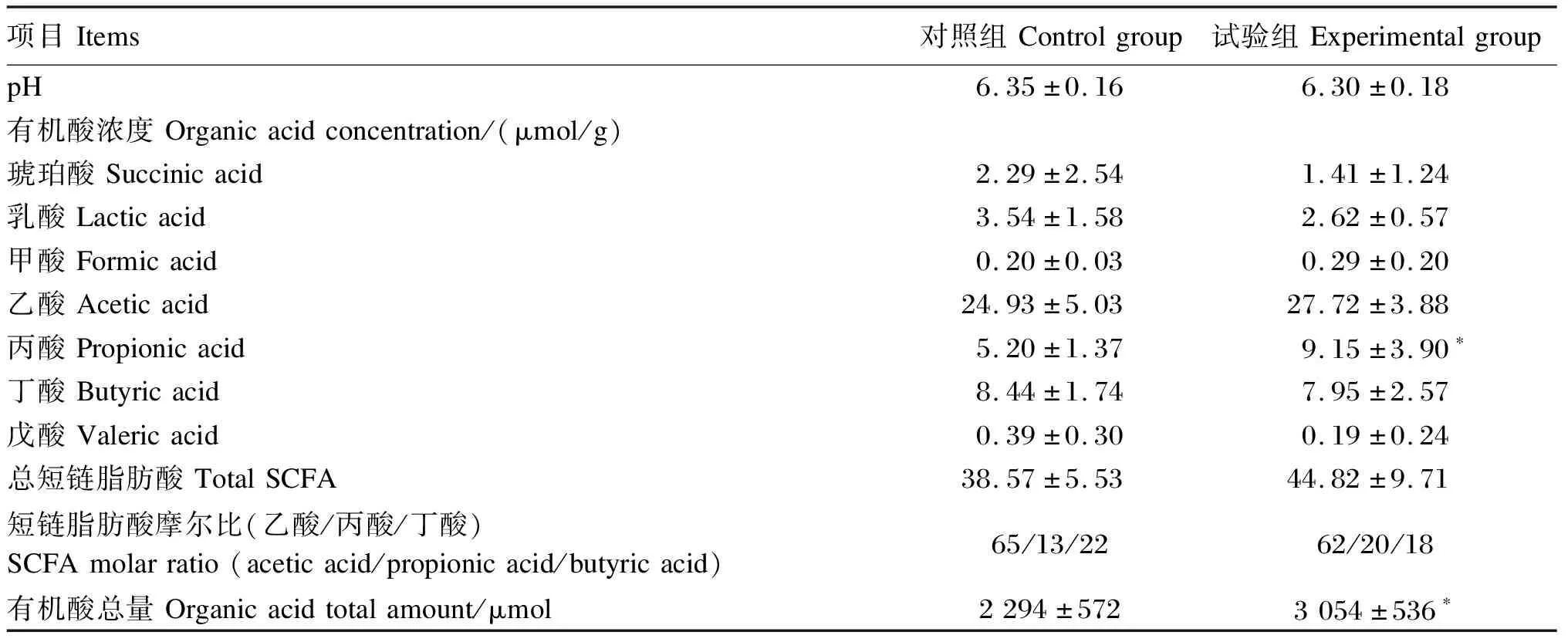
表3 含尿素饲粮中添加FOS对幼兔盲肠内容物pH、有机酸浓度和有机酸总量的影响
由表4可知,2组之间各部分肠段内容物的氮比例、总氮和总氮的15N过显现比例均无显著差异(P>0.05)。试验组的近端结肠内容物总氮的15N过显现量和15N添加量的百分比显著低于对照组(P<0.05),2组之间其他部分肠段内容物的总氮的15N过显现量和15N添加量的百分比均无显著差异(P>0.05)。

表4 含尿素饲粮中添加FOS对幼兔肠道内容物总氮和15N浓度的影响(干物质基础)
由表5可知,2组之间肝脏内容物蛋白氮比例无显著差异(P>0.05),但试验组肝脏内容物总蛋白氮含量显著低于对照组(P<0.05)。此外,2组之间肝脏内容物蛋白氮的15N过显现比例、15N过显现量和15N添加量的百分比无显著差异(P>0.05)。2组之间盲肠内容物蛋白氮比例无显著差异(P>0.05),但试验组盲肠内容物总蛋白氮含量显著高于对照组(P<0.05)。此外,2组之间盲肠内容物蛋白氮的15N过显现比例、15N过显现量和15N添加量的百分比无显著差异(P>0.05)。2组之间其他各肠段(小肠、近端结肠、远端结肠)内容物蛋白氮的比例、含量、15N过显现比例、15N过显现量和15N添加量的百分比均无显著差异(P>0.05)。

表5 含尿素饲粮中添加FOS对幼兔肝脏和肠道内容物蛋白氮和15N浓度的影响(干物质基础)
由表6可知,2组之间盲肠和远端结肠内容物的微生物氮的比例、含量、15N过显现比例、15N过显现量和15N添加量的百分比均无显著差异(P>0.05)。2组之间近端结肠内容物微生物氮比例无显著差异(P>0.05),但试验组近端结肠内容物总微生物氮含量显著低于对照组(P<0.05)。另外,2组之间近端结肠内容物微生物氮的15N过显现比例无显著差异,但是试验组的近端结肠内容物微生物氮的15N过显现量和15N添加量的百分比均显著低于对照组(P<0.05)。

表6 含尿素饲粮中添加FOS对幼兔肠道内容物微生物氮和15N浓度的影响(干物质基础)
由表7可知,2组之间盲肠内容物尿素氮、氨氮浓度和15N过显现比例均无显著差异(P>0.05)。2组之间动脉血血清尿素氮、氨氮浓度和15N过显现比例均无显著差异(P>0.05)。2组之间门静脉血血清尿素氮、氨氮浓度均无显著差异(P>0.05),试验组门静脉血血清尿素氮的15N过显现比例显著低于对照组(P<0.05)。

表7 含尿素饲粮中添加FOS对幼兔盲肠内容物、动脉血血清、门静脉血血清的氨氮、尿素氮及15N浓度的影响
3 讨 论
哺乳动物的消化酶不易分解可发酵性碳水化合物,经消化道进入大肠后在肠道菌群的作用下发酵生成有机酸,特别是SCFA[19-20],并为后肠道微生物的增殖提供能量[21]。然而,后肠道微生物增殖所需的氮源主要由小肠内未被消化的饲粮蛋白质或内源性蛋白质和尿素提供[22]。另外,兔盲肠中含有大量的较高活性的脲酶,能使进入盲肠的血液尿素分解生成氨[1],为微生物蛋白质的合成提供氮源[23]。据报道,在饲粮中添加D-甘露醇或FOS刺激盲肠微生物的增殖,使血液尿素流入盲肠分解利用的速度加快,导致尿氮排泄量显著降低[8,24-26]。本研究中,含尿素饲粮中添加FOS可有效促进体内氮沉积,导致基于摄入量和表观消化量的氮沉积均显著提高。但是对尿氮排泄量没有产生影响,可能与饲粮蛋白质水平过高有关。据NRC(1977)[27]报道,幼兔CP需求量为16%。而本试验中所使用的基础饲粮的CP水平为16.3%,在此基础上再追加1%的尿素导致饲粮中的CP含量超出了幼兔需求量。此外,本试验中添加的尿素和FOS可能产生拮抗作用,导致FOS的功能被抵消。本试验结果也显示,试验组盲肠内容物蛋白氮含量显著增加,但是蛋白氮的15N过显现量和15N添加量的百分比在2组之间均无显著差异。而且,盲肠内容物的总氮含量、微生物氮含量及其对应的15N过显现量在2组之间没有显著差异。
本研究中,试验组的门静脉血血清尿素的15N过显现比例显著低于对照组,可能原因是饲粮中添加的FOS促进了脲酶活性,使尿素快速分解生成氨。氨生成速度高于微生物的合成速度,导致氨的一部分不被利用而通过盲肠上皮细胞由血液进入肝脏中,供非必需氨基酸的合成[5];另一部分再转化为尿素,经尿排出体外[28]。本试验结果显示,肝脏中的蛋白氮含量及其15N过显现比例在2组之间并无显著差异。此结果表明,饲粮中添加的尿素在盲肠内分解生成氨,但并没有被微生物有效利用合成微生物蛋白,经血液循环通过尿液迅速排泄至体外。本试验结果中的尿氮排泄量在2组之间无显著差异也能说明此结果。另外,盲肠氨氮、尿素氮浓度及门静脉血血清尿素氮浓度无显著差异。以上结果表明,当饲粮蛋白质丰富时,盲肠微生物优先利用饲粮蛋白质,因而降低了对尿素氮的利用[29]。
本研究结果显示,近端结肠内容物鲜重、总氮、总蛋白氮含量在2组之间无显著差异,但是试验组近端结肠内容物总氮的15N过显现量、微生物总氮含量及其15N过显现量显著低于对照组。此结果可能与FOS延长盲肠内容的平均滞留时间有关。Sakaguchi等[30]报道,在大鼠饲粮中添加的FOS影响盲肠内容物重量和肠道内容物平均滞留时间。正因如以上原因,本试验中试验组的盲肠内容物鲜重显著高于对照组。
已有的研究中发现,在豚鼠饲粮中添加FOS能有效促进Ash和ADF表观消化率[31]。另有研究报道,大鼠饲粮中添加FOS能有效促进Ash表观消化率[32-33]。由此可知,FOS能有效促进大鼠和豚鼠的Ash消化。但本试验结果显示,含有尿素饲粮中添加FOS对营养物质表观消化率没有显著影响。此结果与先前的试验结果一致。先前的试验结果显示,兔饲粮中添加FOS没有有效促进营养物质表观消化率[11]。
据报道,通过大鼠口腔投喂FOS时,经3~4 h后到达大肠,在盲肠微生物的作用下发酵生成SCFA[34],作为能源被大肠上皮细胞利用[35-36],也参与体内脂肪酸和葡萄糖合成过程。另有研究报道,在大鼠饲粮中添加FOS使盲肠内容物的有机酸浓度和总量显著提高,导致盲肠膨胀[33],其SCFA组成与对照组相比有明显的差异[23]。本试验结果显示,除了盲肠内容物的丙酸浓度外,乙酸、丁酸浓度及SCFA摩尔比在2组之间均无显著差异。另外,试验组盲肠内容物鲜重及其丙酸浓度的显著提高导致有机酸总量显著增加。关于试验组盲肠内容物丙酸浓度的显著增加有待进一步研究。
4 结 论
本试验条件下,含有尿素饲粮中添加FOS可以显著提高荷兰幼兔体内氮沉积,但是饲粮蛋白质含量充足时,不能使非蛋白氮源尿素转化为体内蛋白质。

