运输抵藏对三河牛血清生化指标的影响
张新雨 郑宇慧 益西多吉 李胜利
(中国农业大学动物科技学院,动物营养国家重点实验室,北京 100193)
为促进奶业发展,西藏自治区先后引入娟姗牛、荷斯坦牛等优良奶牛品种的育成牛或冻精对本地黄牛品种进行改良。然而,由于引入品种通常体型更大、生产水平更高、代谢旺盛、耗氧量大,加之西藏自治区地处高海拔地区,氧分压低,造成牛只在进藏的运输过程中损失比例远高于低海拔地区的牛只运输[1]。2016年西藏自治区拉萨市曲水县曾引入300头娟姗牛和200头荷斯坦奶牛,研究发现,娟姗牛进入高原适应性显著高于荷斯坦奶牛,死亡率低,但所有引进奶牛的抗病能力和生产性能都没有表现出对高寒缺氧环境的长期适应性[2]。因此,测定血清生化指标、探究运输抵藏牛的生理状态十分必要。
内蒙古三河牛是我国第1个自主培育的乳肉兼用牛品种,起源于内蒙古自治区额尔古纳市三河地区,具有生产性能优良、耐粗饲、耐高寒、抗病力强、适应性强等优点。三河牛90%以上分布在呼伦贝尔市各牧场,良种三河牛多集中于农垦集团等国营农牧场,近年来实行地方性良种补贴项目,三河牛作为优秀种畜代表享受良种补贴。三河牛遗传性能稳定,同时其乳房附着良好,乳头大小适中、质地良好,乳静脉弯曲明显,且牛奶乳脂率高(达到4.1%以上)[3-5]。近年来,内蒙古地区向全国各省、市、自治区输出三河牛几十万头,也曾将三河牛出口到蒙古国等国家[6]。基于胡春华副总理西藏考察作出的指示和农业农村部办公厅印发的《畜牧产业扶贫和援疆援藏行动方案》要求,为进一步落实西藏牛业扶贫项目,在西藏自治区拉萨市开展高海拔地区奶牛适应性生产技术试验示范项目,引进三河牛进行科学研究,提高奶牛生产性能,推动西藏奶业发展[7]。然而,运输进藏的过程中,三河牛的生理状态将如何变化,目前尚未有研究报道。
因此,本试验在三河牛引入西藏拉萨市的进藏过程中,在运输起点、运输途中、运输终点分别采集三河牛的血液样品,旨在通过血清生化指标反映长途运输进藏过程中三河牛生理状态的变化,为今后西藏自治区奶牛引进运输过程中的牛只管理提供参考,为奶牛的高原适应性研究提供信息。
1 材料与方法
1.1 试验设计
2020年7月,在内蒙古呼伦贝尔市苏沁牧场和特泥河牧场根据体型外貌评分和系谱信息选择60头12~14月龄、体重[(304.12±12.02)kg]相近的三河牛后备牛运送至西藏自治区拉萨市。检查牛只健康情况,完成疾病检测,做好三河牛运输过程中“运输热”群体性防控措施,即可进行汽运进藏。本试验从60头一同运输的三河牛中随机选取12头作为研究对象,分别在运输起点(运输前,内蒙古自治区呼伦贝尔市,海拔700 m)、运输途中(运输中,青海省西宁市,海拔2 200 m)和运输终点(运输后,西藏自治区拉萨市,海拔3 650 m)采用尾根采血法采集12头试验牛的血液样品。本试验中,三河牛运输全程约5 400 km,运输途中所有牛只自由采食燕麦干草,运输时间为7 d。
1.2 样品采集
在装车运输前、运输途中和到达目的地卸车后分别对12头运输牛进行尾根静脉采血15 mL,装入真空采血管中,静置1 h,常温离心(3 000 r/min离心10 min),分离血清至冻存管,并将血清储存于液氮罐。
1.3 检测指标及检测方法
1.3.1 抗氧化酶活性及氧化产物含量
采用比色法(GF-D200型半自动生化分析仪,山东高密彩虹分析仪器有限公司)测定血清总抗氧化能力(total antioxidant capacity,T-AOC)和超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性及丙二醛(malondialdehyde,MDA)、过氧化氢(hydrogen peroxide,H2O2)含量,采用酶联免疫吸附法(Multiskan Ascent全自动酶标仪,美国Thermo公司)测定血清谷胱甘肽(glutathione,GSH)含量,所用试剂盒均购于南京建成生物工程研究所。
1.3.2 免疫球蛋白和细胞因子
采用酶联免疫吸附法测定血清免疫球蛋白A(immunoglobulin,IgA)、免疫球蛋白G(immunoglobulin,IgG)、免疫球蛋白M(immunoglobulin,IgM)、白细胞介素-2(interleukin,IL-2)、白细胞介素-6(interleukin,IL-6)、白细胞介素-10(interleukin,IL-10)含量,所用试剂盒均购于南京建成生物工程研究所。
1.3.3 肝脏功能指标
采用比色法测定血清总蛋白(total protein,TP)、白蛋白(albumin,ALB)含量和谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate ainotransferase,AST)活性,所用试剂盒均购于南京建成生物工程研究所。
1.3.4 酶活性
采用比色法测定血清碱性磷酸酶(alkaline phosphatase,ALP)和肌酸激酶(creatine kinase,CK)活性,采用酶联免疫吸附法测定血清一氧化氮合酶(nitric oxide synthase,NOS)活性,所用试剂盒采购于南京建成生物工程研究所。
1.3.5 激素指标
采用放射免疫分析方法测定血清胰岛素(insulin,INS)、生长激素(growth hormone,GH)和甲状腺素(thyroxine,T4)含量,采用酶联免疫吸附法测定血清肾上腺素(epinephrine,E)、生长激素释放激素(growth hormone releasing hormone,GHRH)和促甲状腺激素(thyroid stimulating hormone,TSH)含量,所用试剂盒均购于南京建成生物工程研究所。
1.3.6 血清其他生化指标
采用比色法测定血清钙离子(Ca2+)、磷离子(P5+)、尿素氮(urea nitrogen,UN)、葡萄糖(glucose,GLU)、总胆固醇(total cholesterol,TC)、非酯化脂肪酸(nonesterified fatty acid,NEFA)含量,采用放射免疫分析方法测定血清皮质醇(cortisol,COR)含量,采用酶联免疫吸附法测定血清血管内皮舒张因子(endothelinum-derived relaxing factor,EDRF)和瘦素(leptin,LEP)含量,所用试剂盒均购于南京建成生物工程研究所。
1.4 数据统计分析
试验数据经Excel 2019汇总整理后,采用SAS 9.2软件的ANOVA过程进行单因素方差分析,使用Turkey法进行多重比较。结果以平均值和均值标准误(SEM)表示,P<0.05表示差异显著。
2 结 果
2.1 运输抵藏对三河牛血清抗氧化酶活性及氧化产物含量的影响
如表1所示,运输前和运输后的血清SOD活性显著高于运输中(P<0.05),运输前和运输中的血清CAT活性和H2O2含量显著低于运输后(P<0.05)。运输过程中血清T-AOC、GSH-Px活性和MDA含量均未见显著差异(P>0.05)。

表1 运输抵藏对三河牛血清抗氧化酶活性及氧化产物含量的影响
2.2 运输抵藏对三河牛血清免疫球蛋白和细胞因子含量的影响
如表2所示,运输过程中血清IgA、IgG、IgM、IL-2、IL-6、IL-10含量均未见显著差异(P>0.05)。

表2 运输抵藏对三河牛血清免疫球蛋白和细胞因子含量的影响
2.3 运输抵藏对三河牛血清激素指标的影响
如表3所示,运输中和运输后的血清INS含量显著低于运输前(P<0.05),运输后的血清COR含量显著低于运输前(P<0.05),运输前和运输中的血清T4含量显著高于运输后(P<0.05)。运输过程中血清GH、GHRH、TSH、E含量均未见显著差异(P>0.05)。

表3 运输抵藏对三河牛血清激素指标的影响
2.4 运输抵藏对三河牛血清酶活性和肝功能指标的影响
如表4所示,运输中和运输后的血清ALP活性和TP、ALB含量显著高于运输前(P<0.05),运输中的血清ALT活性显著高于运输前和运输后(P<0.05)。运输过程中血清CK、NOS、AST活性均未见显著差异(P>0.05)。
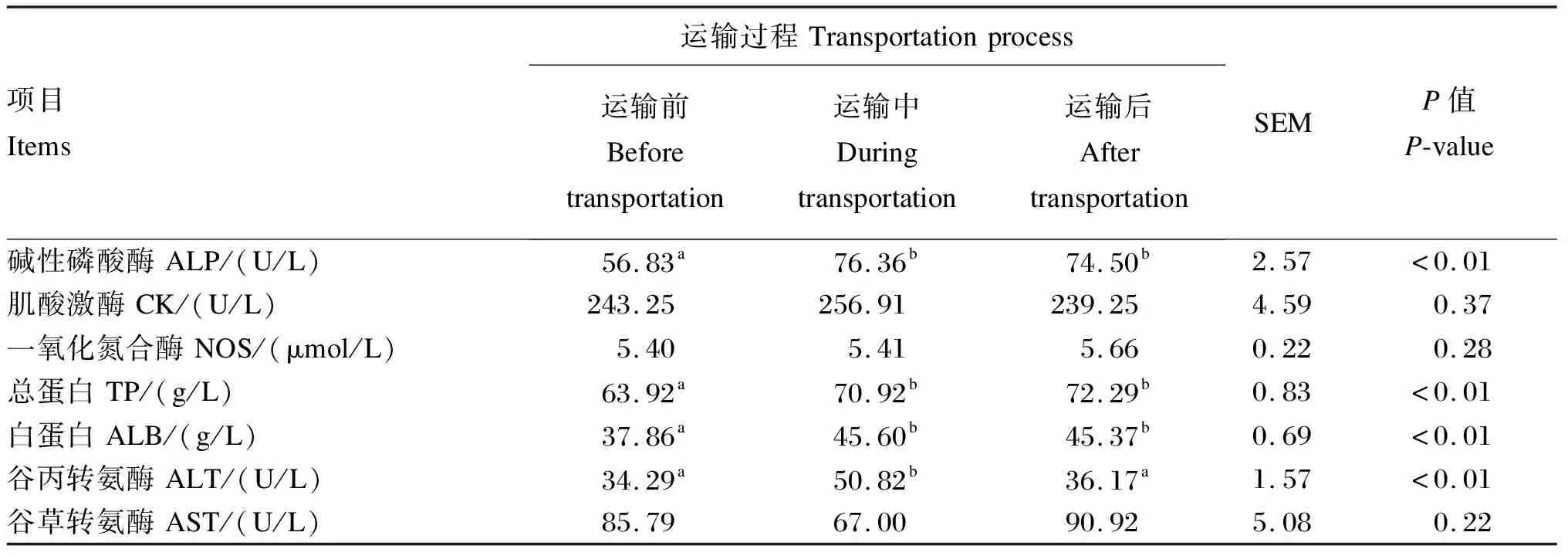
表4 运输抵藏对三河牛血清酶活性和肝功能指标的影响
2.5 运输抵藏对三河牛血清其他生化指标的影响
如表5所示,运输中和运输后的血清GLU含量显著高于运输前(P<0.05),运输中和运输后的血清Ca2+含量显著高于运输前(P<0.05),运输后的血清P5+含量显著高于运输前和运输中(P<0.05),运输前和运输后的血清UN含量显著高于运输中(P<0.05)。运输过程中血清TC、NEFA、EDRF含量均未见显著差异(P>0.05)。

表5 运输抵藏对三河牛血清其他生化指标的影响
3 讨 论
3.1 运输抵藏对三河牛血清抗氧化酶活性及氧化产物含量的影响
动物自身具有一套完整的抗氧化酶防御系统,T-AOC、SOD、GSH-Px、MDA、CAT等指标可以反映机体抗氧化能力。在氧化应激反应中,H2O2是化学性质活泼的活性氧,它和细胞凋亡、细胞增殖等密切相关。SOD可以将超氧阴离子转换为H2O2,CAT可将活性氧代谢产物H2O2转化成无害物质[8-9]。本试验条件下,与运输前和运输中相比,运输后三河牛血清CAT活性显著上升,可能是由于细胞氧自由基平衡被高原缺氧环境和长途运输造成的应激状态打破,同时运输过程中血清SOD活性先降低后上升,可能由于三河牛后期在逐渐适应长时间的汽运及海拔高度的上升,运输过程中血清抗氧化活性酶和氧化产物含量的变化是机体对长途运输和高海拔缺氧环境做出的必要反应。
3.2 运输抵藏对三河牛血清免疫免疫球蛋白和细胞因子含量的影响
IL-2和IL-6是促炎性细胞因子,参与炎症反应。IL-10是体内一种抗炎性细胞因子,具有抑制炎症反应的作用。IgA是主要的外分泌免疫球蛋白,可以抵抗微生物的入侵;IgM对黏附病原体、激活补体免疫系统有重要作用;IgG在机体内含量远高于其他免疫球蛋白,在机体抗感染过程中起主要作用。本试验条件下,运输过程中三河牛血清IgA、IgG、IgM、IL-2、IL-6、IL-10含量均有所上升,但未达到显著水平,这说明长途运输抵藏的过程没有对三河牛免疫能力造成显著影响。
3.3 运输抵藏对三河牛血清激素指标的影响
INS、GH、T4是调节营养物质代谢的重要激素,在动物的代谢和生长中起关键作用[10]。INS在调节机体血液GLU含量稳定方面发挥着重要作用。在应激情况下,通常INS分泌减少而胰高血糖素分泌加强。INS的分泌受血液中多种激素、细胞因子和代谢物质的影响。有研究表明,猪运输后其血清INS含量显著下降[11],运输应激状态下INS的分泌减少有利于机体动员更多能量以克服应激源作用[12],这与本试验结果一致。Lay等[13]研究发现,青年牛在经过多次运输或长途运输后,其血清COR含量逐渐降低,最后趋于平稳,这与本试验中三河牛血清COR含量在运输过程中显著降低的趋势一致,这可能是运输途中三河牛机体代谢下降造成的。高海拔低氧低压环境下,动物机体肾上腺皮质能力增强,从而抑制应激反应过度,以增强抵抗力,保持并恢复内环境稳定[14]。本试验也发现运输过程中三河牛血清E含量上升,但未达到显著水平。T4是由甲状腺分泌的含碘的酪氨酸,是畜禽调节机体代谢的重要激素[15],T4能促进蛋白质、糖原分解以增加能量供给,满足长途运输中增加的能量需要[16]。本试验中,运输前和运输中的血清T4含量显著高于运输后,这与Fazio等[17]研究短途公路运输对马的影响中T4释放增加的结果一致。
3.4 运输抵藏对三河牛血清酶活性和肝功能指标的影响
酶在机体发生生化反应时起到催化的作用,血清中酶活性标志着细胞的代谢水平和机体生长发育状况[18]。例如,血液中ALP参与脂肪消化代谢,其活性与畜禽生长速度及生产性能呈正相关[19];转氨酶是肝细胞损害的敏感标志,能反映蛋白质合成、动物体对营养物质消化率及机体的生长情况[20]。有研究发现,动物进入高海拔后,机体为适应缺氧环境,可能引起自身肝脏功能变化,进而影响脂类代谢[21]。ALP广泛存在于各器官,其中以肝脏居多,ALP主要功能是核酸、蛋白质、生物碱等底物去磷酸化,生成羟基和磷酸根离子。通常认为血清ALP活性升高是由肝脏受损造成的。本试验中,血清ALP活性在运输中和运输后显著增加,这可能由于长途运输抵达西藏的过程中三河牛肝脏功能出现一定程度的损伤;此外,有研究发现糖皮质激素的增加也会导致血清ALP活性的增加,这与本试验中血清COR含量和ALP活性协同上升结果一致。本试验中,运输中三河牛的血清ALT活性显著高于运输前和运输后,这可能由于运输过程中酶活性发生改变造成[16]。血清ALB具有维持血液正常胶体渗透压和pH、运输多种代谢废物、调节被运输物质的生理作用和功能,TP、ALB含量可以反映肝脏的代谢能力。本试验中,运输中和运输后的血清TP、ALB含量显著高于运输前,此结果与前人禁水禁食运输肉牛33 h的结果[16]存在差异。综上所述,三河牛血清ALP、ALT活性及TP、ALB含量的变化说明运输过程中机体肝脏功能存在一定程度的损伤。
3.5 运输抵藏对三河牛血清其他生化指标的影响
运输中和运输后的血清Ca2+含量显著高于运输前,运输后的血清P5+含量显著高于运输前和运输中,可能由于三河牛高海拔应激时机体代谢紊乱造成的。Wang等[22]研究发现,兰尼碱受体2基因编码的蛋白是钙通道上Ca2+运输的重要组成因子,当处于缺氧环境中,通常会导致细胞内Ca2+的释放,引发心肌兴奋-收缩耦联过程,刺激细胞收缩,应对低氧反应。血清UN含量能够反映动物生长状况、蛋白质合成及饲粮蛋白质的利用等情况[23],此前有研究发现血液中UN含量与机体生长速度和蛋白质沉积呈负相关[24-25]。本试验中,血清UN含量随着运输过程先减少后增加,反映了运输过程中三河牛的生长状况和蛋白质合成,这可能是三河牛在运输过程机体代谢出现紊乱造成的。血钙是肌肉收缩心肌功能及神经肌肉应激所必需的,保持血钙水平对维持动物体正常生命活动意义重大。运输中和运输后三河牛血清GLU含量显著上升,研究人员使用小鼠为模型模拟高原低氧环境时发现动物机体可能会出现血糖代谢紊乱的现象[26],这印证了本研究的结果。
4 结 论
运输抵藏过程中,三河牛血清抗氧化酶活性及氧化产物含量、激素含量和部分生化指标均有所变化,这是三河牛对运输抵藏过程中的运输应激和高原缺氧应激做出的应答。本研究揭示了三河牛长距离运输抵藏过程中血清生化指标的变化,可为高海拔地区奶牛引进运输过程中的牛只管理提供参考信息。

