转录因子Sox5在多发性硬化患者中表达的研究
傅增辉,林再红,金 艳,姜 岩,刘 晶,于绘丽,张广萍
多发性硬化(multiple sclerosis,MS)是一种炎性脱髓鞘性神经疾病(inflammatory demyelinating diseases,IDD)。辅助性T细胞17 (helper T 17,Th17)产生白细胞介素17A (interleukin-17A,IL-17A)并在MS等多种自身免疫性疾病中发挥致病作用[1,2]。活化的CD4+T细胞需要IL-6等细胞因子刺激发育成Th17细胞[3,4]。由于维甲酸相关核孤儿受体γt(retinoicr acid-related orphanreceptorγt,RORγt)的过度表达诱导Th17细胞分化,而RORγt缺陷型小鼠缺乏Th17细胞分化,RORγt被认为是Th17细胞的谱系特异性转录因子[5]。Th17细胞中诱导RORγt的潜在机制,已证明IL-6介导的Stat3激活起着核心作用[6]。Shigeru等[7]报道,Sox5通过作为Stat3下游靶标的RORγt的诱导协同诱导Th17细胞分化。本研究组在前期的研究中发现,复发缓解型MS患者的急性加重期外周血Th17细胞RORγt表达水平高于缓解期,且缓解期高于健康对照者[8]。Hiramatsu等对IL-6刺激的CD4+T细胞进行DNA芯片分析报道中,证实IL-6-Stat3途径的下游靶点的转录因子参与Th17细胞分化[9]。Sox5在系统性红斑狼疮、类风湿关节炎等自身免疫疾病的发生中扮演重要角色,Riveros等[10]报道,Sox5是MS患者全血中最显着上调的转录因子之一。本研究拟探讨MS患者外周血Sox5表达水平,分离并培养外周血CD4+T细胞,采用IL-6刺激CD4+T细胞分化为Th17细胞,检测Sox5和RORγt等因子水平,现报道如下。
1 资料和方法
1.1 研究对象 收集齐齐哈尔医学院附属第三医院神经内科门诊和病房2015年1月至2018年12月确诊的急性发作期的复发-缓解型MS汉族患者20例作为研究对象。纳入要求:符合《多发性硬化诊断和治疗中国专家共识》[11]诊断标准和McDonald诊断标准[12]。需排除项目:①肝炎病毒感染;②滥用酒精;③合并其他免疫相关疾病,如系统性红斑狼疮、强直性脊柱炎、肿瘤等患者。所有MS患者进行扩展残疾状况评分量表(expanded disability status scale,EDSS)评分。选取本院体检中心、实习学生等与病例组在性别、年龄相匹配的人为健康对照者。整个研究经医院伦理委员会的批准通过,均符合赫尔辛基宣言[13]要求,并得到所有研究对象知情同意。
1.2 标本采集 急性发作期MS入院后均给予甲基泼尼松龙1000 mg/d,3 d后减至500 mg,每3 d减一半减至40 mg时改为口服,每周减4 mg至结束,及营养神经(如甲钴胺等)等治疗。采集MS患者治疗前、治疗4 w后及组健康对照者清晨空腹采肘静脉血10 ml,各5 ml分别加入无抗凝剂干燥管和EDTA-K2抗凝管,用于后续检测用。
1.3 血清Sox5水平测定 ELISA检测试剂盒购于BD公司,检测IL-17水平,严格说明书操作,每个样本和标准品均设3个复孔。
1.4 外周血CD4+T细胞分离培养及培养基IL-17A检测 所有研究对象血样进行单核细胞的分离,以密度梯度离心法进行。流式细胞术分选研究对象外周血中CD4+T细胞亚群,重悬于细胞培养基并计数,按照合适比例接种于96孔板内,按照如下分组体外刺激培养7 d:组1为健康人CD4+T细胞不给予刺激的空白组,除培养基外不增加任何其他成分;组2为健康人CD4+T细胞给予IL-6刺激组,培养基加入前炎症因子IL-6(25 ng/ml);组3 为MS患者CD4+T细胞不给予刺激的空白组,除培养基外不增加任何其他成分;组4为MS患者CD4+T细胞给予IL-6刺激组,培养基加入前炎症因子IL-6(25 ng/ml)。ELISA试剂盒购于BD公司,检测孔中细胞培养上清中Sox5和IL-17A水平,具体操作方法按照试剂盒说明书进行操作,每个样本和标准品均设3个复孔。
1.5 培养CD4+T细胞中Th17细胞水平测定及分离 根据Th17的表面标记进行染色,完成PE-标记CD4抗体和FITC-标记IL-17A抗体胞内染色,4 ℃孵育30 min,PBS重悬,300 r/min离心5 min后去上清,再次加入50 μl PBS重悬,转移入流式管内,行流式细胞分析。
1.6 Th17细胞Sox5和RORγt mRNA表达水平测定 按TRIzol试剂说明书分别提取总RNA,采用RNA纯化试剂盒纯化总RNA。进一步使用Nanodrop ND-1000紫外分光光度计对总RNA进行定量和质量分析。反转录试剂盒将RNA行逆转录反应为cDNA,取2 μL RNA进行PCR扩增。β-actin内参引物序列:Upstream:5’-CTGGAACGGTGAAGGTGACA-3’;Downstream:5’-AGGGACTTCCTGTAACAATGCA-3’;Sox5引物序列:Upstream:5’-CAGCCAGAGTTAGCACAATAGG-3’;Downstream:5’-CTGTTGTTCCCGTCGGAGTT-3’;RORγt引物序列:Upstream:5’-GGCTCCCTGGATGAATAGAATG-3’;Downstream:5’-AGGCAGAGGCAGAAAATGTAAAG-3’。扩增条件:95℃ 预变性2 min,1个循环;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃总延伸6 min。所有样品做3个复孔,分析待测标本的扩增熔解曲线,均为单峰,无非特异性扩增。根据待测标本的Ct值,引物序按照2-△△CT相对定量计算公式计算各样品的目的基因相对定量结果,分析目的基因mRNA转录水平差异。
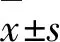
2 结 果
2.1 两组一般资料比较 健康对照20例(男6例,女14例),平均年龄(38.20±11.47)岁;MS组20例(男6例,女14例),平均年龄为(38.20±11.47)岁。对照组和MS组的年龄和性别相比差异均无统计学意义(见表1)。

表1 两组一般资料比较
2.2 Sox5在MS患者血清中的表达水平及与临床相关性分析 ELISA结果显示,20例MS患者急性期[(14.32±1.56)ng/ml]外周血血清中Sox5水平高于治疗后[(9.37±2.10)ng/ml,(t=3.519,P<0.001)],且高于20例健康对照组[(3.02±0.75)ng/ml,(t=8.343,P<0.001)],差异有统计学意义。Pearson 相关系数分析显示,MS患者急性期Sox5与EDSS(r=0.203,P=0.185)、年龄(r=0.130,P=0.602)评分之间不存在相关性。
2.3 CD4+T细胞培养Sox5、IL-17A和Th17细胞水平 对培养基中Sox5和IL-17A进行ELISA检测、Th17细胞比例行流式细胞术检测,活化的CD4+T细胞需要用IL-6刺激发育成Th17细胞,结果显示,健康对照者CD4+T细胞培养基给予IL-6刺激并不能增加Sox5、IL-17A和Th17细胞比例水平;急性期MS患者CD4+T细胞培养基给予IL-6刺激可以显著增加Sox5、IL-17A和Th17细胞比例水平(见图1、表2)。

图1 CD4细胞中Th17细胞流式细胞图

表2 CD4+T细胞培养Sox5、IL-17A和Th17细胞水平
2.4 Th17细胞Sox5和RORγt mRNA表达水平 流式细胞术分选培养基中Th17细胞,后RT-PCR法测定ox5和RORγt mRNA表达水平,结果显示,健康对照者CD4+T细胞培养给予IL-6刺激并不能增加Th17细胞Sox5和RORγt mRNA表达水平,而急性期MS患者CD4+T细胞培养给予IL-6刺激能够增加Th17细胞Sox5和RORγt mRNA表达水平(见表3)。
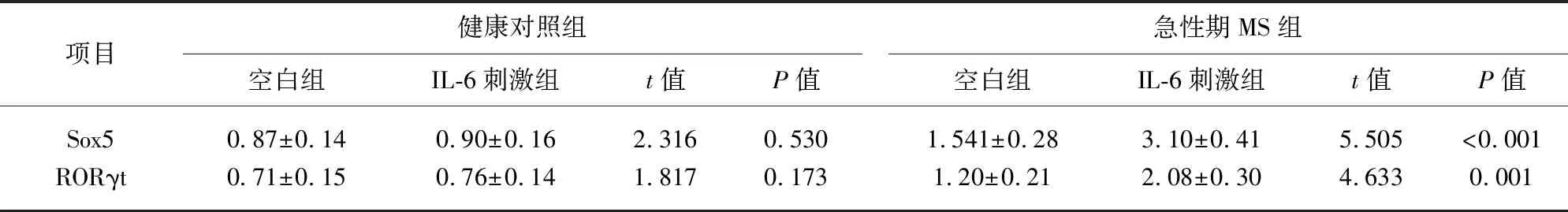
表3 体外培养Th17细胞Sox5和RORγt mRNA表达水平
3 讨 论
Sox5是转录因子SOX家族成员,属于SoxD组,由Sox5,Sox6和Sox13组成[14]。Sox5具有三个功能域,一个HMG盒DNA结合域和两个卷曲螺旋域,第一个卷曲螺旋域介导SoxD蛋白的同型和异型二聚化。SoxD蛋白本身不具有反式结构域,因此其活性可能会受到与其相互作用的其他分子的影响。缺乏Sox5的小鼠出生后通常存活困难死于神经发育异常[15],Sox5在精子细胞、神经元和少突胶质细胞等呈现高表达。尽管许多研究表明Sox家族蛋白在发育过程中的作用[14],但只有少数Sox家族蛋白在T细胞发育和分化中的发挥作用。Shigeru等[7]报道,Sox5在Th17细胞中表达,并与c-Maf一起在Th17细胞分化过程中诱导RORγt表达。关于Sox5与自身免疫性疾病之间的关系,Riveros等[10]报道,Sox5是多发性硬化症患者全血中最显着上调的转录因子之一。此外,对IL-6刺激的CD4+T细胞的DNA芯片分析表明,在IL-6刺激后,Sox5是CD4+T细胞中诱导最显著的转录因子。Lefebvre等[14]报道,在CD4+T细胞中诱导IL-17A产生需要Sox5的一个卷曲螺旋结构域,该卷曲螺旋结构域显示出介导Sox蛋白的同二聚化和异二聚化。Melichar等[16]关于SoxD在CD4+T细胞中的结合伴侣的研究报道中,部分SoxD家族成员Sox13和Sox6 在mRNA水平未在CD4+T细胞中高表达,Sox5是CD4+细胞表达的SoxD家族中唯一的参与 T细胞分化的因子,并通过诱导RORγt表达参与Th17细胞分化。
Durant等[17]在EAE小鼠模型的研究报道中,Sox5对于Th17分化过程中RORγt的表达至关重要。Lazarevic等[18]在体外细胞学研究报道中,Sox5的高表达均可诱导CD4+T细胞向Th17细胞分化;在敲除RORγt基因的CD4+T细胞中,Sox5的高表达不能诱导Th17细胞分化;并且,Sox5的高表达诱导CD4+T细胞中RORγt的表达可能通过结合其调控元件发挥作用。Sox5作为Th17细胞分化过程中Stat3信号的下游效应子和RORγt表达的上游激活物之一参与IL-17A的产生,并独立于其他Th17细胞相关分子[19,20]。在本研究中,对MS患者外周血清Sox5蛋白水平进行检测,发现其在MS患者表达水平增高,那么,Sox5是否在Th17细胞介导的多发性硬化的免疫应答的发展中起关键作用,并且Sox5可能通过诱导RORγt表达在Th17细胞分化中扮演重要角色。本研究对健康者PBMC中的CD4+T细胞进行培养,给予IL-6刺激并未发现Th17细胞水平、IL-17A、Sox5和RORγt表达的变化;但在MS患者PBMC中的CD4+T细胞进行培养,活化的CD4+T细胞需要用IL-6刺激发育成Th17细胞,给予IL-6刺激组的MS患者CD4+T细胞后,其Th17细胞水平、IL-17A、Sox5和RORγt表达增高,Sox5与MS发病相关,推测高表达的Sox5可能通过介导RORγt干预Th17细胞分化影响IL-17A表达,促进MS免疫反应。但Sox5的具体作用机制尚需进一步分子生物学研究,进一步研究Sox5在MS发病的作用可能为其临床治疗提供新的靶点,并为临床的早期诊断提供可能的外周血标志物。

