MAGiC序列在乳腺肿瘤良恶性鉴别诊断中的应用
柴青焕,胡晓欣,肖 勤,杨 孟,岳 磊,顾雅佳
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
乳腺疾病是女性常见疾病,而乳腺癌是严重威胁女性健康的主要乳腺疾病之一。近年来,乳腺癌发病率逐年升高,根据世界卫生组织(World Health Organization,WHO)最新癌症统计报告,乳腺癌已经取代肺癌,成为全球第一大癌症[1]。早发现、早治疗是提高患者生存率的有效途径。因此,乳腺病变的早期发现及准确鉴别对患者治疗方案的选择和预后情况的评估均有重要意义[2]。目前,乳腺疾病的常规影像学检查方法主要包括超声检查、乳腺X线摄影和磁共振成像(magnetic resonance imaging,MRI)[3]。相较于超声检查和乳腺X线摄影,MRI具有软组织对比度良好、可多方位及多序列成像、无电离辐射、病灶检出率高和定量信息丰富等优势,可以对疾病进行定量、定性分析,提供更加精准的诊断信息以评估治疗效果及提示预后[4]。定量MRI(quantitative MRI,QMRI)技术是通过某些特殊的序列,如定量图谱MRI(MRI compilation,MAGiC)序列,测量或者反映组织的某些特性值的技术。QMRI不仅能提供组织器官的基本结构信息,也能提供病变发生、发展过程中丰富的生物学和病理生理学信息,是目前国际上MRI研究的前沿技术[5]。QMRI技术通过研究疾病对单一组织参数的改变,提高对疾病的灵敏度[6];可测量的定量参数包括Tl、T2、质子密度(proton density,PD)、弥散常数、磁化转移(magnetic transfer,MT)及磁共振波谱的胆碱CHO值等[7]。近年来的研究[8-9]表明,QMRI有助于乳腺病变程度的诊断。
美国GE医疗研发了多对比度QMRI序列MAGiC,该序列一次扫描可得到多种不同对比度的图像,包括T1、T2、T1液体抑制反转恢复( fluid-attenuated inversion recovery,FLAIR)、T2 FLAIR、短反转时间反转恢复(short inversion time inversion recovery,STIR)、双反转恢复(dual inversion recovery,DIR)和PD加权图像,提供了更多的对比度图像信息[10]。MAGiC序列首次实现了MRI图像从常规灰阶图像到组织定量图谱的转变,得到定量化数据,可以更加灵活且回溯性地对图像进行各种调节,获取更多有价值的定量图像数据,帮助医师进行更优的临床决策。此外,MAGiC在定量测量组织的弛豫时间T1、T2和PD值时,无需增强扫描,避免了动态增强MRI检查造影剂造成的不可逆性肾损伤[11]。因此,本研究拟通过采用MAGiC扫描序列对乳腺病灶的T1、T2、PD值进行比较,探讨MAGiC序列在乳腺肿瘤恶性程度诊断中的应用价值。
1 资料和方法
1.1 资料
收集2020年1—8月在复旦大学附属肿瘤医院初次行MRI检查(包括MAGiC序列扫描),有乳腺肿物且此后继续在院治疗的女性乳腺疾病患者42例。年龄25~72岁,平均年龄47岁。纳入标准:女性,25~75岁,乳房肿块可触及,乳腺影像报告和数据系统(Breast Imaging and Reporting Data System,BI-RADS)分级4A以上[14],MRI检查后在本院有穿刺、活检或手术后病理学检查报告。排除标准:处于妊娠或哺乳期;MRI检查前有抗肿瘤治疗史,既往有乳腺癌或其他恶性肿瘤化疗史。本研究符合《赫尔辛基宣言》的要求,并获得患者知情同意。
1.2 方法
1.2.1 MAGiC序列的定量及多对比图像的生成
多动态多回波使用相同的梯度反转过程的重复形式,用于产生单个梯度回波,该梯度回波在单个射频脉冲后又产生额外的梯度回波[12]。多重(或双重)回波梯度回波,当横向磁化完全消失时T2弛缓尚未发生。基于多动态多回波的MAGiC序列是一个定量序列,能对组织的物理性质如纵向弛豫时间T1、横向弛豫时间T2、PD、纵向弛豫率R1(纵向弛豫时间T1的倒数)、横向弛豫率R2(横向弛豫时间T2的倒数)等进行绝对定量,而不依赖于MRI扫描仪设置。
MAGiC成像利用对多种物理性质的定量探测,仅通过1次扫描合成与常规T1、T2、T1 FLAIR、T2 FLAIR、PD和STIR等常规MRI图像相似的MRI图像[13];从1次扫描中重建多重对比,如重复时间(repetition time,TR)、回波时间(echo time,TE)和反转时间(inversion time,TI)等参数可通过数学推理进行修改,而非预先确定。因此,MAGiC序列中R1、R2和PD值的定量通过设置回波时间TE和重复时间TR的任意组合,生成T1加权图像(T1-weighted imaging,T1WI)、T2加权图像(T2-weighted imaging,T2WI)或PD加权图像(PD-weighted imaging,PDWI)来测量。反转恢复图像,如FLAIR图像和STIR图像也可通过添加TI得到;此外,利用2个反转延迟时间(TI1和TI2)可合成DIR图像。
1.2.2 图像采集
采用美国GE公司的Signa Pionner 3.0 T MRI扫描仪,使用8通道乳腺专用相控阵表面线圈。患者俯卧于专用的乳腺相控阵表面线圈上,使双侧乳房自然悬垂于线圈孔洞内[15]。在常规的临床乳腺MRI检查中增加MAGiC序列。在注射造影剂前行MAGiC序列扫描,扫描参数:8个自动计算的反转恢复时间,TR=4 128 ms,层厚=4.5 mm,层间隔=0.5 mm,视野=30 cm,图像矩阵=224×224,带宽=31.25 kHz。
1.2.3 图像处理
扫描所得的MAGiC图像使用MAGiC viewer后处理软件打开并处理。获得T1WI、T2WI、PDWI、FLAIR、STIR、DIR等各种对比度图像;同时也得到T1map、T2map以及PDmap等定量图谱。参照常规乳腺MRI增强图像,在MAGiC序列扫描获得的各种对比度图像中,选取病灶的最大直径层面勾画感兴趣区(region of interest,ROI)。每个受试者图像所勾画的ROI中所有体素的平均T1、T2和PD值将由MAGiC viewer自动计算得出(图1)。良性与恶性分别有不同的定量值,乳腺良恶性T1、T2、PD值的对比实例如图2所示。

图1 MAGiC viewer自动计算定量值示例
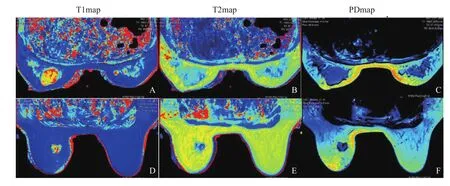
图2 乳腺良恶性病变T1、T2、PD定量图谱的比较
1.3 统计学处理
本研究根据病理学检查结果将受试者分为良性和恶性两类。基于SPSS 24.0软件对良性组和恶性组对应的定量指标(T1、T2、PD值)及年龄进行统计学分析。首先,对T1、T2、PD及年龄差异进行显著性检验,采用Shapiro-Wilk检验进行正态性检验、Levene检验判断两组数据观测变量是否方差齐(方差相等),在经检验满足独立样本t检验假设条件的前提下,进行独立样本t检验;然后,基于t检验结果,将差异有统计学意义(P<0.05)的变量,在经检验满足logistic回归假设条件前提下,纳入logistic回归模型进行分析;最后,采用支持向量机(support vector machine,SVM)分类算法训练分类器对数据进行分类实验,分别使用径向基函数(radial basis function,RBF)及多项式等方式作为执行SVM处理的内核函数,调整训练模型至有比较好的预测质量。
2 结 果
2.1 临床资料
选取42例年龄为25~72岁、明确有乳腺肿块的患者行MAGiC序列扫描。良恶性患者情况:良性共18例,纤维腺瘤5例,导管不典型增生3例,囊肿1例,炎性改变9例;恶性共24例,浸润性导管癌20例,导管原位癌4例。
2.2 独立样本t检验
经统计学分析得到良恶性乳腺肿瘤的T1、T2、PD、年龄箱式图(图3)。可以看出,本研究的各组数据中没有显著异常值,满足独立样本t检验的假设条件。

图3 良性组和恶性组的T1、T2、PD、年龄箱式图
本研究采用独立样本t检验,判断良恶性乳腺肿瘤在T1、T2、PD及年龄上的差异。研究数据不存在显著异常值,且在各组内接近正态分布,同时方差齐。其独立样本t检验结果如表1所示。

表1 良性组和恶性组T1、T2、PD、年龄的独立样本t检验分析结果
结果表明,良性组平均T1值高于恶性组,差异有统计学意义(t=8.423,P<0.001);良性组平均T2值高于恶性组,差异有统计学意义(t=2.224,P=0.032);PD差异无统计学意义(t=0.770,P=0.446);年龄差异无统计学意义(t=-0.652,P=0.518)。综上所述,T1,T2值可选取作为判断良恶性乳腺肿瘤的特征。
2.3 Logistic回归分析
本研究采用二分类logistic回归评估T1、T2和年龄对研究对象良恶性乳腺肿瘤的影响。使用Box-Tidwell方法检验连续自变量T1、T2和年龄与其logit转换值间是否为线性时模型共纳入6项,Bonferroni校正后显著性水平为0.008 33(0.05/6)。线性检验结果得到所有连续自变量与其logit转换值间存在线性关系。最终,得到的logistic模型具有统计学意义(χ2=40.277,P<0.001,表2)。该模型能够正确分类90.5%的研究对象。模型的灵敏度为91.7%,特异度为88.9%。模型纳入的3个自变量中,T1表现出显著的统计学意义。
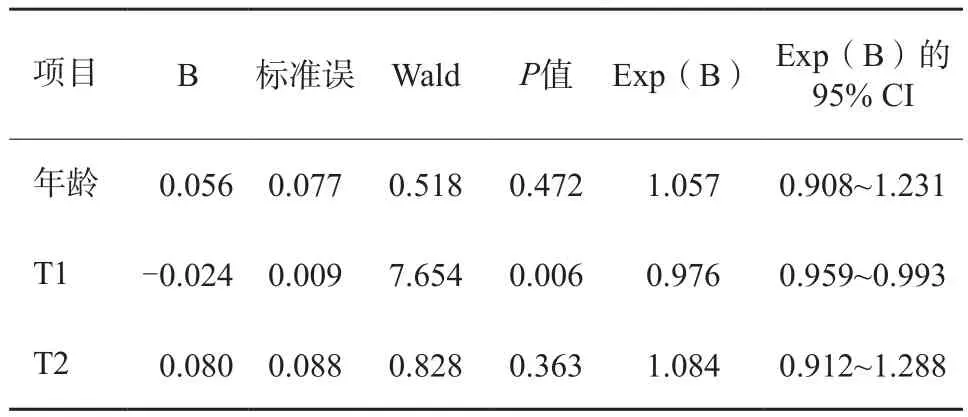
表2 logistic回归分析结果
2.4 基于SVM分类器检测
采用SVM分类算法和留一交叉验证的方法训练分类器进行分类实验,根据准确度、灵敏度、特异度和曲线下面积(area under curve,AUC)这4个指标来评判分类结果的质量,具体结果见表3,其中采用多项式作为内核函数训练分类器能够得到较好的准确度和灵敏度(分别为0.929和1.000)。

表3 基于SVM分类的结果
3 讨 论
MAGiC序列在1次扫描中提供多种不同对比度的图像和多种定量图谱,包括T1WI、T2WI和PDWI图等。MAGiC序列的应用可获得常规对比图像无法获得的定量值,为疾病诊断、疗效评价和预后研究等提供一个强大的定量工具,同时也可减少MRI扫描和阅片的时间。本研究中我们利用MAGiC序列扫描得到的图像,对乳腺良恶性病变进行T1、T2、PD值的差异分析,以期对乳腺病变提供更全面的功能表征。在本研究中,我们发现乳腺恶性病变的平均T1、T2值均显著高于良性病变,而PD值差异无统计学意义。
在T1、T2两种定量指标中,定量T1值显示出较高的鉴别诊断效率,两种指标相结合能进一步提高乳腺癌良恶性的诊断准确度,为改善患者治疗和预后提供了重要信息。MRI是多参数成像,T1和T2值取决于组织成分,如大分子浓度、水化状态和组织含水量[12]。肿块的成分受到病理、生理条件的影响,定量的T1和T2值可以根据组织成分的变化,反映可能的病理学性质。
本实验中乳腺肿块良性病变与恶性病变的T1值存在显著差异,良性组T1(1 569.67±139.045)高于恶性组(1 233.71±119.025),差值为335.958(95% CI 255.348~416.569),这个结果与Meng等[16]和与Chen等[17]研究的结果不同。纵向弛豫时间T1是组织的固有属性之一。在相同场强的磁场环境下,不同的组织具有不同的T1;同一组织在不同场强的磁场中亦表现出不同的T1;更为重要的是,同一组织生理状态下的T1和病理状态下的T1同样表现不同。Chen等[17]在场强为3 T的磁场下对比了志愿者的纤维腺瘤组织T1值[(1 256±171)ms]和浸润性导管癌的T1值[(1 183±256)ms]差异无统计学意义。本研究和Meng等[16]及Chen等[17]研究结果产生差异的原因可能与所使用的磁场环境、序列参数及患者选择的不同有关。本研究所选取的是MRI报告为BI-RADS 4A以上有明确肿块的患者,良恶性以病理学检查结果为金标准;良性患者不局限于纤维腺瘤,这也可能是导致研究结果不同的原因。同时在Chen等[17]的研究中,计算了年轻健康志愿者正常实质的T1值,证实了年轻女性的实质受到激素水平的显著影响,T1值在月经周期波动。健康志愿者的ROI中分布的脂肪组织比有乳腺病变的女性多。这种差异可能导致健康志愿者的T1值超过乳腺病变患者的T1值。进一步大样本量的研究将有助于获得更准确的T1定量结果。
弛豫过程是一个能量转变的过程,需要一定的时间,组织的T1和T2弛豫时间是同时发生的。本研究中乳腺良性肿块组T2值[(92.56±12.296)ms]高于恶性肿块组T2值[(85.50±8.262)ms],差值为7.056(95% CI 0.644~13.467);与既往研究[16,18]一致。影响乳腺T2值的因素很多,包括水分含量、纤维组织含量、乳腺组织细胞密度等。人体内的水可分为自由水和结合水,其中自由水由于分子较小,横向弛豫时间较长。而生物大分子与水的结合显著缩短了T2。因此,自由水的量决定了横向弛豫时间T2[19];在乳腺癌中,具有丰富细胞质的大的乳腺癌细胞快速生长,导致恶性肿瘤中的组织细胞密度高于良性病变。肿瘤组织常伴有细胞坏死,大分子物质释放到细胞周围的空间,使细胞外空间进一步缩小;特别是浸润性癌症,淋巴细胞和浆细胞浸润间质,导致游离水减少,缩短了横向弛豫时间。同时,在良性病变中,如纤维腺瘤中的黏液样变性和乳腺疾病中慢性炎症引起的间质水肿延长了横向弛豫时间。因此,T2值的差异对于鉴别乳腺良恶性病变具有参考价值。如Liu等[20]利用常规T2 mapping技术,发现乳腺良恶性病变的T2均值分别为94.48和82.69 ms。Jung等[18]也通过SyMRI得到乳腺癌T2均值为84.75 ms。证实了乳腺良性病变的T2值高于恶性病变这一结论。未来我们将进一步探索MAGiC序列在健康受试者和乳腺病变患者中测量的定量值,以及MAGiC序列在乳腺MRI增强扫描前和增强扫描后测量的定量值的不同,来准确地对乳腺良恶性病变的T1、T2值界定一个标准。
本研究存在局限性。首先,我们没有将MAGiC序列所测得的T1、T2值与常规序列所测得的T1、T2值进行比较。其次,我们测量的是每个病变最大直径所在图像层面的T1、T2值,而不是整个病变,可能丢失了其余病变的细节。第三,ROI的测量为手动测量,可能存在测量误差。第四,本研究所获得的样本量尚小,需要增加样本量来确定乳腺癌和良性病变的T1和T2值的范围。
本研究表明基于MAGiC序列获得的定量T1和T2值可以有效地区分乳腺良恶性病变,T1弛豫时间表现出较高的诊断效率。T2弛豫时间虽然在t检验过程中差异有统计学意义,但在逻辑回归分析时没有表现出显著差异,这可能与T2弛豫时间自身时间短、变化不明显有关。总之,在MRI中,基于MAGiC序列的定量MRI技术能够提高乳腺良恶性病变的诊断价值;在常规乳腺MRI的基础上可提供更多的鉴别诊断依据,值得临床应用和推广。

