超声联合酶处理下TG酶交联大豆分离蛋白凝胶特性研究
李 杨 马召蕾 郑 丽 黄雨洋 金技峰 滕 飞
(1.东北农业大学食品学院,哈尔滨 150030;2.哈尔滨商业大学食品工程学院,哈尔滨 150030;3.张哲九平壤商业大学给养系,平壤 950003)
0 引言
大豆分离蛋白(Soybean protein isolate,SPI)是大豆油脂工业加工副产物,主要由7 S(β-伴大豆球蛋白)和11 S(大豆球蛋白)两种球形蛋白组成,因其基本氨基酸组成均衡,具有良好的营养特性和应用价值,被广泛应用于食品行业[1-2]。然而,未改性SPI由于其三级、四级结构比较复杂,具有紧密堆叠的致密球形构象,其功能特性在食品工业的应用往往受到许多限制,例如其凝胶性、乳化性、起泡性等[3]。大豆分离蛋白的凝胶性等功能特性可以通过改性得到改善,这对SPI在食品行业和非食品行业领域的应用具有一定的意义[4]。
近年来,超声和酶改性常被用于SPI的改性。超声作为物理改性手段,利用超声波的机械和空化作用破坏蛋白颗粒间的非共价作用,从而引起SPI结构状态改变,进而改善其理化性质和功能特性[5-6]。酶改性作为主要生物改性手段,利用蛋白酶在温和条件下的催化作用使SPI结构发生变化,暴露出蛋白分子内的疏水性基团,达成对蛋白质改性使其功能特性改善的目的。目前,大豆分离蛋白酶改性常用的蛋白酶有木瓜蛋白酶、胰蛋白酶、菠萝蛋白酶、胃蛋白酶、风味蛋白酶和谷氨酰胺转氨酶等,常被用于改善SPI的功能特性。其中,木瓜蛋白酶由于具有广泛的酶解位点(例如精氨酸、赖氨酸羧基端肽键等),且木瓜蛋白酶对SPI进行限制性酶解后可以暴露出更多的赖氨酸残基利于谷氨酰胺转氨酶后续的交联反应,而被用于改善SPI的凝胶特性[7-8]。文献[9]研究发现木瓜蛋白酶限制性水解使SPI凝胶强度和持水性分别提升了58.7%和6.4%左右。文献[10]研究发现,中等振幅较短时间的超声处理效果较好,可对SPI凝胶性产生有利影响。文献[11]研究发现,超声处理可以降低SPI粒径,提升SPI表面疏水性,促进TG交联SPI形成蛋白凝胶。目前,单一改性方式对SPI结构和TG交联SPI凝胶特性影响的研究报道很多,而超声联合酶改性对TG交联SPI凝胶特性影响的研究鲜见报道,并且单一的改性方式对蛋白功能特性的提升效果有限。
因此,本文以大豆分离蛋白为原料,运用超声联合酶改性手段处理SPI,探讨超声联合酶改性对SPI结构特性的改变,以及其对TG交联SPI凝胶特性的影响,通过粒度、游离巯基含量和表面疏水性分析,内源性荧光光谱和傅里叶红外变换光谱、质构以及扫描电镜测试等方法,研究超声联合酶改性后SPI结构特性和功能特性的变化。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(蛋白质量分数90.2%),河南川锦生物科技有限公司;木瓜蛋白酶(酶活力800 000 U/g)、无水四硼酸钠、邻苯二甲醛(OPA),上海源叶生物科技有限公司;谷氨酰胺转氨酶(酶活力100 U/g),北京索莱宝生物科技有限公司;十二烷基硫酸钠(SDS)、乙二胺四乙酸(EDTA)、5,5′-二硫代双(2-硝基苯甲酸)(DTNB)、甘氨酸、L-丝氨酸,北京博奥拓达科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
DJ1C-120W型增力电动搅拌器、S22-2型磁力搅拌器,金坛区西城新瑞仪器厂;HH-4恒温水浴锅,常州金坛良友仪器有限公司;F-4500型荧光分光光度计,日本Hitachi公司;AUY120型电子天平、UV-2600/2700型紫外-可见分光光度计,岛津仪器(中国)有限公司;Nano-ZS 90型粒度分析仪,英国马尔文仪器有限公司;Nicolet is50型傅里叶变换红外光谱仪,赛默飞世尔科技(中国)有限公司;TA-XT型质构仪,英国Stable Micro System公司;S-3400型扫描电子显微镜,日本Hitachi公司。
1.3 方法
1.3.1样品制备
(1)超声改性样品
根据文献[12]的方法稍作修改,将SPI分散于蒸馏水中(液料比10 mL/g),在室温(25℃)下搅拌2 h制备SPI分散液,维持分散液pH值为7.0。将SPI分散液在功率300 W下超声处理20 min(工作/间歇时间为5 s/1 s)。在超声处理过程中,将探头保持在SPI分散液表面以下1~2 cm处。将超声处理后的SPI分散液样品冷冻干燥,然后放入干燥器中保存直至分析测定。将超声改性样品记为USPI。
(2)木瓜蛋白酶改性样品
根据文献[9]的方法稍作修改,将SPI分散于蒸馏水中(液料比10 mL/g),在室温下搅拌2 h制备SPI分散液。将分散液在pH值7.0、50℃条件下进行改性处理,木瓜蛋白酶用量为25 U/g,在50℃恒温水浴锅中水解30 min,使其充分反应,在90℃下灭酶10 min。将酶解改性后的SPI分散液样品冻干,然后放入干燥器中保存直至分析测定。将木瓜蛋白酶酶解改性样品记为ESPI。
(3)超声联合酶改性样品
将SPI分散于蒸馏水中(液料比10 mL/g),室温下搅拌2 h制备SPI分散液。将分散液在功率300 W下超声处理20 min,然后在pH值7.0、50℃条件下进行改性处理,木瓜蛋白酶用量为25 U/g,在50℃恒温水浴锅中水解30 min,使其充分反应,最后在90℃下灭酶10 min,冻干并保存。将超声联合酶改性样品记为UESPI。
1.3.2水解度测定
根据文献[13]的方法稍作修改,采用OPA法测定蛋白质的水解度。其原理是OPA在1,4-二巯基苏糖醇(DTT)的存在下会与自由α-氨基形成黄色化合物,其在340 nm处有特征吸收,用紫外-可见分光光度计可检测其OD(光密度)值。
将600 μL样品水解液加入到装有4.5 mL OPA试剂的试管中(时间点设为0),混合均匀后静置2 min,读取340 nm处的吸光度。使用600 μL去离子水和丝氨酸标准溶液分别制备空白和标准品。样品水解度的计算公式为
(1)

(2)
(3)
式中htot——每克蛋白质的肽键总数,取7.8
α、β——大豆蛋白常量,取0.97、0.342
AS——样品吸光度
AB——空白吸光度
AC——标准品吸光度
V——样品体积,L
X——样品质量,g
P——样品中可溶性蛋白质的质量分数,%
1.3.3粒度测定
将样品分散于蒸馏水中,得到质量浓度为0.5 mg/mL的蛋白质溶液,颗粒折射率和分散剂折射率分别为1.460和1.330。采用马尔文纳米力度测定仪测定样品的粒度,每一个样品进行平行3次测量。
1.3.4傅里叶变换红外光谱
根据文献[14]的方法稍作修改,用Nicolet is50型傅里叶变换红外光谱仪在室温下记录了SPI的红外光谱。将样品与KBr粉末按质量比1∶100混合研磨,然后压片。然后利用傅里叶变换红外光谱仪进行全波段扫描(400~4 000 cm-1),分辨率为4 cm-1。采用Peakfit 4.12软件,高斯曲线拟合方法拟合α-螺旋、β-折叠、β-转角和无规则卷曲的特征峰,分析其相对含量[10]。
1.3.5内源荧光光谱
根据文献[15]的方法稍作修改,采用F-4500型荧光分光光度计测定大豆分离蛋白的荧光光谱。将样品分散于磷酸盐缓冲液(浓度为0.01 mol/L,pH值为7.0)中,配制成适合浓度的蛋白溶液,激发波长为290 nm,扫描发射光谱范围为300~500 nm,进行荧光光谱分析。
1.3.6游离巯基含量测定
根据文献[16]的方法稍作修改,分别取15 mg样品溶于5 mL的Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/L EDTA,pH值8.0)中,使用快速混匀器漩涡振荡溶解。然后向该蛋白溶液中加入50 μL Ellman试剂(4 mg DTNB溶于1 mL Tris-甘氨酸缓冲液),漩涡混匀后将悬浮液置于室温下避光保温1 h,然后在10 000g条件下离心15 min。取上清液测定游离巯基含量,以未加蛋白的混合液作空白对照,使用紫外可见分光光度计测定412 nm处的吸光度A412。游离巯基含量计算公式为
SH=[106/(1.36×104)A412D]/C
(4)
式中SH——游离巯基质量摩尔浓度,μmol/g
D——稀释系数
C——样品最终质量浓度,mg/mL
1.3.7表面疏水性测定
根据文献[17]的方法稍作修改,将不同SPI样品各0.01 g溶于10 mL磷酸盐缓冲液(pH值7.0、浓度0.01 mol/L)中,使样品质量浓度为1 mg/mL。然后用磷酸盐缓冲液将样品稀释到一系列质量浓度(0.062 5~1 mg/mL)。取不同质量浓度的稀释样品10 mL加入100 μL ANS(8-苯胺-1-萘磺酸,8 mmol/L),混匀,黑暗中静置30 min。采用荧光分光光度计在激发波长365 nm、发射波长485 nm处测定样品的荧光强度,以荧光强度对蛋白质质量浓度作曲线,曲线斜率即为蛋白质的表面疏水性指数。
1.3.8凝胶制备
根据文献[18]的方法稍作修改,进行凝胶样品的制备。将SPI样品分散于蒸馏水中(液料比10 mL/g),搅拌使其充分溶解,加入谷氨酰胺转氨酶(20 U/g),搅拌均匀。将其置于50℃下加热45 min,取出冷却至室温,将样品放置在4℃条件下静置12 h,制成凝胶。
1.3.9凝胶强度测定
根据文献[19]的方法稍作修改,将凝胶切成圆柱形(直径20 mm、高度10 mm),利用TA-XT型质构仪测定样品的凝胶强度。使用P/36R型探头,触发力0.029 4 N,下降高度10 mm,测前速度为5.0 mm/s,测试速度1.0 mm/s,测后速度5.0 mm/s。
1.3.10凝胶持水性测定
根据文献[20]的方法稍作修改,每个样品取一定量凝胶置于离心管中,记录凝胶质量为m,离心管和凝胶总质量为m1,并在4℃下以8 000g离心15 min,除去离心管内的水分,测离心管及凝胶质量m2。持水率计算公式为
(5)
1.3.11凝胶微观结构观察
根据文献[21]的方法稍作修改,将凝胶样品切成尺寸2 mm×5 mm的小条,用2.5%戊二醛(pH值 6.8)固定,4℃保存。先用0.1 mol/L、pH值 6.8的磷酸盐缓冲液冲洗2次,再用体积分数50%、70%、90%的乙醇溶液分别脱水一次,无水乙醇脱水3次,然后用无水乙醇与叔丁醇体积比为1∶1的混合液和纯叔丁醇各置换1次。冷冻干燥后进行离子渐射镀金,于扫描电子显微镜下观察。
1.3.12数据统计
所有实验重复3次取平均值,实验结果均采用平均值±标准差表示。利用SPSS 20软件进行数据处理和ANOVA差异显著性分析及相关分析,当P<0.05时差异性显著,使用 Origin 2019制图。
2 结果与讨论
2.1 粒度分析
蛋白质粒径是影响其功能特性的主要因素之一。不同方式处理后SPI粒径如图1(图中不同字母表示差异显著,下同)所示,与未经处理的SPI相比,经超声处理的SPI溶液平均粒径显著降低(P<0.05),这可能是由于超声处理产生的空化效应减弱蛋白分子之间的相互作用,降低蛋白分子之间的聚集。这与文献[22]研究超声改性对大豆分离蛋白凝胶冻融稳定性影响时得到超声改性使SPI粒径降低结果相似。经木瓜蛋白酶处理的SPI与未经处理的SPI相比,其平均粒径显著降低(P<0.05),其水解度约为0.1%。这是由于SPI经过木瓜蛋白酶的限制性水解作用,被部分切割成小分子片段,从而使SPI粒径降低。而与经超声处理的SPI相比,其平均粒径略有升高,这可能是由于SPI结构较为致密,酶解位点被一定程度包埋,减弱了木瓜蛋白酶对SPI的酶解作用[23]。经超声联合酶处理的SPI溶液平均粒径最低,其水解度约为0.5%,这可能是由于经超声预处理后,蛋白结构展开,酶解位点暴露,改善了木瓜蛋白酶对SPI的水解效果[5]。
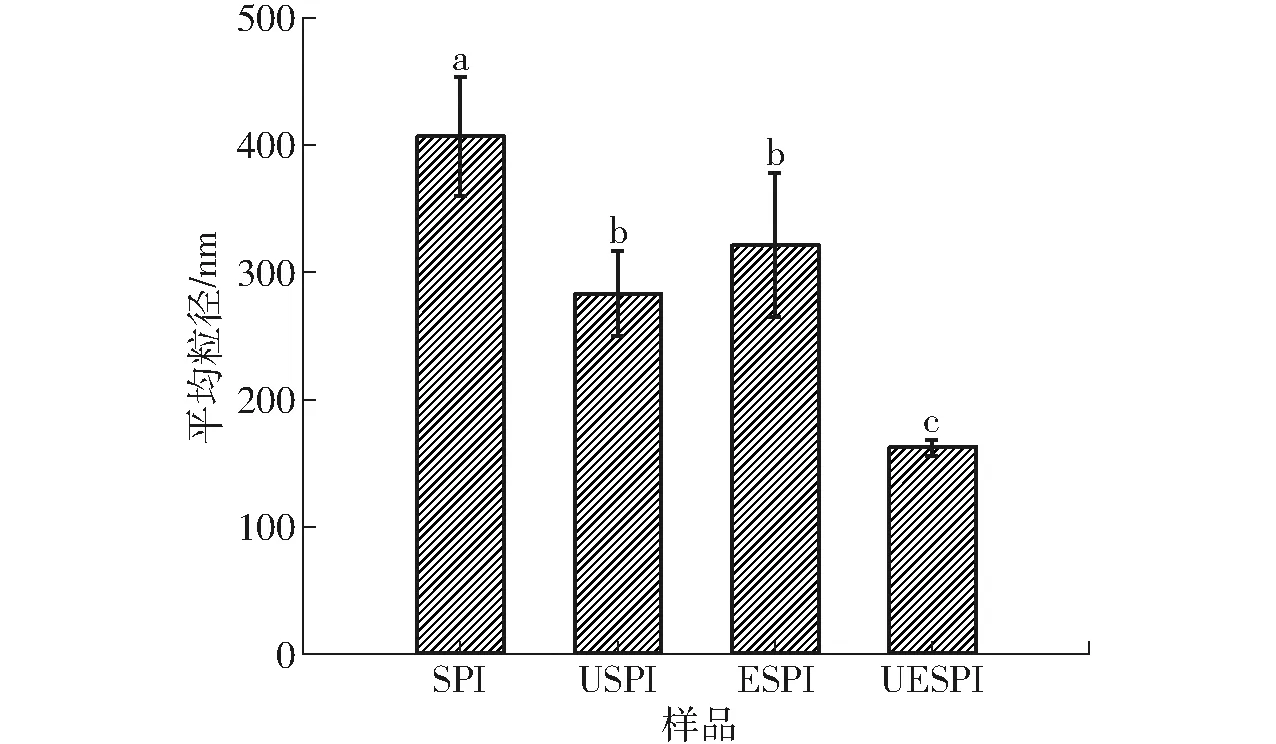
图1 超声与酶处理对SPI溶液粒径的影响Fig.1 Effect of ultrasound and enzyme treatments on the particle size of SPI solutions
2.2 傅里叶变换红外光谱分析
傅里叶变换红外光谱可以用来分析蛋白的二级结构,SPI二级结构相对含量如表1所示。去酰胺Ⅰ带光谱(1 600~1 700 cm-1)被用来分析蛋白的二级结构,吸收峰与其对应的二级结构如下:α-螺旋为1 650~1 660 cm-1;β-转角为1 660~1 670 cm-1和1 690~1 700 cm-1;β-折叠为1 610~1 640 cm-1和1 670~1 690 cm-1;无规则卷曲为1 640~1 650 cm-1[24]。由表1可知,与未经处理的SPI相比,经不同改性方式处理的SPI样品α-螺旋和β-转角相对含量均显著降低(P<0.05),β-折叠和无规则卷曲相对含量均显著上升(P<0.05),这表明不同处理方式均可以对SPI二级结构产生影响。其中,经超声联合酶处理的SPI二级结构变化最为明显,表明两种改性方式有协同作用。文献[25]研究木瓜蛋白酶限制性水解大豆分离蛋白时,SPI的α-螺旋和β-转角含量降低、β-折叠和无规则卷曲含量增加,与本研究结果一致。根据文献[26]的研究结果可知,SPI的二级结构主要由β-折叠结构来维持。β-折叠结构的增加改变了蛋白质间的相互作用,β-折叠结构在维持蛋白凝胶网络结构中起重要作用,这也为改性处理后SPI的凝胶性提高提供了理论基础[27]。

表1 超声与酶处理SPI的二级结构相对含量Tab.1 Secondary structure of SPI under ultrasound and enzyme treatments %
2.3 荧光光谱分析
当激发波长为290 nm时,SPI荧光发射光谱主要是由蛋白质内部色氨酸的荧光强度变化形成的,色氨酸的荧光强度变化是由蛋白质发生折叠或展开引起的。通常情况下,最大吸收波长红移表明荧光发射基团暴露在溶剂中,蛋白质分子展开;蓝移则表明大豆分离蛋白发生了聚集等变化[28]。本研究通过荧光光谱来表征大豆分离蛋白三级结构的变化,如图2所示,与未改性SPI相比,经超声改性的SPI荧光光谱没有发生红移或蓝移现象,最大吸收波长仍为334 nm,但是其荧光强度显著增加(P<0.05),这是因为超声促使蛋白分子结构展开,从而导致蛋白分子内部的发色基团暴露[29]。而经木瓜蛋白酶处理的SPI荧光光谱发生了红移现象,最大吸收波长从334 nm移至336 nm,且荧光强度显著增加(P<0.05),文献[30]研究发现,大豆分离蛋白经酶修饰后最大荧光值出现红移,且荧光强度显著升高,这与本研究的结果一致。超声联合酶处理的SPI荧光强度进一步增强,最大吸收波长红移至338 nm,进一步表明超声处理和木瓜蛋白酶处理之间的协同作用,使蛋白结构伸展,发色基团暴露,荧光强度增加[28]。

图2 超声与酶处理SPI的荧光光谱Fig.2 Fluorescence spectra of SPI under ultrasound and enzyme treatments
2.4 游离巯基含量
游离巯基位于SPI分子表面,其含量对SPI功能特性有很大影响,尤其在蛋白的凝胶性方面。游离巯基可能通过过氧化形成二硫键从而对凝胶的结构和机械性能有积极影响[18]。不同样品游离巯基含量的测定结果如图3所示,与未经处理的SPI相比,经不同方式处理的SPI游离巯基含量均显著升高(P<0.05)。超声处理的SPI游离巯基含量升高,主要是由于超声处理产生的空化效应使蛋白结构展开,使得包埋在蛋白内部的游离巯基暴露到分子表面[31-33]。木瓜蛋白酶处理的SPI游离巯基含量升高,可能是由于木瓜蛋白酶水解SPI引起的蛋白结构伸展和二硫键断裂导致[7]。相比于前3种样品,超声联合酶处理的SPI游离巯基含量显著升高(P<0.05),这可能是由于超声与木瓜蛋白酶之间的协同作用,使蛋白结构更加松散,二硫键断裂,内部的游离巯基暴露出来[28]。

图3 超声与酶处理SPI的游离巯基含量Fig.3 Free sulfhydryl content of SPI under ultrasound and enzyme treatments
2.5 表面疏水性分析
蛋白的表面疏水性可以体现极性环境中蛋白表面疏水基团的数量,是评估在极性条件下蛋白质构象和功能性质的重要指标,并且它与蛋白凝胶性密切相关[25]。由图4可知,与未改性SPI相比,经不同改性方式处理的SPI表面疏水性均显著升高(P<0.05)。经超声处理的SPI表面疏水性升高,这是由于超声作用使蛋白分子结构展开、疏水基团暴露,使蛋白表面疏水性增大[34]。经木瓜蛋白酶处理的SPI表面疏水性升高,这可能是由于木瓜蛋白酶处理使SPI结构展开,二硫键断裂,包埋在SPI内部的疏水基团暴露,从而表面疏水性升高[35]。这与文献[36]研究的木瓜蛋白酶酶解处理使SPI疏水基团暴露,表面疏水性升高的结果一致。超声联合酶处理的SPI与单一方式处理的SPI相比,表面疏水性的升高极为明显,这表明超声处理的机械力和空化作用与木瓜蛋白酶的水解作用相互协同,使SPI的致密结构得以展开,酶水解作用一定程度加强,疏水基团更多地暴露,增强了SPI的表面疏水性[23]。

图4 超声与酶处理SPI的表面疏水性Fig.4 Surface hydrophobicity of SPI under ultrasound and enzyme treatments
2.6 凝胶强度和持水性分析
凝胶强度和持水性是蛋白凝胶的重要特性,经超声联合酶处理的SPI凝胶强度和持水率显著升高(P<0.05),结果如图5所示,其凝胶微观结构如图6所示。谷氨酰胺转氨酶诱导的未改性SPI凝胶的凝胶强度和持水率分别为75.41 g和51.83%。谷氨酰胺转氨酶诱导的经超声处理的SPI凝胶强度和持水率分别为169.00 g和84.36%,相较于未经处理的SPI分别提升了(124.09±2.47)%和(62.80±2.46)%。这是由于超声处理产生的空化效应使SPI结构展开,粒径减小,活性基团暴露在分子表面,从而使SPI在谷氨酰胺转氨酶的交联作用下形成的凝胶结构孔洞变小,从而使凝胶强度和持水性升高[37-38]。谷氨酰胺转氨酶诱导的经木瓜蛋白酶处理的SPI凝胶强度和持水率分别为205.22 g和90.67%,相较于未经处理的SPI分别提升了(172.14±8.21)%和(74.96±1.66)%。研究显示,SPI经木瓜蛋白酶特异性酶解,暴露出赖氨酸残基,利于谷氨酰胺转氨酶的交联形成较为均匀的网络结构,从而使凝胶的强度和持水性升高[7]。谷氨酰胺转氨酶诱导的经超声联合酶处理的SPI凝胶强度和持水率分别为284.96 g和98.20%,相较于未经处理的SPI分别提升了(278.04±18.81)%和(89.51±2.78)%,与单一处理的SPI相比,其凝胶强度和持水率也显著增加(P<0.05)。这可能是由于超声处理使蛋白结构展开,粒径减小,更加利于木瓜蛋白酶的特异性酶解,暴露出更多的赖氨酸残基等活性基团,更加利于谷氨酰胺转氨酶的交联作用,形成均匀致密的凝胶结构,从而使凝胶的强度和持水性显著升高,这也进一步证明了超声与木瓜蛋白酶处理之间的协同作用[39-40]。
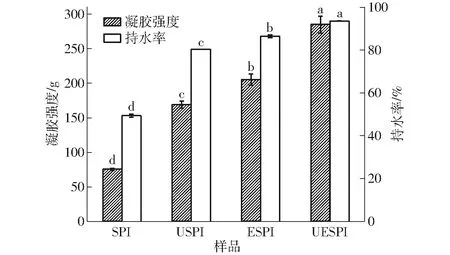
图5 超声与酶处理SPI的凝胶强度和持水率Fig.5 Strength and water holding capacity of SPI gel under ultrasound and enzyme treatments

图6 超声与酶处理SPI的凝胶微观结构Fig.6 Microstructures of SPI gel under ultrasound and enzyme treatments
2.7 微观结构
通过扫描电子显微镜[41]可以直观地观察不同样品经TG交联形成的三维网络凝胶结构。从图6可以看出,未经处理的SPI凝胶样品(图6a~6c)存在较大的孔洞,且相较于其它经过处理的凝胶样品,其结构松散、凝胶表面粗糙。经超声处理的SPI凝胶样品(图6d~6f),表面的孔洞明显减少、结构变得致密,但凝胶表面仍比较粗糙。说明超声处理降低了蛋白粒径,使蛋白结构展开、活性基团暴露于蛋白表面,促进TG交联形成更加致密的凝胶结构[38]。经木瓜蛋白酶处理的SPI凝胶样品(图6g~6i),表面紧密均匀、孔隙减少,粗糙程度也有所降低。这是由于木瓜蛋白酶的限制性酶水解破坏了SPI的二硫键,蛋白结构伸展,暴露出一定的赖氨酸残基,有利于TG交联成更加均匀致密的凝胶网络[9]。经超声联合酶处理的SPI凝胶样品(图6j~6l),表面光滑平整、均匀致密,孔隙小。这是由于超声处理降低蛋白分子之间的相互作用,使蛋白结构展开,有利于木瓜蛋白酶的特异性酶解,暴露出更多的赖氨酸残基等活性基团,更加利于谷氨酰胺转氨酶的交联作用,形成表面光滑、均匀致密的凝胶结构[7]。
3 结束语
以大豆分离蛋白为原料,探究超声联合酶处理对SPI结构以及对TG交联的SPI凝胶性能的影响,主要得出以下结论:不同处理方式均可以提高SPI荧光强度,其中超声联合酶处理效果最佳,两种方式的协同作用使蛋白结构伸展,发色基团暴露,荧光强度增加。同时,超声联合酶处理也显著降低了SPI的α-螺旋和β-转角相对含量,并提高了β-折叠和无规则卷曲相对含量。超声处理产生的机械力及空化效应,使蛋白结构展开,协同木瓜蛋白酶处理破坏SPI二硫键,暴露出更多的疏水基团和游离巯基,提升了SPI表面疏水性和游离巯基含量,比单一处理的提升效果更明显。超声联合酶处理可以显著提高TG交联的SPI凝胶强度和持水性能,超声处理使蛋白结构展开,利于木瓜蛋白酶的特异性酶解,暴露出更多的赖氨酸残基等活性基团,有利于谷氨酰胺转氨酶的交联作用,形成均匀致密的凝胶结构。

