基于高通量测序技术分析奶牛乳房炎关联微生物群落结构及多样性
刘肖利,程 彪,刘璐瑶,李勤凡,佟盼盼,张 毅,刘英玉,苏战强,李 斌
(1. 新疆农业大学动物医学学院,乌鲁木齐 830052;2. 西北农林科技大学动物医学院,陕西杨凌 712100)
0 引 言
【研究意义】对CJ和HZS 2个奶牛场的奶牛进行乳房炎的检查,最终将2个奶牛场中患有临床型乳房炎的奶牛乳汁随机采样各3份,非临床型奶牛乳汁随机采样各1份,通过对临床型乳房炎奶牛和非临床型奶牛乳样中细菌的16S rRNA基因V3-V4区的PCR扩增和高通量测序,分析临床型奶牛乳汁样本和非临床型奶牛乳汁样本中微生物群落结构分布的多样性差异。【前人研究进展】奶牛乳房炎是危害奶牛业生产的重要疾病之一[1-4]。引起奶牛乳房炎的病因十分复杂,引起其发病的病原体大约有150多种,包括细菌、真菌、支原体,还包括病毒等[5-7]。其中常导致奶牛乳房炎发病的病原体以细菌最为多见,种类多达20余种,而金黄色葡萄球菌、链球菌及大肠杆菌等约占90%以上[8-10]。奶牛生活的环境中存在的微生物同样值得重视,包括大肠杆菌、乳房链球菌、肺炎克雷伯菌、绿脓杆菌等[11-13]。【本研究切入点】由于传统微生物鉴定方法的局限性,在临床乳房炎病例中通过常规培养不能被检测到的细菌约占25%[14],而许多临床乳房炎动物采集的细菌培养阴性乳样品中也可能存在细菌种类[15]。在乳房炎样本中含量相对较少和难以培养的细菌通过常规方法极少被检测到,不能全面反映样本中菌群分布,借助分子生物学技术对牛奶样本中的菌群进行多样性分析很有必要。【拟解决的关键问题】采集临床型和非临床型奶牛乳汁样本,通过Illumina NovaSeq高通量测序技术研究样本中的菌群多样性,分析奶牛乳房炎菌群组成,为奶牛乳房炎的防控提供更全面的理论依据。
1 材料与方法
1.1 材 料
NanoDrop ND-1000分光光度计,美国Thermo公司;高速冷冻离心机,德国赛多利斯公司;PCR仪,美国Thermo公司。
从新疆伊犁某2个奶牛场(HZS,CJ)采集奶牛样品8份,其中HZS场采样4份,3份为临床乳房炎样本,1份为非临床型牛乳样本。
1.2 方 法
1.2.1 样品处理
临床乳房炎样品编号为HZS.LC1、HZS.LC2、HZS.LC3,非临床型牛乳样本编号为HZS.ZC;CJ场采样4份,3份为临床乳房炎样本,1份为非临床型牛乳样本,临床乳房炎样本编号为CJ.LC1、CJ.LC2、CJ.LC3,非临床型牛乳样本编号为CJ.ZC。先用温水彻底清洗患病奶牛的采样乳头,再用75%的酒精棉对乳头进行消毒,最后使用消毒纸巾擦干;弃去采样乳区的前3把乳汁,无菌采集第3把以后的乳样约50 mL,置于无菌管中,并将样品做好标记,放入附有冰袋的采集箱中送实验室检测。
1.2.2 16S rRNA基因V3-V4区的PCR扩增
使用基因组DNA提取试剂盒提取细菌总基因组DNA,并使用NanoDrop ND-1000分光光度计和1.2%琼脂糖凝胶电泳检测DNA的质量,调整DNA溶液浓度后,使用通用引物338F-806R(338F:5'-ACTCCTACGGGAGGCAGCA-3',806R:5'-GGACTACHVGGGTWTCTAAT-3')进行细菌16S rRNA基因V3-V4区的PCR扩增[16]。反应程序:98℃ 2 min,98℃ 15 s,55℃ 30 s,72℃ 30 s,共25个循环;72℃ 5 min。回收扩增产物,然后使用Quant-iT PicoGreen dsDNA Assay Kit分析试剂盒进行定量,委托上海派森诺生物技术有限公司的Illlumina NovaSeq6000测序平台进行测序。
1.2.3 生物信息学
使用Qiime(1.9.1)软件对测序获得的原始数据进行拼接、过滤、去嵌合体序列,最终得到有效序列,调用UCLUST,将有效序列按97%的序列相似度进行归并和操作分类单元(OTU)划分,选取丰度较高的OTU作为代表序列,采用Greengenes数据库(Release 13.8)对OTU进行物种注释,并统计样本在各层次的物种丰度。使用ɑ多样性指数(Chao1、Observed species、Shannon、Simpson)来评估不同样本中菌群的物种丰富度和多样性的差异性,对OTUs进行稀疏曲线分析,使用Qiime软件分别计算各样本的Shannon、Chao1、覆盖度( coverage)等参数,同时使用R语言根据Bray-Curtis距离算法得到Beta多样性距离矩阵,利用非加权平均法(UPGMA)对样本中丰度靠前的属进行聚类分析并绘制热图。
2 结果与分析
2.1 样品测序
研究表明,共得到2 229 421条有效序列,测得样本的序列长度分布在400~450 bp,平均长度在430 bp左右。乳房炎样本菌群丰富度及多样性总体比非临床型样本高。所有样本的曲线都逐渐趋于平坦,测序量足以覆盖大部分微生物类群,增加测序量可能只会产生少量的新物种,测序数据量合理。表1,图1
2.2 在门分类水平上的细菌组成
研究表明,在临床型乳房炎样本中,优势菌群分别是变形菌门(Proteobacteria)、无壁菌门(Tenericutes)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)。在CJ场中,样本中丰度最高的菌群是无壁菌门(Tenericutes)、变形菌门(Proteobacteria);在HZS场中,样本丰度最高的菌群是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes);CJ场与HZS场相比,无壁菌门(Tenericutes)仅在样本CJ.LC1、CJ.LC2中被检测到,且菌群丰度高达57%以上,而在HZS场中,样本HZS.LC3中,厚壁菌门(Firmicutes)的菌群丰度均高于其他5个乳房炎样本,达96%左右;样本CJ.LC3、HZS.LC1、HZS.LC2中,均含有4个菌群,分别是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria),但细菌类群在各样本间的比例有所差异。在非临床样本中,优势菌群是变形菌门(Proteobacteria),且该细菌类群在2个非临床型样本中的丰度高达92%以上,其次是厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes),菌群丰度均大于1%;临床型乳房炎样本与非临床型样本相比,变形菌门(Proteobacteria)丰度均低于非临床型样本,其他菌群门和丰度均高于非临床样本。图2
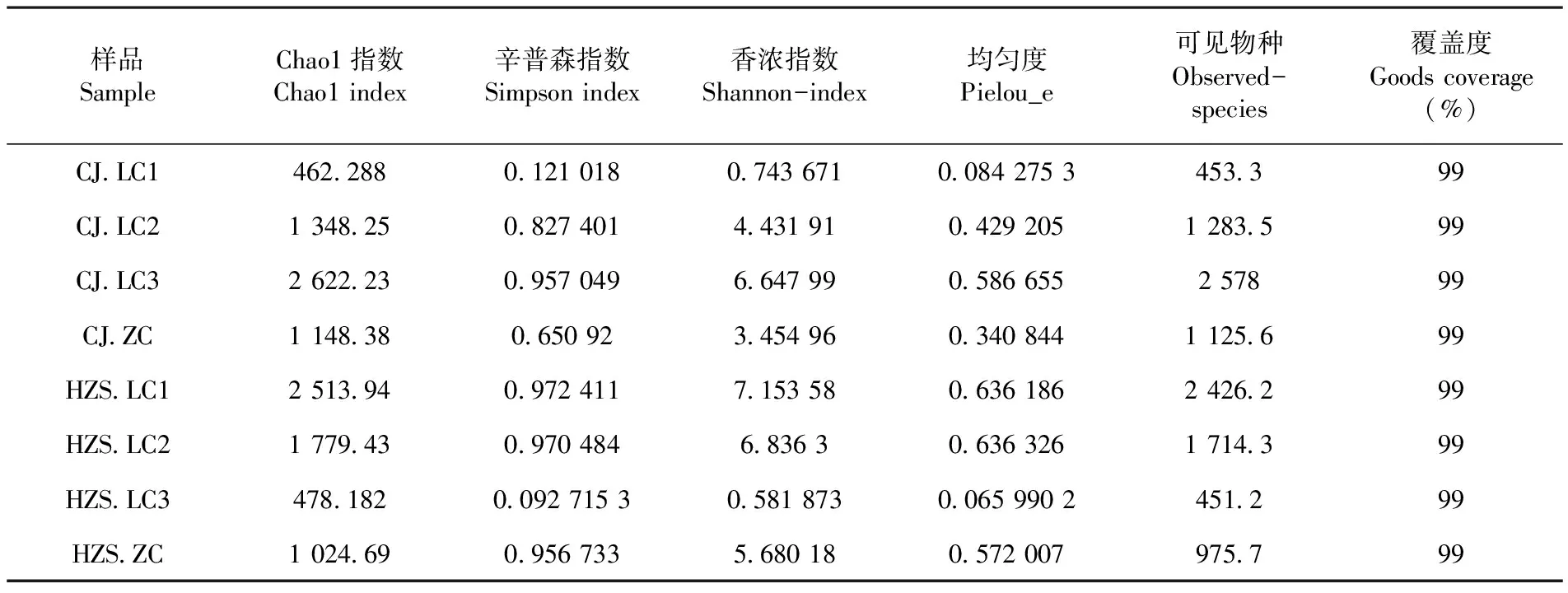
表1 样本菌群Alpha多样性指数Table 1 Microflora Alpha Diversity Index of Sample

图1 相似度为97%条件下各样本的稀释曲线Fig.1 Rarefaction curves of each sample at cutoff level of 3%
2.3 在科分类水平的组成
研究表明,在临床型乳房炎样本中,优势菌群分别是莫拉氏菌科(Moraxellaceae)、支原体(Mycoplasmataceae)、链球菌科(Streptococcaceae),主要群落分别是布鲁氏菌科(Brucellaceae)、莫拉氏菌科(Moraxellaceae)、丛毛单胞菌科(Comamonadaceae)、假单胞菌科(Pseudomonadaceae)、草酸杆菌科(Oxalobacteraceae)、柄杆菌科(Caulobacteraceae)、噬几丁质菌科(Chitinophagaceae)、肠杆菌科(Enterobacteriaceae)等;在CJ场中,丰度最高的菌群莫拉氏菌科(Moraxellaceae)、支原体(Mycoplasmataceae),在HZS场中,丰度最高的菌群是莫拉氏菌科(Moraxellaceae)、链球菌科(Streptococcaceae);在CJ场中,样本CJ.LC1、CJ.LC2丰度最高的菌群是支原体(Mycoplasmataceae),分别占细菌总数的94%和57%,在样本CJ.LC3中,丰度最高的菌群是莫拉氏菌科(Moraxellaceae),占细菌总数的55%,样本CJ.LC1、CJ.LC2与样本CJ.LC3相比,莫拉氏菌科(Moraxellaceae)的菌群丰度相对较低,分别占细菌总数的2%、13%;在HZS场中,样本HZS.LC1、HZS.LC2中丰度最高的菌群是莫拉氏菌科(Moraxellaceae),分别占细菌总数的51%、46%,在样本HZS.LC3中,菌群丰度最高的菌群是链球菌科(Streptococcaceae),
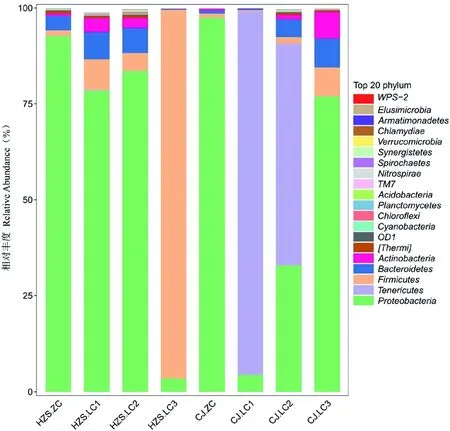
注:HZS.ZC:HZS奶牛场非临床型乳汁样本;HZS.LC1:HZS奶牛场临床型乳房炎乳汁样本;HZS.LC2:HZS奶牛场临床型乳房炎乳汁样本;HZS.LC3:HZS奶牛场临床型乳房炎乳汁样本;CJ.ZC:CJ奶牛场非临床型乳汁样本;CJ.LC1:CJ奶牛场临床型乳房炎乳汁样本;CJ.LC2:CJ奶牛场临床型乳房炎乳汁样本;CJ.LC3:CJ奶牛场临床型乳房炎乳汁样本,下同
占细菌总数的96%,莫拉氏菌科(Moraxellaceae)占细菌总数的1%,与样本HZS.LC1、HZS.LC2相比,莫拉氏菌科(Moraxellaceae)的菌群丰度相对较低,CJ场与HZS场相比,支原体(Mycoplasmataceae)仅在样本CJ.LC1、CJ.LC2中被检测到,链球菌科(Streptococcaceae)仅在样本HZS.LC3中被检测到,而莫拉氏菌科(Moraxellaceae)、Brucellaceae(布鲁氏菌科)、噬几丁质菌科(Chitinophagaceae)、丛毛单胞菌科(Comamonadaceae)、草酸杆菌科(Oxalobacteraceae)、假单胞菌科(Pseudomonadaceae)、柄杆菌科(Caulobacteraceae)在样本CJ.LC2、样本CJ.LC3、样本HZS.LC1、HZS.LC2中均被检测到。在非临床型样本中,优势菌群是莫拉氏菌科(Moraxellaceae),且该细菌类群在2个非临床型样本中的丰度高达50%以上,主要群落分别是假单胞菌科(Pseudomonadaceae)、肠杆菌科(Enterobacteriaceae)、丛毛单胞菌科(Comamonadaceae)、草酸杆菌科(Oxalobacteraceae)等。乳房炎样本之间菌群结构分布基本一致,且临床型和非临床型奶牛乳汁中菌群结构分布和丰度变化有所差异。图3
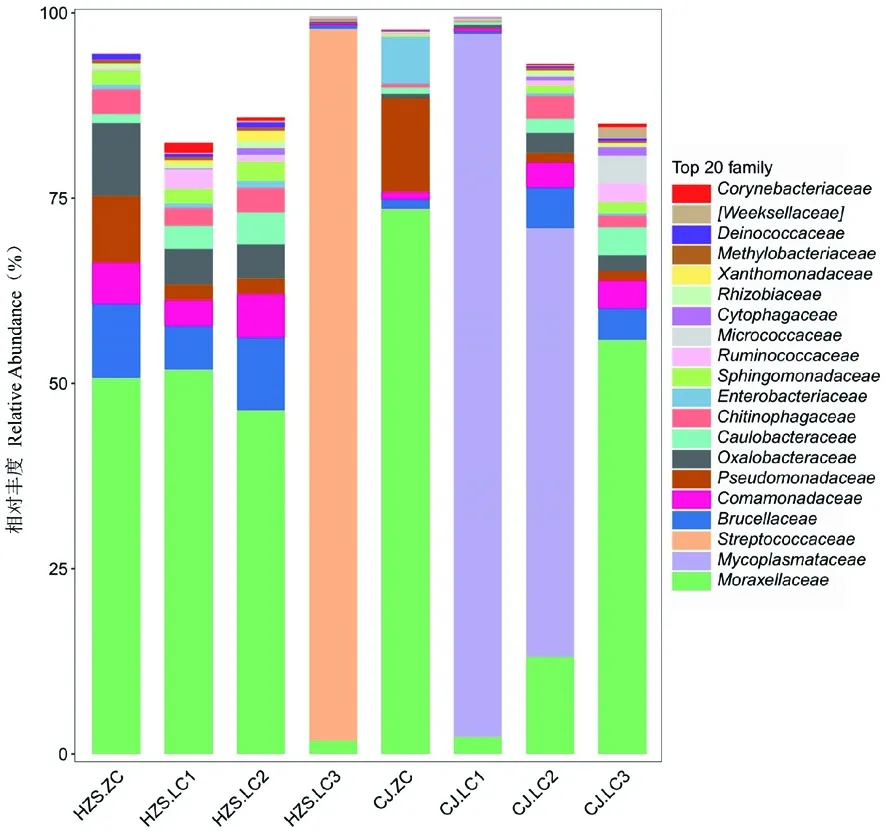
图3 细菌科分类水平的比较Fig.3 Comparison of bacteria groups at family level
2.4 在属分类水平的组成
研究表明,在临床乳房炎样本中,优势菌群分别是不动杆菌属(Acinetobacter)、支原体(Mycoplasmataceae)、链球菌属(Streptococcus)、主要菌群分别是棒杆菌属(Corynebacterium) 、嗜冷杆菌属(Psychrobacter)、苍白杆菌属(Ochrobactrum)、贪铜菌属(Cupriavidus)、沉积物杆状菌属(Sediminibacterium)、嗜糖假单胞菌属(Pelomonas)、罗斯氏菌属(Rothia)等;在CJ场中,样本CJ.LC1、CJ.LC2中丰度最高的菌群是支原体(Mycoplasmataceae),分别占细菌总数的94%和57%,在样本CJ.LC3中,丰度最高的菌群是不动杆菌属(Acinetobacter),占细菌总数的53%,而样本CJ.LC1、CJ.LC2中不动杆菌属(Acinetobacter)的菌群比例相对较小,分别占细菌总数的2%、12%,在HZS场中,样本HZS.LC1、HZS.LC2中丰度最高的菌群是不动杆菌属(Acinetobacter),分别占细菌总数的49%、43%,在样本HZS.LC3中丰度最高的菌群是链球菌属(Streptococcus),占细菌总数的95%,而不动杆菌属(Acinetobacter)仅占细菌总数的1%。CJ场与HZS场相比,仅在CJ场在2个乳房炎样本中检测到支原体,而在HZS场在1个乳房炎样本中检测到链球菌属。样本CJ.LC3、HZS.LC1、HZS.LC2中的菌群结构分布基本一致;在非临床型样本中,优势菌群是不动杆菌属(Acinetobacter),主要菌群分别是苍白杆菌属(Ochrobactrum)、贪铜菌属(Cupriavidus)、沉积物杆状菌属(Sediminibacterium)、嗜糖假单胞菌属(Pelomonas)、鞘氨醇单胞菌属(Sphingomonas)、克雷伯氏菌属(Klebsiella);在CJ场和HZS场中,不动杆菌属(Acinetobacter)在2个非临床型样本的菌群丰度高达50%,其他菌群丰度均在1%以上。奶牛患乳房炎后菌群结构变化最大的属是支原体和链球菌属。图4
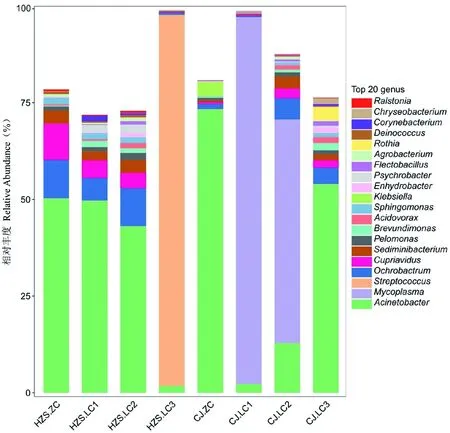
图4 细菌属分类水平的比较Fig.4 Comparison of bacteria groups at genus level
2.5 聚类分析
研究表明,乳房炎样本之间相似度较高,非临床型样本之间虽未聚在一起,但二者细菌群落相似性也较高,说明菌群在不同组内平行样本之间存在个体差异性。取丰度在前20属,绘制热图,在临床乳房炎样本中链球菌和支原体较其他病原微生物而言丰度明显较高,不同样本中均有相对丰度较高的属,临床乳房炎样本与非临床型样本相比,属水平丰度较高菌群较多。图5,图6
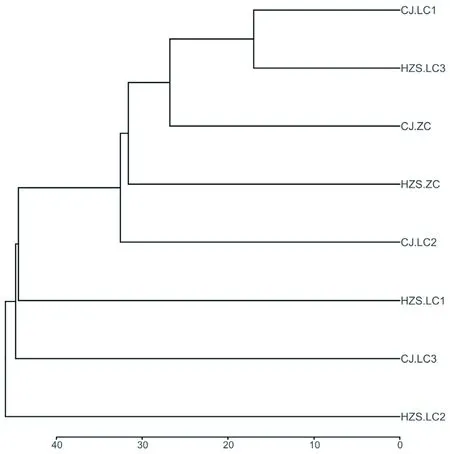
图5 样本层级聚类树Fig.5 Hierarchical clustering tree
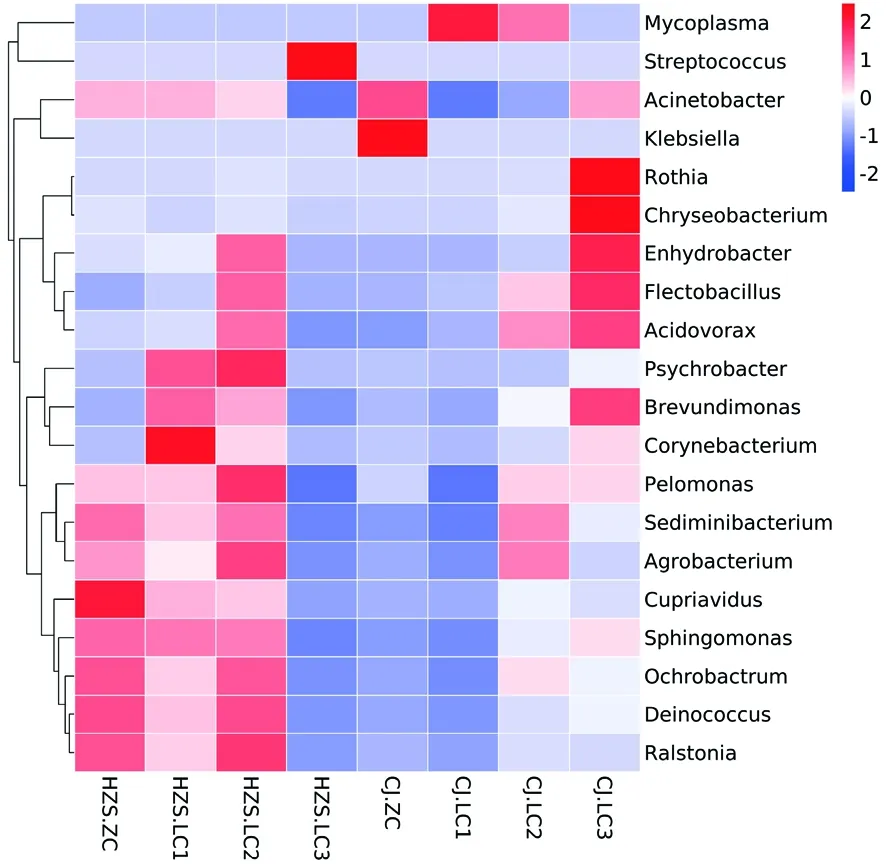
注:红色色块代表该属在该样本中的丰度较其他样本高,蓝色色块代表该属在该样本中的丰度较其他样本低
3 讨 论
研究首次利用高通量测序技术对奶牛乳房炎乳汁样本进行研究,通过16S rRNA基因的V3-V4区测序分析,检测乳房炎样本中微生物群落结构多样性。6个乳房炎样本共获得25个门,47个纲,82个目,174个科,349个属;2个非临床型奶牛乳汁样本共获得23个门,38个纲,61个目,125个科,212个属。研究表明,临床型奶牛乳汁中菌群多样性与丰富度均高于非临床型奶牛,表明患乳房炎的奶牛乳汁中菌群结构更为复杂。
不同奶牛场采集的乳房炎样本菌群分布有所差异。研究在乳房炎样本中检测到的主要菌门分别是无壁菌门(Tenericutes)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)。Catozzi等[17]的研究表明,乳房炎样本中菌群主要有厚壁菌门( Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria),与研究结果一致。Falentin等[18]的研究表明,乳房炎样本中主要主要菌群分别是厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria),与研究结果相比,主要菌群基本一致,但无壁菌门(Tenericutes)在研究中为主要菌群。说明乳房炎样本之间菌群分布基本一致,但由于区域、动物种类不同等可能造成微观的菌群比例差异。
变形菌门(Proteobacteria)的多数细菌均能引起各种传染性临床综合征(如肺炎、泌尿道感染等)[19,20]。研究表明,乳房炎样本和非临床型样本中变形菌门(Proteobacteria)的相对丰度均较高,但是变形菌门是否和发生乳房炎有密切的关系,需要进一步研究。到目前为止,尚无大量由不动杆菌引起牛乳房炎的相关报道[21],莫拉氏菌科( Moraxellaceae) 中的不动杆菌属(Acinetobacter)中有50多个物种[22],但大多数是非致病性环境生物[23]。铜绿假单胞菌是奶牛乳腺炎的一个众所周知的病因,通常可以通过传统的培养方法分离鉴定,由铜绿假单胞菌引起的乳腺炎,经常与奶牛舍的水和奶头消毒剂的污染有关[24]。假单胞菌科( Pseudomonadaceae ) 中的假单胞菌( Pseudomonas)是机会致病菌,可以适应多种环境条件,与肺部炎症密切相关[25,26]。肠杆菌科中常见的属是机会性环境病原体,由这类细菌所引起的乳房炎,可能是受污染的粪便以及牛舍内潮湿的环境所引起[27]。肠道微生物不仅在维持宿主营养、防御和免疫发育中起关键作用[28];并且有报道揭示肠道微生物与牛奶微生物之间在发生牛乳房炎时,二者微生物存在紧密的联系,当肠道微生物迁移到乳腺后,可通过损害宿主细胞导致临床或慢性乳腺炎[29, 30]。
临床型乳房炎样本和非临床型样本之间主要OTU存在较大差异。与非临床型样本相比,无壁菌门(Tenericutes)仅在临床型乳房炎样本中检测到,厚壁菌门(Firmicutes)的相对丰度变化较大,此次发生乳房炎的主要病因可能与无壁菌门(Tenericutes)、厚壁菌门(Firmicutes)有较大的关系。研究发现,在HZS场中,有1个临床样本中丰度最高菌群的是链球菌,在CJ场中,有2个样本中丰度最高菌群的是支原体。HZS场发生乳房炎的病因可能是由链球菌引起,CJ场发生乳房炎的病因可能是由支原体引起。
4 结 论
临床型奶牛乳汁中菌群丰度明显升高,多样性变化显著。非临床型乳汁样本中丰度较高的菌群依次是变形菌门、拟杆菌门、厚壁菌门。奶牛患乳房炎后菌群结构比例变化显著的门是厚壁菌门,研究发现,仅在乳房炎样本中检测到菌群结构比例变化显著的门是无壁菌门(高达57%),变化显著的是支原体(高达57%)和链球菌(高达95%)。奶牛患乳房炎后会引起奶牛乳汁菌群失调,乳汁菌群结构分布和丰度变化与乳房炎的发生具有密切的联系。

