侧柏叶黄酮的大孔树脂纯化工艺研究
肖 凡
(同方药业集团有限公司,北京 102100)
侧柏叶是柏科植物侧柏Platycladus orientalis(L.)的干燥嫩枝和叶,具有凉血止血,化痰止咳的功效,富含多种活性成分,其中黄酮化合物含量较为丰富,是其主要功能成分之一[1]。现代药理学研究显示,该黄酮化合物具有抗菌、抗氧化、抗运动疲劳和提高机体免疫力等效果,因此,相关研究多集中对其提取工艺的研究和药理作用的探讨[2],但无论采取溶剂或超声波辅助提取,其产物中杂质仍较多,而目前鲜有涉及侧柏叶黄酮的纯化研究报道。由于大孔树脂吸附分离具有选择性高、干扰因素少、且能重复循环利用等优点,被广泛用于天然产物的纯化[3],因此,本研究利用大孔树脂纯化侧柏叶黄酮粗提物,通过静态和动态吸附-解吸试验,讨论不同工艺条件对侧柏叶黄酮的吸附与解吸性能影响,从而为侧柏叶黄酮的富集利用提供参考。
1 实验部分
1.1 材料与仪器
侧柏叶,经鉴定为柏科植物侧柏的干燥叶片,购于南京益丰大药房;芦丁标准品(92.4%中国食品药品检定研究院);AB-8、H103型大孔树脂(天津欧瑞生物科技有限公司);HPD 400型大孔树脂(天津浩聚科技有限公司);DM 301、HPD 600型大孔树脂(北京索莱宝科技有限公司);其他试剂均为分析纯,国药集团化学试剂有限公司。
玻璃层析柱(Ф16mm×50mm,新辉层析设备有限公司);5800H型紫外-可见分光光度计(上海元析仪器有限公司);FA1004型电子天平(绍兴市景迈仪器设备有限公司);RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂);TG18G-II型台式高速离心机(盐城凯特实验仪器有限公司);SHA-C型恒温振荡器(常州国华仪器制造有限公司)。
1.2 方法
1.2.1 侧柏叶黄酮提取 侧柏叶经60℃烘箱干燥4h后粉碎,过60目筛,称取一定重量的侧柏叶干粉,在料液比1∶20(m∶V)下,加入50%乙醇溶液,于60℃、100W超声波功率下提取51min后过滤,对所得滤渣重复上述提取步骤,浓缩后减压干燥即得[4]。
1.2.2 总黄酮含量测定 依照文献所述方法,配制不同浓度的芦丁标准液,于510nm波长下测定吸光度[5],绘制标准曲线:y=11.16x-0.011(r=0.9994),表明在0.01~0.10mg·mL-1范围内线性关系良好。不同样品溶液经稀释后于相同波长测定吸光度,根据下式计算样品的黄酮含量(以芦丁含量计)。
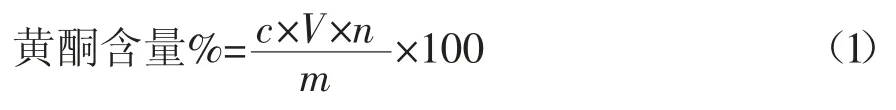
式中 c:样品中芦丁浓度,mg·mL-1;V:样品溶液体积,mL;n:稀释倍数;m:样品质量,mg。
1.2.3 静态吸附-解吸试验 分别准确称取不同溶液预处理后的5种型号树脂2.0g置于锥形瓶后,加入3mg·mL-1黄酮提取液30mL,于室温下振荡吸附12h使其充分吸附后过滤,测得滤液中黄酮浓度;另用纯水洗去树脂表面未吸附的杂质与溶液后,置于锥形瓶中加入体积分数70%的乙醇溶液100mL,于室温下振荡12h,使其充分解吸后,过滤,测得洗脱液中黄酮浓度[6],根据下式分别计算5种型号大孔树脂对侧柏叶黄酮的吸附率、解吸率与回收率。
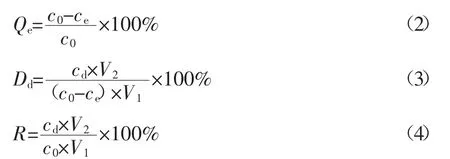
式中 c0:样品溶液中黄酮浓度,mg·mL-1;ce:饱和吸附后滤液中黄酮浓度,mg·mL-1;cd:洗脱液中黄酮浓度,mg·mL-1;V1:样品溶液体积,mL;V2:洗脱液体积,mL;Qe:吸附率,%;Dd:洗脱率,%;R:回收率,%。
1.2.4 动态吸附-洗脱条件考察
上样浓度选择 将5.0g AB-8树脂湿法装柱后,以体积分数50%乙醇溶液为溶剂,分别配制1、2、3、4、5mg·mL-1上样溶液60mL,以2.0mL·min-1流速上样后,测得流出液中黄酮浓度,考察不同上样浓度对侧柏叶黄酮吸附率的影响。
上样液pH值选择 相同浓度上样溶液分别调节pH值为4、5、6、7、8后于2.0mL·min-1流速上样至湿法填充树脂的层析柱内,测得流出液中黄酮浓度,考察不同上样浓度对侧柏叶黄酮吸附率的影响。
上样流速选择 相同浓度上样溶液分别以1.0、2.0、3.0mL·min-1流速上样至湿法填充树脂的层析柱内,测得流出液中黄酮浓度,考察不同上样浓度对侧柏叶黄酮吸附率的影响。
洗脱液体积分数选择 采用上述最佳条件上样后,用纯水冲洗至流出液中基本无黄酮化合物,分别采用50%、60%、70%、80%、90%乙醇溶液,以1.0mL·min-1流速洗脱,测得不同收集管内洗脱液中黄酮浓度,考察洗脱液的不同体积分数对侧柏叶黄酮洗脱率的影响。
洗脱流速选择 采用上述最佳条件上样后,用纯水冲洗至流出液中无黄酮化合物,以70%乙醇溶液分别于1.0、2.0、3.0mL·min-1流速洗脱,测得不同收集管内洗脱液中黄酮浓度,考察洗脱液的不同流速对侧柏叶黄酮洗脱率的影响。
泄漏曲线与洗脱曲线绘制 3mg·mL-1不同体积的上样溶液以2.0mL·min-1流速上样至湿法填充树脂的层析柱内,测得流出液中黄酮浓度后,绘制吸附曲线,同时吸附饱和后,以70%乙醇溶液于1.0mL·min-1流速洗脱,测得不同体积流出液中黄酮浓度后,绘制洗脱曲线。
1.3 数据处理
所有结果均以3次平行试验结果的均值与标准差表示,并采用OriginPro 8.5软件作图分析。
2 结果与讨论
2.1 静态吸附-解吸试验结果
不同型号树脂在静态吸附-解吸试验的结果,见表1。
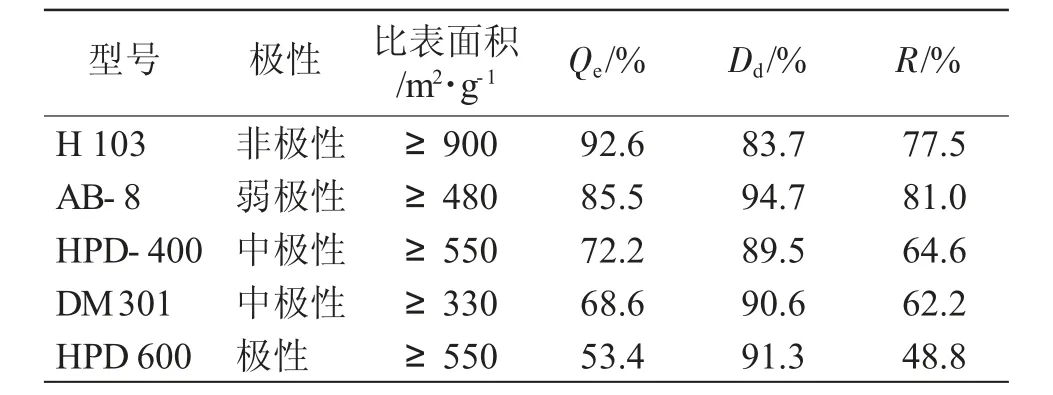
表1 不同型号树脂对侧柏叶黄酮的静态吸附-解吸效果Tab.1 Static adsorption and desorption capacity of different type resins for flavonoid from Platycladus orientalis leaves
由表1可见,不同型号树脂对侧柏叶黄酮的吸附率依次为H 103>AB-8>HPD-400>DM 301>HPD 600,这归因于H 103树脂的比表面积较大,可提供较多的吸附位点,而洗脱率依次为AB-8>HPD 600>DM 301>HPD-400>H 103,这源于侧柏叶黄酮类化合物的极性较弱,因此,与具有一定极性树脂的范德华力和氢键作用较低[7],AB-8树脂的比表面积适中,且对黄酮类化合物的回收率较高,从而选择AB-8树脂纯化侧柏叶黄酮化合物。
2.2 上样浓度对吸附率的影响
图1为黄酮粗提液浓度对AB-8树脂吸附效果的影响。
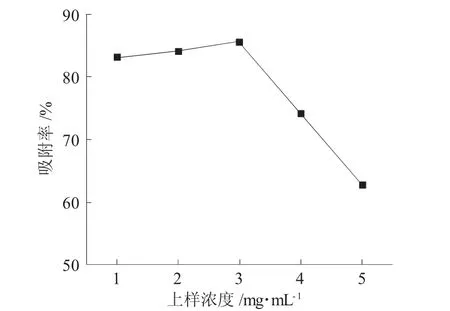
图1 黄酮粗提液浓度对AB-8树脂吸附效果的影响Fig.1 Effect of flavonoid crude concentration on adsorption efficiency of AB-8 resin
由图1可见,随着上样浓度增大至3mg·mL-1后,树脂的吸附率开始下降,这归因于当上样浓度较低时,树脂的吸附位点较多,因此,随着上样浓度的增大,树脂的吸附量适当增大,但当上样浓度大于3mg·mL-1时,表明树脂吸附基团饱和,这不仅造成侧柏叶黄酮的泄漏,同时增大样品中杂质堵塞树脂的风险[8],因此,选择3mg·mL-1黄酮粗提液作为上样液溶液浓度较宜。
2.3 上样液pH值对吸附率的影响
图2为上样液pH值对AB-8树脂吸附效果的影响。
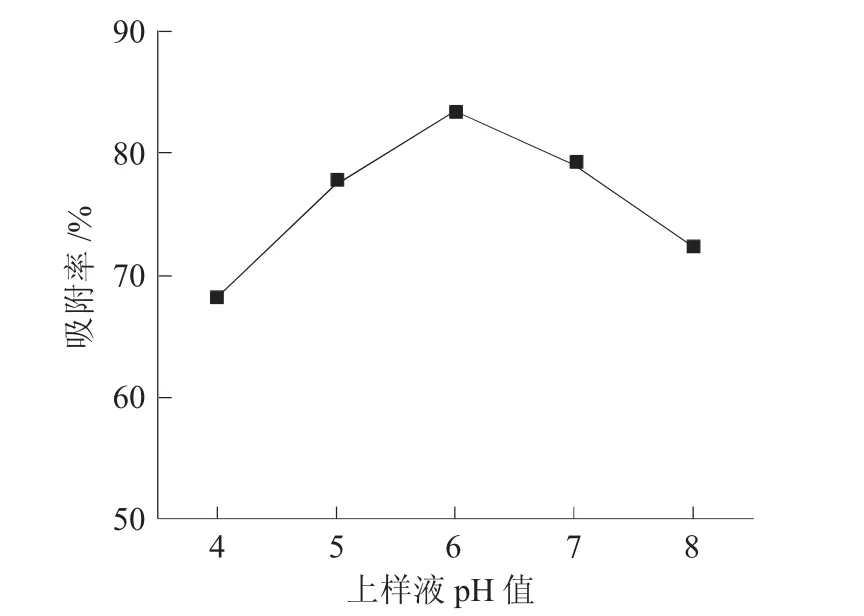
图2 上样液pH值对AB-8树脂吸附效果的影响Fig.2 Effect of pH value of loading sample solution on adsorption efficiency of AB-8 resin
由图2可见,当上样液pH值低于6时,AB-8树脂对黄酮化合物的吸附率呈升高趋势,随后逐渐下降。由于黄酮化合物的化学结构中存在多羟基酚和糖苷键结构呈弱酸性,溶液pH值过低或过高时,黄酮化合物易以离子形式存在,均不利于与树脂发生相互作用[9],当上样液pH值为6时,树脂对侧柏叶黄酮的吸附率达到最高,表明其有利于吸附于树脂内,这与魏静等研究大孔树脂吸附不同pH值蝴蝶花黄酮溶液的结果相近[10],因此,选择上样液pH值为6较适宜。
2.4 上样流速对吸附率的影响
图3为上样流速对AB-8树脂吸附效果的影响。
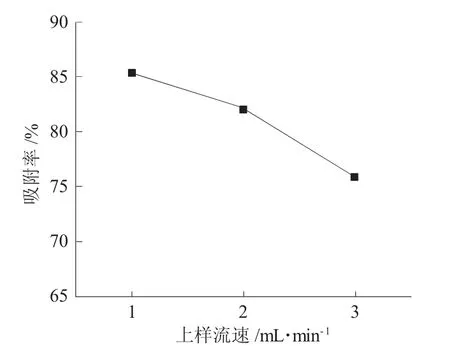
图3 上样流速对AB-8树脂吸附效果的影响Fig.3 Effect of loading sample velocity on adsorption efficiency of AB-8 resin
由图3可见,随着上样流速的增大,AB-8树脂对侧柏叶黄酮的吸附率逐渐下降,大孔树脂对黄酮化合物的吸附分为膜扩散与粒扩散过程,流速越快导致侧柏叶黄酮与树脂的接触时间越短,不利于进行吸附过程,便流出柱外[11]。与1.0mL·min-1上样流速相较,采用2.0mL·min-1的流速上样时,树脂对侧柏叶黄酮的吸附率仅下降(3.1±0.1)%,但上样液体积却增大2倍,与段宇宙等研究不同上样流速下树脂对沉香叶黄酮的变化趋势较一致[12],考虑后续应用的生产效率,因此,选择2.0mL·min-1作为上样流速较适宜。
2.5 泄漏曲线
图4为AB-8树脂对侧柏叶黄酮的动态吸附曲线。
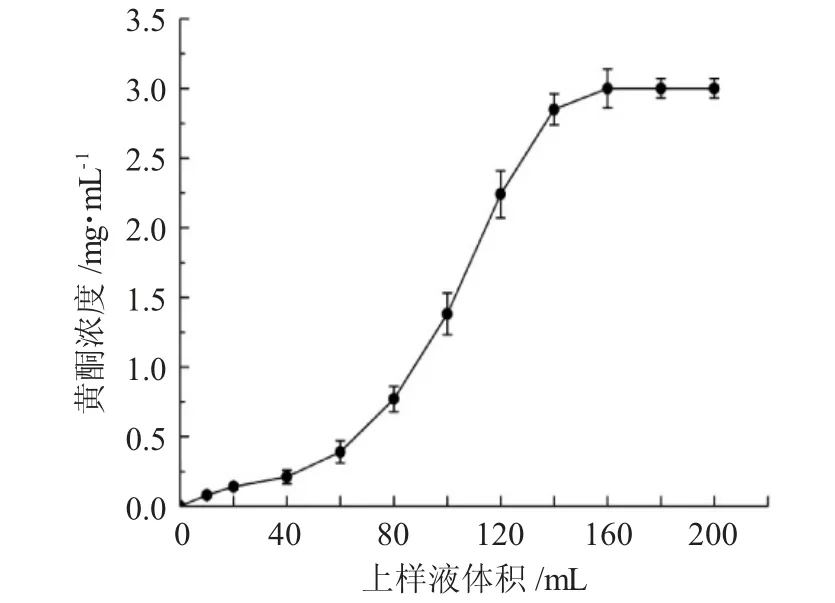
图4 上样液体积对AB-8树脂吸附效果的影响Fig.4 Effect of loading sample volume on adsorption efficiency of AB-8 resin
由图4可知,随着上样液体积增大,流出液中侧柏叶黄酮的浓度逐渐增大,当上样液体积为60mL时,流出液中黄酮化合物浓度为(0.39±0.08)mg·mL-1,约为上样浓度的10%,即为曲线的泄漏点,表明该体积下树脂已开始发生目标化合物的泄漏,继续增大体积至140mL时,流出液中的黄酮化合物浓度接近上样液中侧柏叶黄酮浓度,表明AB-8树脂达到饱和吸附,综合考虑样品利用率与吸附效率,选择上样液体积为60mL。
2.6 洗脱液浓度对洗脱率的影响
图5为洗脱浓度对AB-8树脂解吸侧柏叶黄酮的影响。
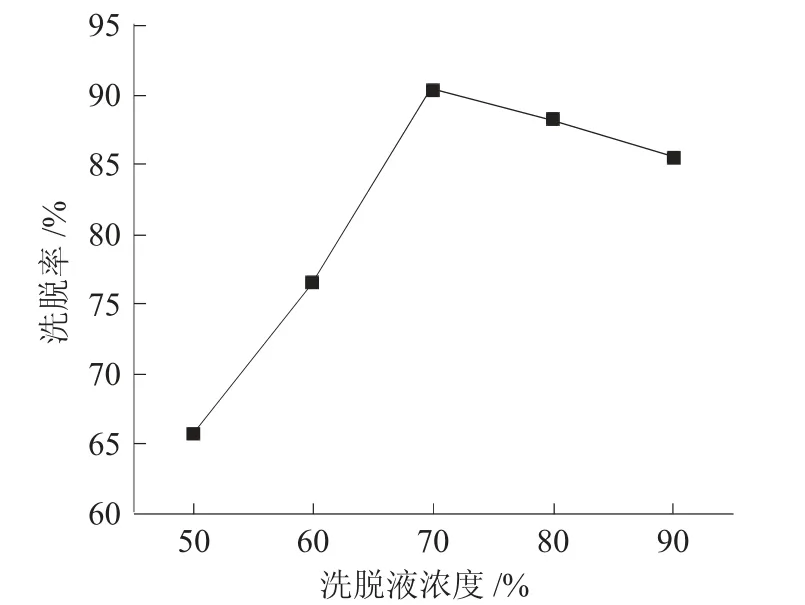
图5 洗脱液浓度对AB-8树脂解吸侧柏叶黄酮的影响Fig.5 Effect of eluent concentration on the desorption of flavonoid from Platycladus orientalis leaves by AB-8 resin
由图5可见,随着洗脱液乙醇的体积分数增大,侧柏叶黄酮的洗脱率呈先增大后减小的趋势,适当浓度的乙醇溶液有利于减小树脂对黄酮化合物的吸附作用力,但浓度过高可能使得吸附的其它杂质(如色素、蛋白质等)同时被洗脱,当乙醇体积分数70%时,洗脱率达到最大,与吴婕等考察不同浓度的乙醇溶液洗脱甜茶叶黄酮的影响一致[13],因此,选择70%乙醇溶液洗脱吸附于树脂中的侧柏叶黄酮。
2.7 洗脱流速对洗脱率的影响
图6为洗脱流速对AB-8树脂解吸侧柏叶黄酮的影响。
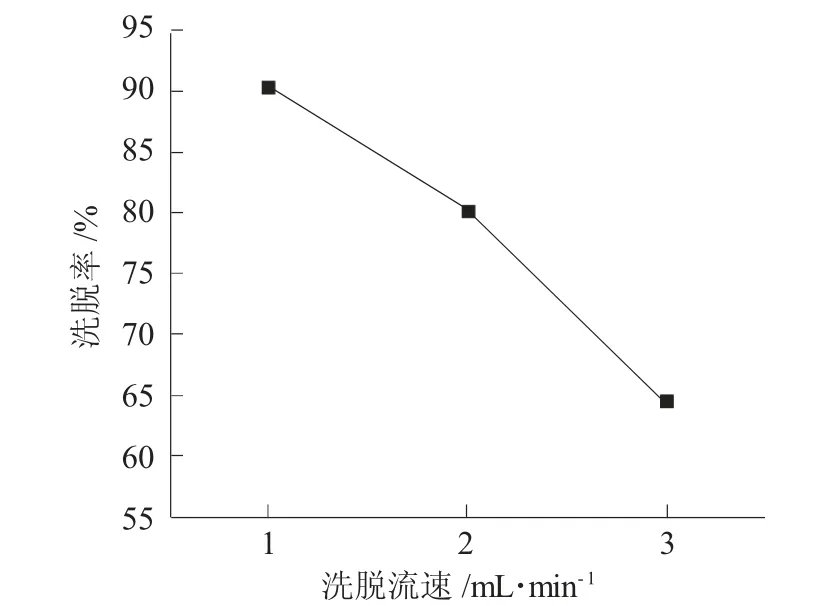
图6 洗脱流速对AB-8树脂解吸侧柏叶黄酮的影响Fig.6 Effect of elution velocity on desorption of flavonoid from Platycladus orientalis leaves by AB-8 resin
由图6可知,侧柏叶黄酮的洗脱率随着洗脱流速加快而逐渐减小,与1.0mL·min-1洗脱流速相较,当洗脱流速为2.0mL·min-1时,乙醇对侧柏叶黄酮的洗脱率下降幅度超过10%。这归因于乙醇流速过快,与吸附在AB-8树脂内的侧柏叶黄酮接触时间过短,从而不利于解吸,导致吸附的部分侧柏叶黄酮未被洗脱,因此,选择1.0mL·min-1作为洗脱流速较适宜。
2.8 洗脱曲线
洗脱曲线可反映不同用量洗脱液对侧柏叶黄酮在的解吸效果,图7为洗脱液体积对AB-8树脂解吸侧柏叶黄酮的影响。
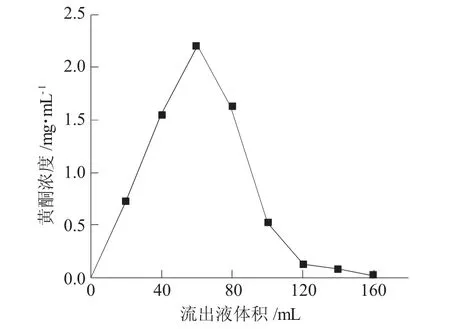
图7 洗脱液体积对AB-8树脂解吸侧柏叶黄酮的影响Fig.7 Effect of eluent volume on desorption of flavonoid from Platycladus orientalis leaves by AB-8 resin
由图7可见,随着洗脱液用量增多,收集的侧柏叶黄酮浓度不断增大,当乙醇用量约为60mL时,流出液中侧柏叶黄酮含量达到最高为(2.2±0.1)mg·mL-1,继续增大洗脱液用量后,流出液中黄酮浓度不断下降,当洗脱液体积为140mL时,流出液中黄酮的浓度仅为0.08mg·mL-1,约为最高浓度的1/25,表明吸附的侧柏叶黄酮基本被洗脱完全,因此,选择最佳洗脱液体积为140mL。
2.9 最佳纯化工艺验证
采用AB-8树脂分离纯化侧柏叶黄酮粗提物,配制pH值为6,3mg·mL-1上样溶液60mL,以2.0mL·min-1流速上样后,采用体积分数为70%乙醇溶液140mL,以1.0mL·min-1流速洗脱,纯化后样品的黄酮纯度由(24.7±0.8)%提高至(68.2±1.1)%,约为纯化前2.8倍,李倩曾采用大孔树脂纯化圆柏黄酮,其纯度较纯化前约提高2.8倍[14],而冯靖采用大孔树脂纯化银杏叶黄酮,其纯度较纯化前约提高3.0倍[15],表明AB-8型大孔树脂纯化侧柏叶黄酮的最佳工艺除杂纯化效果较好。
3 结论
由于黄酮类化合物具有较好的抗氧化、保鲜等作用,为此本研究利用大孔树脂纯化侧柏叶黄酮化合物。通过静态吸附-解吸试验确定AB-8树脂分离纯化侧柏叶黄酮粗提物,其最佳工艺条件为:pH值为6,3mg·mL-1上样溶液60mL,以2.0mL·min-1流速上样后,采用体积分数为70%乙醇溶液140mL,以1.0mL·min-1流速洗脱,纯化后样品的黄酮从(24.7±0.8)%提高至(68.2±1.1)%,表明该纯化工艺分离效果可靠,可用于侧柏叶黄酮的富集。