超声引导下射频消融与手术治疗原发性甲状腺功能亢进症疗效比较
王杰鑫,杨玉萍,周宏莲,戴海霞,刘丽娟,黄 星,张 智
(广东医科大学附属医院1.超声科;2.血管甲状腺乳腺外科,广东湛江 524001)
甲状腺功能亢进症简称甲亢,是指甲状腺激素分泌过多,引起以神经、循环、消化等系统兴奋性增高和代谢亢进为主要表现的一组综合征。目前治疗的方法主要有抗甲状腺药物、131I 治疗和手术切除。药物治疗简便、患者依从性较强,但需长期口服抗甲状腺药物,可造成骨髓抑制和药物性肝损害等并发症;131I治疗不易掌控,容易引起甲亢复发或永久性甲状腺功能减退症(甲减);而手术切除有创伤,可重复操作性差及容易引起甲减[1]。射频消融(RFA)、微波消融(MWA)、激光消融(LA)、海扶刀(HIFU)等微创治疗甲状腺结节是近年来兴起的治疗方法,目前热消融在甲状腺良性结节、微小癌及颈部转移性淋巴结的应用获得临床肯定,然而它在甲亢疾病中应用的相关报道尚少[2-4]。本研究对超声引导下射频消融及手术切除治疗原发性甲亢的疗效进行比较,旨在为超声引导下射频消融治疗原发性甲亢提供更多的参考。
1 资料和方法
1.1 病例与分组
2017 年3 月-2020 年3 月在广东医科大学附属医院行原发性甲亢治疗的患者35 例,均符合以下纳入标准和排除标准。纳入标准:经临床表现及病理检查确诊为原发性甲亢;甲状腺II 度肿大及以上;规范抗甲状腺药物治疗2 a 以上病情仍不稳定;患者不愿继续接受抗甲状腺药物或131I 治疗。排除标准:孕妇或哺乳期妇女;严重心、肝、肾功能不全不能耐受治疗者;有严重出血倾向;合并甲状腺恶性肿瘤者;有心脏起搏器植入等。35 例患者按照自愿原则进行分组,13 例患者(射频组)选择射频消融治疗,均为女性,年龄20~53 岁,平均(30.5±10.2)岁;22 例患者(手术组)选择手术切除,其中男3 例,女19 例,年龄21~67 岁,平均(37.6±13.3)岁。两组患者的性别、年龄的构成差异无统计学意义(P>0.05)。
1.2 方法
两组患者治疗前均完善甲状腺彩超、甲状腺功能、生化检查、血常规、心电图等检查。
手术组患者采取甲状腺次全切除,参照中国甲状腺疾病诊治指南[5]推荐的甲亢手术腺体保留4~6 g。患者平卧位,气管插管麻醉成功后,常规消毒铺巾。取颈前区胸骨上2 cm 做弧形切口,长约7 cm,依次切开皮肤、皮下组织、颈阔肌,于颈阔肌下游离皮瓣,上至甲状软骨,下至胸骨切迹,切开颈白线,向外牵拉颈前肌群,游离甲状腺外科包膜,充分显露甲状腺。超声刀切断右甲状腺悬韧带后,靠近右甲状腺上下极闭合离断甲状腺上、下动静脉,以及中静脉,楔形次全切除右侧甲状腺,并包埋缝合约拇指大小的残余腺叶。再同法楔形次全切除左侧甲状腺,彻底止血后,放置泰陵止血纱保护喉返神经。留置引流管1 条,清点手术用物无误,逐层缝合关闭切口。
射频组患者采用超声引导下射频消融治疗。超声仪器采用迈瑞M9 彩超仪,配备高频率浅表探头。射频消融治疗采用美国RITA公司生产的射频治疗仪及射频针,射频治疗仪型号美国RITA1500X,射频针为一次性单极射频针,电极针UniBlate,消融针裸区范围1~2.5 cm。患者取平卧位,垫高肩部,充分暴露颈前区。术前进行常规超声检查,仔细评估消融进针路径,避开颈前区动静脉、气管、喉返神经等。随后常规消毒铺巾,1%盐酸利多卡因与生理盐水按照1:1配置局部麻醉药,在穿刺部位皮下及甲状腺前方浸润麻醉,于甲状腺周围注入生理盐水作为隔离带。超声引导下将射频针在置入甲状腺腺体,设定射频仪输入功率为50~70 W,启动射频治疗仪开始消融治疗,消融方法采用移动消融方式。根据患者病情第1 次先消融一侧叶1/2~2/3 的腺体组织;第2 次消融间隔1 个月后消融另一侧叶1/2~2/3 的腺体组织。消融过程中应与患者随时保持交流,评估患者疼痛程度及有无声音嘶哑等情况的发生。消融过程中监测消融范围,直至拟定消融范围完全被气体强回声覆盖。术后压迫穿刺点30 min,观察24 h。
1.3 观察指标
采用口述分级评分法记录患者术后当天疼痛分级情况及住院时间。两组患者于术后6、12 个月进行随访,记录两组患者手术前及术后游离三碘甲状腺激素(FT3)及游离四碘甲状腺激素(FT4)、促甲状腺激素(TSH)等甲状腺功能激素水平。记录两组患者的术中出血量、喉返神经损伤情况及甲状腺旁腺功能。记录患者12个月后的甲减发生率[6]。
1.4 疗效评价
根据患者临床症状及甲状腺功能症状进行疗效评价。临床治愈:除眼部症状外,甲亢症状基本消失,体征及FT3、FT4、TSH 恢复正常;好转:症状缓解,体征基本恢复,FT3、FT4、TSH 等甲状腺指标显著好转接近正常;无效:症状、体征及甲状腺功能指标无明显变化。治疗总有效率=100%−无效率[7]。
1.5 统计学处理
采用SPSS 22.0 进行统计学处理。计量资料以±s表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料采用χ2或确切概率法;有序分类资料采用秩和检验。P<0.05为差异有统计学意义。
2 结果
与手术组比较,射频组的住院时间更短(P<0.01)。两组术后当天的疼痛分级比较,差异有统计学意义(P<0.01)。见表1。两组患者的疗效差异无统计学意义(P>0.05),见表2。治疗后,两组患者的FT3、FT4的水平明显降低(P<0.01或0.05),TSH 水平升高(P<0.05),见表3。射频组患者一侧叶腺体的体积占比分别约(0.48±0.11)%(左)、(0.51±0.10)%(右),符合术前设计的消融一侧叶1/2~2/3 的腺体组织,此消融范围达到预期效果,见表4及图1、2。

图1 消融术前甲状腺右侧叶腺体彩色多普勒血流显像显示丰富血流信号
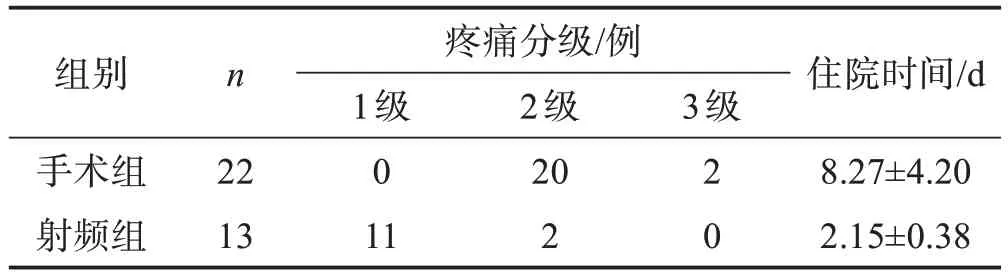
表1 两组患者术后当天疼痛分级及住院时间的比较

表2 术后6个月两组患者疗效的比较 例(%)
表3 术后12个月两组患者甲状腺功能的比较(±s)

表3 术后12个月两组患者甲状腺功能的比较(±s)
与同组治疗前比较:aP<0.01,bP<0.05

表4 射频组消融单侧叶体积及占比
射频组中患者未发现严重不良反应,主要表现为1~2 级疼痛,无明显出血,无喉返神经损伤以及无明显低钙血症引起抽搐;手术组中患者主要表现为2~3级疼痛;术中出血明显1 例,低钙血症引起抽搐3 例,无喉返神经损伤病例。术后随访12 个月,射频组中,3 例患者TSH 降低,而T3、T4 恢复正常;1 例患者复发,没有患者发生甲减。手术组中,4 例患者TSH 升高,而T3、T4 正常;1 例患者复发;3 例患者复查甲功发生甲减。两组的甲减发生情况差异无统计学意义(P>0.05)。

图2 消融术后甲状腺右侧叶腺体彩色多普勒血流显像显示消融区无明显血流信号
3 讨论
射频消融术在肝脏、甲状腺、肺脏肿瘤治疗上应用较多且日趋成熟,但其在甲亢治疗方面的报道较少[8]。射频消融的原理是利用高频振荡器所产生的高频电流接触结节周围组织,产生分子极性变化从而转化为热能,进而通过热量的传导破坏组织中的蛋白质,从而灭活组织细胞,达到缩小结节的目的[9]。本文中,射频组在超声引导下射频消融术通过合理的损毁甲状腺大部分腺体,结果显示两组术后当天的疼痛分级及住院时间比较,差异有统计学意义(P<0.01),说明超声引导下射频消融治疗甲亢能减少患者疼痛的主观感受,达到微创的目的,从而缩短患者住院时间。而射频消融术治疗后患者的甲状腺功能指标有明显改善,提示超声引导下射频消融可有效改善甲亢患者的甲状腺功能及缓解临床症状,其疗效与手术切除相当。
本文中,射频组在治疗中及治疗后的随访均未发生严重不良反应,提示射频消融治疗方式安全性良好,其在保证治疗安全性方面有优势:首先,超声引导下射频消融可实时动态观测消融针穿刺的路径,可以避免对甲状腺周围重要血管及神经的误伤,从而避免出血及神经损伤的发生;其次,射频消融术中先行甲状腺外包膜与周边正常组织注射生理盐水建立隔离带,增加甲状腺腺体与周围神经、血管之间的距离,保证了安全操作的距离,避免术中热量外溢对周围组织造成热损伤;再次,射频消融产生的热能可以使腺体组织发生凝固坏死,阻止甲状腺激素入血,避免甲亢危象的发生。本文两组的甲减发生情况差异无统计学意义(P>0.05),提示射频消融治疗在保证治疗效果的同时,并不增加终身性甲减的发生率。
射频消融术治疗甲亢的关键在于毁损甲状腺大部分腺体,从而减少甲状腺激素的分泌。目前,国内外还没有相关文献或指南推荐甲亢患者的消融范围。中国甲状腺疾病诊治指南推荐甲亢手术腺体保留4~6 g[6],2016 版ATA 指南推荐保留甲状腺组织≤2 g[10],日本相关文献推荐保留甲状腺组织<3 g[11]。为防止永久性甲减及喉返神经损伤,我们拟行甲状腺的分次分叶消融,将靠近气管、食管旁及靠近后侧被膜的腺体(距离被膜约2 mm)保留,并且一侧叶消融体积占比约50%。射频组患者从远期转归情况来看,临床疗效达到一个满意的目标,说明射频消融术前预设方案是可行的。因此,超声引导下射频消融术是治疗原发性甲亢的一种有效手段,值得推广。

