基于logistic回归和决策树法预测颅脑肿瘤患者术后病情恶化风险
张燕,彭伶丽,张磊,周芳意,罗贞
手术是颅脑肿瘤患者主要的治疗手段,但择期开颅术后30 d内病死率为1.0%~2.5%[1-2]。由于颅脑肿瘤术后患者病情危重、病情变化迅速且隐匿,发生病情恶化的风险高。因此,筛选颅脑肿瘤术后病情恶化的风险因素,建立早期预警模型,对及早识别术后高危患者、降低术后病死率具有重要意义。近年来,伴随人工智能的发展和大数据时代的到来,数据挖掘技术在医疗卫生领域的应用优势愈加凸显[3]。据报道,决策树、支持向量机、人工神经网络等数据挖掘技术比logistic回归分析法更能准确地预测病情恶化[4]。而现有的病情评价系统如早期预警评分、改良早期预警评分、国家早期预警评分等大多是基于生命体征数据、运用传统的logistic回归方法建立,缺乏针对性。陈圆圆等[5]运用logistic回归法建立了颅脑肿瘤专科预警模型,但未纳入血生化及影像学检查等指标,未比较其他数据挖掘技术与传统logistic回归法的预测准确性。鉴此,本研究探索性地选用logistic回归分析法和决策树法两种预测模型分别构建颅脑肿瘤患者术后病情恶化的早期预警模型,并对比两种模型的预测效果优劣,力图探索颅脑肿瘤患者术后病情恶化风险评估的更优模型,更好地帮助临床医护人员筛选潜在的危重患者,为早期针对性护理干预提供参考。
1 对象与方法
1.1对象
1.1.1纳入与排除标准 采用病例对照的研究方法,选取中南大学湘雅医院确诊颅脑肿瘤行开颅手术患者为研究对象。纳入标准:①临床症状和体征符合颅脑肿瘤诊断要点,临床病历资料显示颅脑肿瘤疾病诊断,在住院期间发生非计划性再次手术或非计划性转入ICU或死亡;②年龄≥14岁;③住院时间>24 h。排除标准:①并存急性心、肝、肾功能不全;②开颅术后因病情需要计划性转入ICU实施监护、进行计划性再次手术;③非病情恶化原因(如未达到效果手术再调整,引流管问题、切口问题等)导致的非计划性再次手术、非计划性转入ICU、死亡;④孕妇;⑤因可疑风险转入ICU后但病情未发生恶化;⑥手术室、麻醉复苏室、外院直接转入ICU。共纳入患者539例,其中住院期间发生病情恶化(病例组)241例(非计划性转入ICU 73例,非计划性再次手术155例,死亡13例),同期手术但未发生病情恶化(对照组)298例。病例组中,男120例,女121例;门诊入院222例,急诊入院19例。肿瘤类型:脑膜瘤68例,弥漫性星形细胞和少突胶质细胞肿瘤73例,蝶鞍区肿瘤33例,颅神经和脊旁神经肿瘤29例,神经元及混合性神经元-胶质肿瘤5例,淋巴瘤7例,生殖细胞肿瘤10例,间叶肿瘤,非脑膜皮型肿瘤7例,室管膜肿瘤3例,胚胎性肿瘤6例。患糖尿病18例,患肺部疾病18例,肝脏疾病44例。有吸烟史27例。急诊手术5例,择期手术23例,限期手术213例。体温37.10(36.80,38.00)℃;血钾3.80(3.54,4.10)mmol/L,白细胞13.43(9.75,16.00)×109/L。对照组中,男148例,女150例;门诊入院282例,急诊入院16例。肿瘤类型:脑膜瘤72例,弥漫性星形细胞和少突胶质细胞肿瘤84例,蝶鞍区肿瘤57例,颅神经和脊旁神经肿瘤38例,神经元及混合性神经元-胶质肿瘤6例,淋巴瘤7例,生殖细胞肿瘤13例,间叶肿瘤,非脑膜皮型肿瘤16例,室管膜肿瘤1例,胚胎性肿瘤4例。患糖尿病16例,患肺部疾病15例,患肝脏疾病56例;有吸烟史31例。急诊手术2例,择期手术21例,限期手术275例。体温37.10(36.80,38.00)℃;血钾3.77(3.42,4.04)mmol/L,白细胞13.10(9.80,16.35)×109/L。
1.1.2结局指标 本研究颅脑肿瘤患者术后病情恶化的结局指标界定为开颅术后发生非计划性再次手术、非计划性转入ICU或死亡这三类严重不良事件。非计划性转入ICU指患者在同一次住院期间由于病情恶化由普通病房非早期预警转入ICU治疗[6-7];非计划性再次手术指在同一次住院期间,因患者病情发展或术后并发症导致患者计划外的二次手术[8-9];死亡沿用脑死亡的诊断标准[10]。患者发生三类严重不良事件来源均是普通病房。患者在同一次住院期间相继发生多种不良事件,则选择首次事件作为病情恶化的结局,即同一患者同一次住院期间只保留一次病情恶化记录。
1.2方法
1.2.1调查内容 制订统一的患者资料调查表,包括以下6个方面。①一般资料:包括性别、年龄、入院途径、肿瘤类型、基础疾病(高血压、糖尿病、心脏疾病、肺部疾病、肝脏疾病)、吸烟史。②手术相关因素:手术类别、ASA分级、手术时间、术中失血量。③实验室检查:血清钾、血清钠、白细胞、血小板。④基础生理参数:体温、呼吸、心率、收缩压、脉搏血氧饱和度(SpO2)、瞳孔。⑤病情评估系统:改良早期预警评分(MEWS)、格拉斯哥评分(GCS)。⑥影像学检查:为术后中线结构的偏移情况。对于术后的观察指标(实验室检查、生理参数、病情评估系统得分、影像学检查),病例组收集患者发生病情恶化前24 h内最差的一次数值,如资料缺失取最近的一次记录代替;对照组收集住院期间术后病历记录里最差的一次数值。
1.2.2统计学方法 使用Epidata进行数据双录入,核对无误后导入SPSS25.0软件进行统计分析,缺失值用平均值代替。组间比较采用χ2检验、t检验及Mann-WhitneyU检验。采用logistic回归分析建立早期预警模型;选用决策树卡方自动交互检测算法进行变量筛选,建立决策树(树的生长层数为3层,停止规则为α=0.05,父节点、子节点最小样本量分别为200和100)。logistic回归模型采用最大似然法和Hosmer-lemeshow拟合效果检验,用ROC曲线下面积(AUC)评价两个模型预测的鉴别效度。通过MedcalcV20.0.14软件对两个模型的ROC曲线进行绘制与对比。检验水准α=0.05。
2 结果
2.1两组一般资料比较 两组性别、入院途径、肿瘤类型、是否患有糖尿病、肺部疾病、肝脏疾病,是否吸烟、手术类别、血钾及白细胞水平、体温比较,差异无统计学意义(均P>0.05),两组差异有统计学意义的项目及比较,见表1。
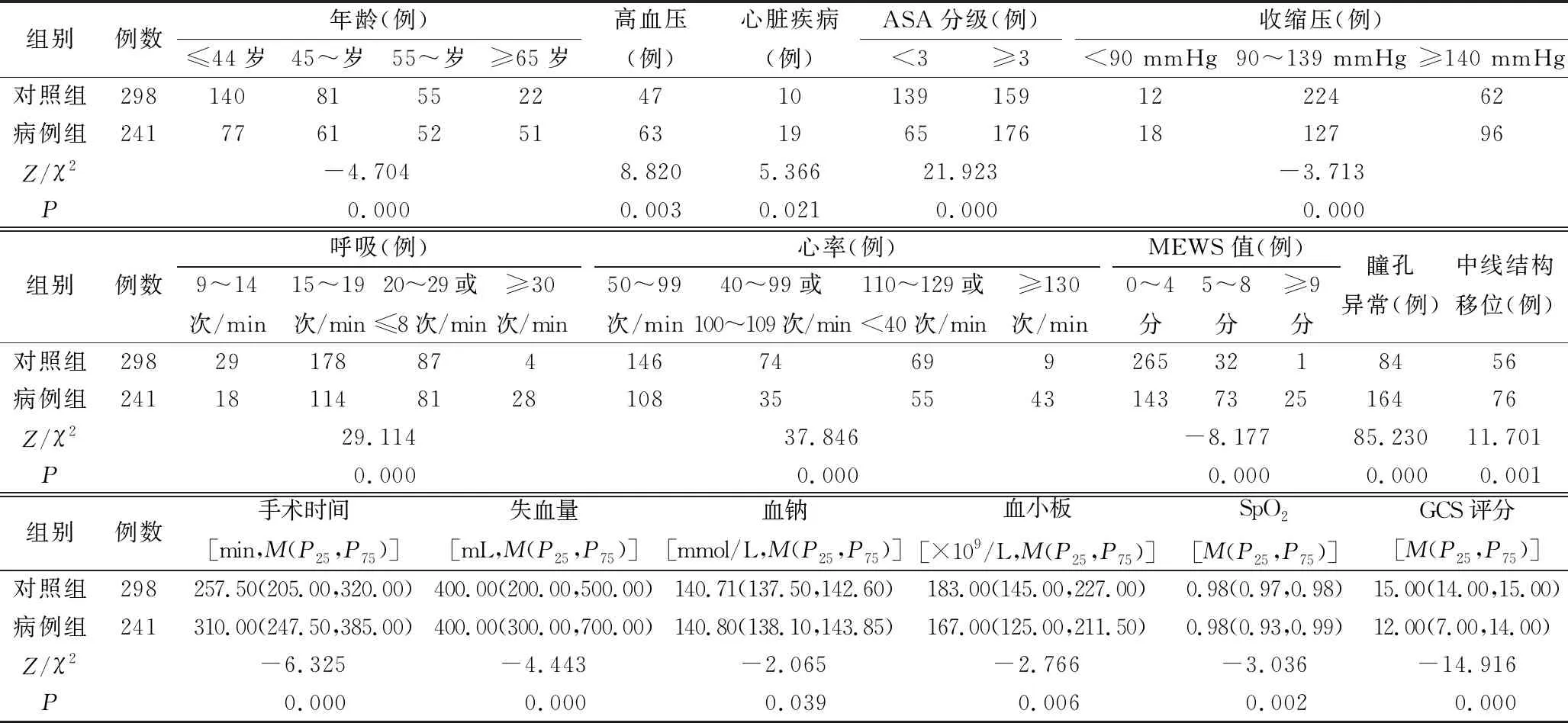
表1 两 组 一 般 资 料 比 较
2.2logistic回归模型 以是否发生病情恶化为因变量Y(否=0,是=1),将单因素分析中有统计学意义的16个变量进行二元logistic回归分析。结果显示,ASA分级X1(<3=0,≥3=1)、手术时间X2(原值输入)、SpO2X3(原值输入)、GCS评分X4(原值输入)、中线结构移位X5(否=0,是=1)是独立危险因素。得到颅脑肿瘤术后病情恶化早期预警模型:Logit(P)=10.951+0.982X1+0.004X2-0.077X3-0.572X4+0.800X5。模型似然比卡方为291.628,df=5,P<0.01,模型有统计学差异;Hosmer-lemeshow拟合优度检验χ2=10.738,df=8,P=0.217,模型拟合较好。见表2。
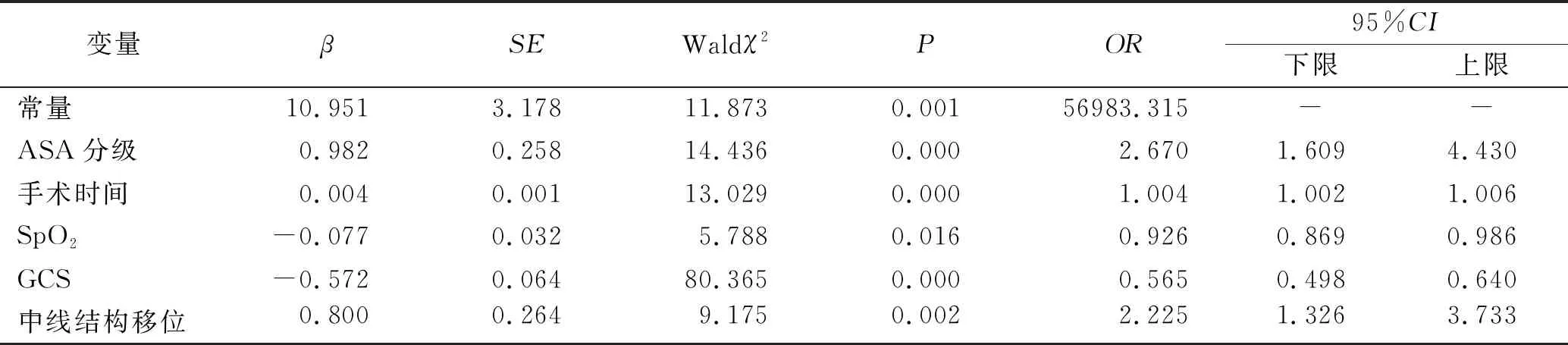
表2 颅脑肿瘤患者术后病情恶化早期预警模型的logistic回归分析(n=539)
2.3决策树模型 将有统计学差异的16个自变量作为预测因子纳入决策树模型,生成的决策树模型见图1。决策树生长2层,共6个节点,其中终末节点4个。结果显示GCS评分和ASA分级是颅脑肿瘤术后病情恶化的影响因素,首层为GCS评分,表明GCS评分对病情恶化的影响最大。其中GCS评分≤9分的患者病情恶化的发生率是93.7%,高于GCS评分为9~14分的患者(58.7%)和GCS评分>14分的患者(14.9%);对于GCS评分>14分的患者,另一个预测变量是ASA分级,ASA分级≥3的患者病情恶化的发生率(19.4%)高于ASA分级<3的患者(9.8%)。
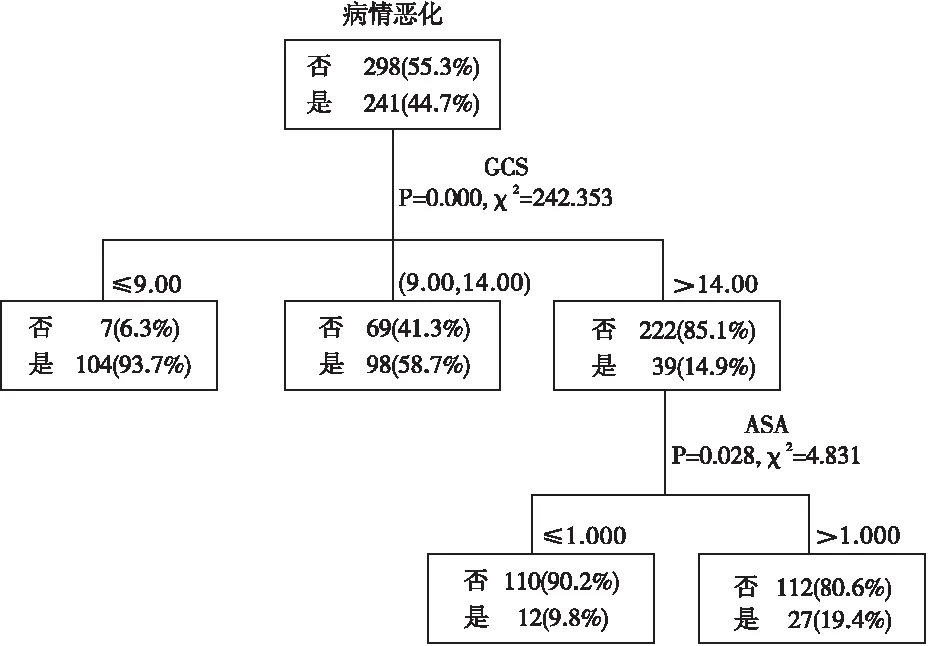
图1 颅脑肿瘤术后病情恶化影响因素的决策树交互检测算法分析
2.4两种模型比较 对照组(298例)用logistic回归模型和决策树模型分别预测40例、76例发生病情恶化,病例组(241例)分别预测167例、202例发生病情恶化,可得logistic回归和决策树模型的分类正确率分别为78.8%[(167+298-40)/(298+241)]和78.7%[(202+298-76)/(298+241)]。logistic回归模型的灵敏度和约登指数(69.3%,0.559)低于决策树模型(83.8%,0.583),其特异度(86.6%)高于决策树模型(74.5%)。以logistic回归模型与决策树模型的预测值作为状态变量,分别绘制ROC曲线,前者的AUC为0.881(95%CI:0.851~0.907),标准误为0.0145;决策树模型的AUC为0.848(95%CI:0.815~0.877),标准误为0.0160,两模型的预测效果中等(0.7~0.9),AUC差异有统计学意义(95%CI:0.0130~0.0536,Z=3.222,P=0.001)。
3 讨论
本研究logistic回归模型结果显示,ASA分级、手术时间、脉搏血氧饱和度、GCS评分、中线结构移位是颅脑肿瘤术后病情恶化的独立危险因素,与以往的研究结果类似[4,11]。其中GCS评分和ASA分级是两种模型共同的危险因素,而GCS评分位于决策树的首层,是决策树模型中影响病情恶化的首要因素,与彭丽等[12]研究结果相符。GCS评分反映患者的意识障碍程度,评分低往往预示着预后不良,因此,术后应密切关注GCS评分低的患者,正确掌握GCS的评估方法,辅助病情判断。ASA分级根据患者系统性疾病程度及代偿能力分为5级,随系统性疾病程度升高而升高。本研究结果显示,ASA≥3级的患者术后发生病情恶化的风险显著高于ASA<3级的患者(P<0.01),说明ASA分级越高的颅脑肿瘤患者是病情恶化高危人群,与孟凯等[13]研究结果一致。Quinn等[14]研究结果发现,ASA分级为4级和5级的患者发生心脏骤停的风险高于1级或2级患者。ASA分级越高的患者合并症多,手术难度大,手术风险高,术前应做好手术风险的全面评估和术前准备,术后加强监护。
此外,手术时间、脉搏血氧饱和度、中线结构移位也是颅脑肿瘤患者术后发生病情恶化的独立危险因素。Dasenbrock等[15]分析11 462例开颅手术患者的资料,发现手术时间长是出现血肿需非计划性再次手术的预测因素之一。可能与手术时间长,脑组织暴露于外界的时间长,易导致颅内感染等并发症的发生有关[16]。脉搏血氧饱和度能在一定程度上反映血氧饱和度及呼吸功能的变化,帮助医护人员及时发现早期的低氧血症,同时也间接反映了循坏功能[17]。本研究结果显示,脉搏血氧饱和度越低者病情恶化风险越高(P<0.05)。由于脑组织对缺氧的耐受性很差,严重缺氧会损伤脑细胞,也会导致心律失常、心脏骤停等并发症,加重患者的病情。护理人员需要根据患者病情选择合适的吸氧方式,吸氧过程中监测血氧饱和度的变化,根据血氧饱和度调整吸氧浓度和时间。中线结构位于正中矢状线,包括第三脑室、胼胝体、透明隔、大脑镰、丘脑、丘脑间粘合、松果体等[18]。由于颅腔的总容积固定,在发生引起容积变化的病变时,会导致处于正常位置的脑组织移位、受压、变形等异常改变,即产生所谓的占位效应。如果占位发生在中线结构或非对称的两侧,可能会造成中线结构的偏移。本研究中病例组有32.1%的颅脑肿瘤患者术后CT检查发现有中线结构移位,显著高于对照组(20.7%)。中线结构移位与病情严重程度和临床预后密切相关,如杜玲等[19]对278例出血性脑卒中患者进行前瞻性研究,发现中线结构发生偏移患者的风险比为1.776,是30 d内死亡的独立预测因素。且中线结构移位越大,患者的病死率越高[20]。因此,监测脑中线结构的移位情况对指导医护人员辨别可能发生的病情恶化、判断预后具有重要意义。
本研究两种预测模型的分类准确率相近,均达到70%以上,模型效果较好。logistic回归模型的灵敏度和约登指数低于决策树模型,但特异度高于决策树模型,说明决策树模型判别真正发生病情恶化的能力较高,而logistic回归模型预测实际不发生病情恶化的能力较高。logistic回归模型的AUC显著高于决策树模型(P<0.01),说明其预测效能更高。主要因为logistic回归模型中包含的变量更多,模型更稳定。有研究指出,logistic回归模型和决策树模型各具优势,两者结合可以充分解释变量间的关系[21]。就本研究而言,logistic回归模型虽然能反映病情恶化与各自变量的依存关系,但在反映变量间的交互作用上不如决策树模型。而决策树模型不受变量间共线性的影响,能显示变量间的交互关系及各自变量对结果变量的重要程度,并以概率的形式展示。如本研究中决策树的首层为GCS评分,其与病情恶化的相关性最高,评分越低的患者发生病情恶化的概率越高;第二层显示变量间的相互作用,如GCS>14分的患者要进一步考虑ASA分级才能判断病情恶化的风险性。且决策树生成的树形图能直观地展示有分类或有预测意义的变量[22],易于医护人员理解和使用。但与logistic回归模型相比,决策树模型不能输出OR值,分类结果受实际数据控制,会随叶子节点数的变化而变化,欠缺稳定性。因此,两者可互为补充,从不同层面发现影响颅脑肿瘤术后病情恶化的因素,为医护人员筛选高危患者提供参考。
4 小结
本研究采用logistic回归分析和决策树法分别建立颅脑肿瘤患者术后病情恶化的早期预警模型,并对比两者的预测效能,结果显示logistic回归模型的预测效果优于决策树模型,而决策树模型更直观,易于理解,两者结合可以帮助医护人员从数学统计、树形图等多角度综合评判患者病情恶化风险。鉴于样本量较小,本研究未探讨其他数据挖掘技术如人工神经网络、贝叶斯等方法的应用效果,未来有望开展大样本、多中心的前瞻性队列研究,对所建立的模型进一步完善。

