钙非依赖性磷脂酶A2在肾内动脉平滑肌收缩反应中的作用
秦晓玥,李穗敏,曾 鹏,陈淑贞,王义蓉,邝素娟,杨 慧,饶 芳,邓春玉
[1.华南理工大学生物科学与工程学院,广东 广州 510006; 2.广东省人民医院(广东省医学科学院)医学研究部临床药理重点实验室,广东 广州 510080;3.华南理工大学医学院,广东 广州 510006; 4.广东省心血管病研究所心血管内科,广东 广州 510080]
正常血管平滑肌细胞(VSMCs)通过细胞内外钙的交换和细胞内钙库的调节两种方式来调节细胞内Ca2+浓度。细胞膜主要通过L型钙通道等电压操纵性钙通道,钙库操纵性钙通道(store-operated calcium channels,SOC)和受体操纵的钙通道控制细胞内外Ca2+交换[1]。胞内Ca2+是VSMCs重要的第二信使,参与VSMCs“兴奋-收缩偶联”与“兴奋-转录偶联”过程,首先发挥“兴奋-收缩偶联”功能调节。常用的血管平滑肌收缩剂苯肾上腺素(phenyhrine,Phe)和5-羟色胺(5-hydroxy tryptamine,5-HT)分别与VSMCs膜上α、5-HT2A受体结合,通过与Gq蛋白结合而激活磷脂C(PLC),使磷脂酰肌醇二磷酸(PIP2)水解为三磷酸肌醇(IP3)和二酰基甘油(DAG),IP3与内质网上IP3受体结合诱导内质网Ca2+流入细胞质中。同时,内质网中的Ca2+耗竭,诱导SOC通道开放,细胞外Ca2+内流,称为钙库操纵性钙内流(store-operated calcium entry, SOCE)[2]。此外,DAG还可以激活不依赖于肌浆网钙释放的花生四烯酸调控的钙通道(arachidonate-regulated Ca2+,ARC)来增加细胞内钙浓度[3]。
SOC通道是广泛存在于兴奋性和非兴奋性细胞中介导Ca2+进入细胞内的重要通道,研究表明,许多疾病都与SOC异常有关,如SOCE的异常可增加血小板的黏附性并聚集,这可导致糖尿病的微血管和大血管病变的发生[4];肾系膜细胞中SOC功能的下调,可抗肾脏纤维化等[5]。但是,肾内动脉平滑肌细胞SOC通道的激活机制还需进一步研究。已有报道SOC通道激活与钙非依赖性磷脂酶A2(calcium-independent phospholipase A2,iPLA2)密切相关,有效的iPLA2不可逆抑制剂BEL可减少主动脉平滑肌细胞的SOC通道介导钙内流,抑制细胞增殖[6]。磷脂酶A2(PLA2)是一类水解磷脂酯键的酶,分解产生花生四烯酸(arachidonic acid,AA)和溶血磷脂等,iPLA2主要与膜相关,且已在心脏、小动脉内皮细胞和肾脏中报道了内质网相关iPLA2活性[7]。已有报道提出,PLA2除了可以调控SOC通道外,分解产生的微量AA还可以激活ARC通道[8]。然而,iPLA2在肾内动脉平滑肌钙调控中的作用,有待进一步阐明。本研究通过观察BEL对肾内动脉血管张力的影响,探讨iPLA2与肾内动脉平滑肌钙调控的关系。
1 材料
1.1 实验动物18周龄SPF级C57BL/6小鼠,雄性,共30只,购于广东斯嘉景达生物科技有限公司,许可证号:SCXK(粤)2020-0052,饲养于华南理工大学实验动物中心。本研究所有动物实验已通过广东省人民医院(广东省医学科学院)的动物实验伦理审查(NoGDRE201208a)。
1.2 实验药物5-HT(091M5163V)、Phe(039K1453)、硝苯地平(nifedipine,57H1139)、毒胡萝卜素(TG,049M4032V)、EGTA(111K5411)均购于Sigma公司;Fluo-4AM(2298173)购于赛默飞公司;AA(HY-109590)、BEL(HY-107411)购于MCE公司;其余试剂皆为国产分析纯。
1.3 实验溶液Krebs Henseleit溶液(K-H溶液)(mmol·L-1):NaCl 119、NaHCO325、 MgCl2·6H2O 1、KCl 4.7、KH2PO41.2、CaCl22.5、D glucose 11.1;高钾K-H溶液(mmol·L-1):KCl 60、NaCl 63.7、NaHCO325、MgCl2·6H2O 1、KH2PO41.2、CaCl22.5、D-glucose 11.1;Ca2+-free K-H溶液(mmol·L-1):NaCl 119、NaHCO325、MgCl2·6H2O 1、KCl 4.7、KH2PO41.2、D-glucose 11.1、EGTA 0.05;Ca2+-free高钾K-H溶液(mmol·L-1):KCl 60、NaCl 63.7、NaHCO325、MgCl2·6H2O 1、KH2PO41.2、D-glucose 11.1、EGTA 0.05;含Ca2+台式液(mmol·L-1):NaCl 136、MgCl2·6H2O 1、KCl 5.4、NaH2PO4·2H2O 0.33、CaCl2·2H2O 1.0、HEPES 10.0、D glucose 10;张力实验所用溶液根据上述浓度配好后均通95% O2±5% CO2混合气使其充分饱和,台式液需用NaOH(3 mol·L-1)调至7.40。
1.4 实验仪器620M型小血管张力测定仪(丹麦,DMT公司);PowerLab 8/30生物信号采集处理系统(澳大利亚,AD公司);Stemi DV4型体视显微镜(德国,ZEISS公司);DK-8D型电热恒温水槽(上海医用恒温设备厂);Leica SP5-FCS激光共聚焦显微镜。
2 方法
2.1 小鼠离体肾内动脉血管环的制备离体肾内动脉血管环制备同已发表文献[9-10]。颈椎脱臼法处死小鼠后,快速取出肾,放入4 ℃预冷并通混合气的K-H溶液中,借助体视显微镜去除肾内动脉血管周围的其他组织,无损伤的分离出肾内动脉血管,剪成长度为2.0 mm左右的血管环;用两根直径40 μm的不锈钢丝先后穿过血管环,将其固定在张力测定仪浴槽内的两个钳夹上,在穿入钢丝的同时轻微摩擦去除内皮,拧紧两根钢丝并使其处于平行状态保证血管受力均匀。在恒温37 ℃和持续通入混合气的浴槽中固定好血管环,平衡30 min后,给予肾内动脉1.5 mN的基础张力,每15 min置换溶液1次,并使基础张力维持在1.5 mN,平衡60 min后加药反应。
2.2 血管反应性及内皮完整性测定血管张力反应性检测同已发表文献[9,10]。待血管张力稳定后,给予1.5 mN基础张力,然后高钾K-H溶液刺激,检测血管反应性。高钾溶液刺激达到最大张力后,K-H溶液洗4次,使其恢复至基线,稳定15 min后,调整基础张力,再用高钾K-H溶液置换K-H溶液,反复操作,直至连续两次高钾溶液刺激引起的血管张力值相差不超过10%,可进行后续实验。稳定20 min后,加入血管收缩剂Phe(1 μmol·L-1),血管收缩,待张力达最大值并趋于稳定后加入血管舒张剂Ach(1 μmol·L-1),若血管舒张程度在10%以内,视为内皮去除完全,可进行后续试验。
2.3 实验药物对离体肾内动脉血管张力变化的影响
2.3.1BEL对血管收缩剂诱导肾内动脉血管收缩反应影响 对血管功能性检测合格并检测内皮完整性的血管,采用浓度梯度给药法,分别加入各浓度梯度的血管收缩剂5-HT(0.001~10 μmol·L-1)和Phe(0.001~10 μmol·L-1),观察血管张力的变化。当血管收缩效应达到最大值不再变化后,用K-H液洗脱4次,洗至基线稳定后,加入溴烯醇内酯(10 μmol·L-1)孵育30 min,重复上述5-HT和Phe浓度梯度给药,观察溴烯醇内酯对血管收缩量效曲线的影响。
2.3.2BEL对L型钙通道介导肾内动脉血管收缩反应影响 另取血管功能性检测合格并检测内皮完整性的血管,Ca2+-free高钾K-H溶液洗脱至基线平衡,稳定20 min加累计浓度CaCl2(0.001~5 mmol·L-1),当血管收缩反应达到最大值不再变化后,用K-H液洗脱4次,洗至基线稳定后,继续用Ca2+-free高钾K-H溶液洗至基线,加溴烯醇内酯(10 μmol·L-1)孵育30 min,重复累计浓度CaCl2,观察溴烯醇内酯对L型钙通道影响。
2.3.3BEL对肌浆网钙释放介导肾内动脉血管收缩反应影响 另取功能检测合格并检测内皮完整性的血管,在Ca2+-free K-H溶液洗脱后,加硝苯地平(1 μmol·L-1)孵育30 min,5-HT和Phe浓度梯度给药,当血管收缩反应达到最大值不再变化后,用Ca2+-free K-H溶液洗脱4次,洗至基线稳定后,加入硝苯地平(1 μmol·L-1)和溴烯醇内酯(10 μmol·L-1)共同孵育30 min,重复上述5-HT和Phe浓度梯度给药,观察溴烯醇内酯对血管收缩量效曲线的影响。
2.3.4BEL对SOC通道介导肾内动脉血管收缩反应影响 另取血管功能性检测合格并检测内皮完整性的血管,Phe(1 μmol·L-1)给药达到最大浓度后,Ca2+-free K-H溶液洗脱至基线平衡,加硝苯地平(1 μmol·L-1)和TG(2 μmol·L-1)孵育30 min,加入CaCl2(2.5 mmol·L-1),处理组加BEL(10 μmol·L-1)与硝苯地平和TG共同孵育,观察BEL对SOC的影响。
2.4 激光共聚焦检测BEL对平滑肌细胞内Ca2+浓度影响将来源于ATCC的人主动脉平滑肌细胞株均匀种在激光共聚焦专皿上,待其密度达80%左右,洗去培养基,PBS反复清洗,再重新给与1 mL培养基。避光下1 mL培养基中加入3 μL Fluo-4 AM(一种自身不发光,与Ca2+结合后显荧光的螯合剂),在暗处恒温37 ℃培养箱孵育30 min使荧光充分与细胞内Ca2+结合。弃去含荧光染料培养基,台式液洗涤,加入1 mL含钙台式液。加入硝苯地平(1 μmol·L-1)去除L型钙通道影响,处理组加入BEL(10 μmol·L-1)共同孵育15 min。在激光共聚焦显微镜下找到细胞,设置荧光强度记录模式,扫描6 min,扫描开始后1 min左右加入AA(8 μmol·L-1),观察荧光变化情况。无荧光背景设为F0,细胞静息状态时荧光强度设置为F1,加入AA后最大荧光值记为F2,以(F2-F1)/(F1-F0)为纵坐标,时间为横坐标作图。
2.5 统计学处理实验数据处理同已发表文献[9,10]。以最后两次高钾K-H溶液刺激张力值的均值为标准值,各药物达稳态的血管收缩张力值占标准值的百分数即药物引起血管收缩的大小。

3 结果
3.1 BEL抑制收缩剂诱导的小鼠肾内动脉血管张力使用累积浓度梯度法加入血管收缩剂5-HT(0.001~10 μmol·L-1)和Phe(0.001~10 μmol·L-1),5-HT与Phe均可诱导小鼠肾内动脉血管呈浓度依赖性收缩,在达到最大浓度后洗脱至基线,待其稳定后加入BEL(10 μmol·L-1)孵育,发现孵育BEL后的血管收缩剂5-HT和Phe诱导血管张力较对照组下降(P<0.01)。BEL孵育组对5-HT诱导肾内动脉量效曲线的Emax(85.43±13.30,n=12)明显低于对照组(113.36±11.66,n=12)(P<0.01),而pEC50在两组间差异无显著性(P>0.05);BEL孵育组对Phe诱导肾内动脉量效曲线的pEC50(6.48±0.18,n=9)低于对照组(6.68±0.19,n=9)(P<0.05),而Emax在两组间差异无显著性(P>0.05)。见Fig 1。
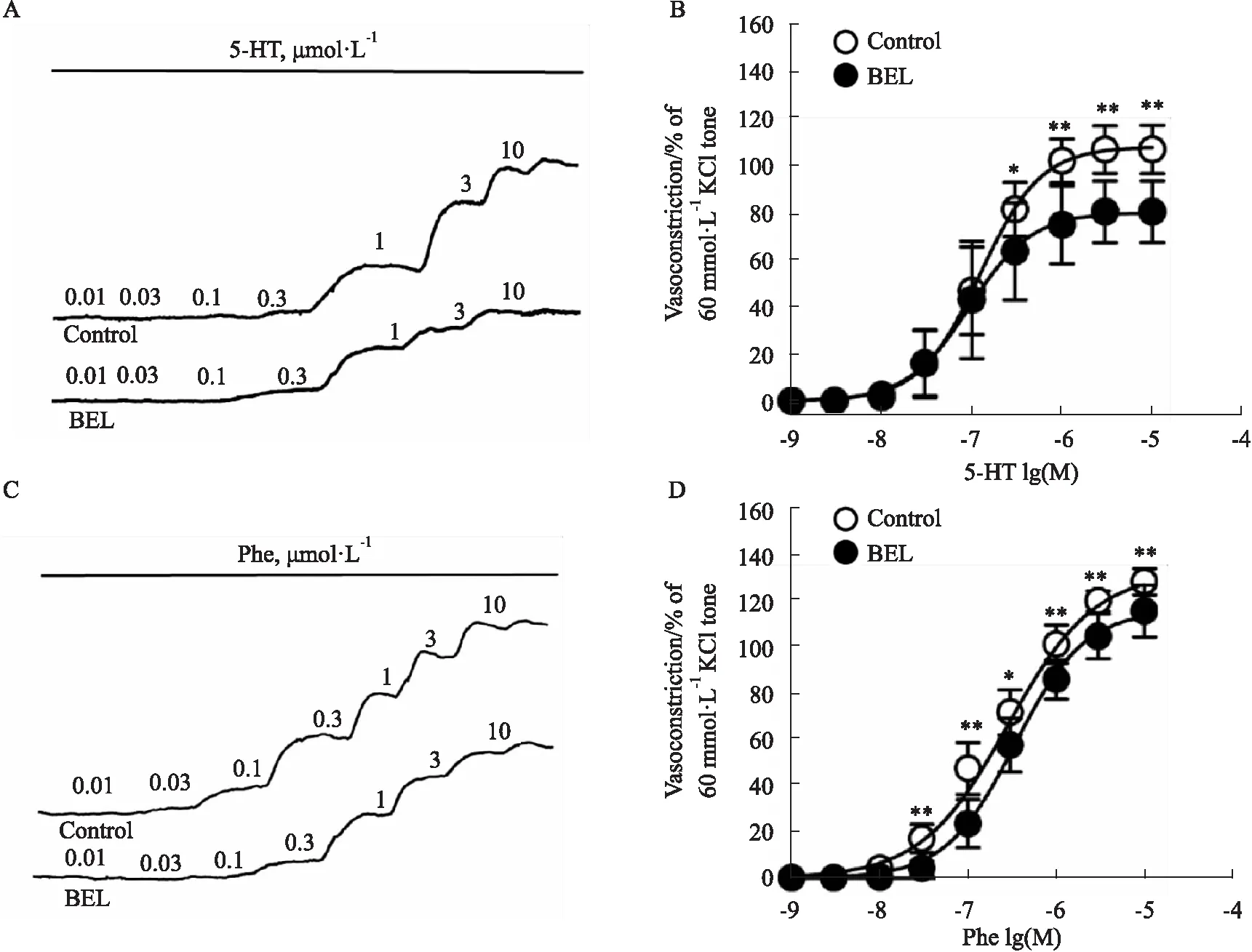
Fig 1 Effect of BEL on 5-HT and Phe-induced concentration-dependent vasoconstriction of intrarenal arterial rings in mice
3.2 BEL抑制L型钙通道诱导的小鼠肾内动脉血管张力在Ca2+-free高钾K-H溶液多次洗至基线平衡后,加入浓度梯度CaCl2(0.001-5 mmol·L-1),发现CaCl2诱导血管呈浓度依赖性收缩。在达到最大浓度后洗脱至基线,待其稳定后加入BEL(10 μmoL·L-1)孵育,与正常组对比,BEL孵育组对CaCl2诱导肾内动脉血管张力下降(P<0.01)。BEL孵育组对CaCl2诱导肾内动脉量效曲线的pEC50(3.16±0.13,n=6)低于对照组(3.39±0.16,n=7)(P<0.05),而Emax差异无显著性(P>0.05)。见Fig 2。
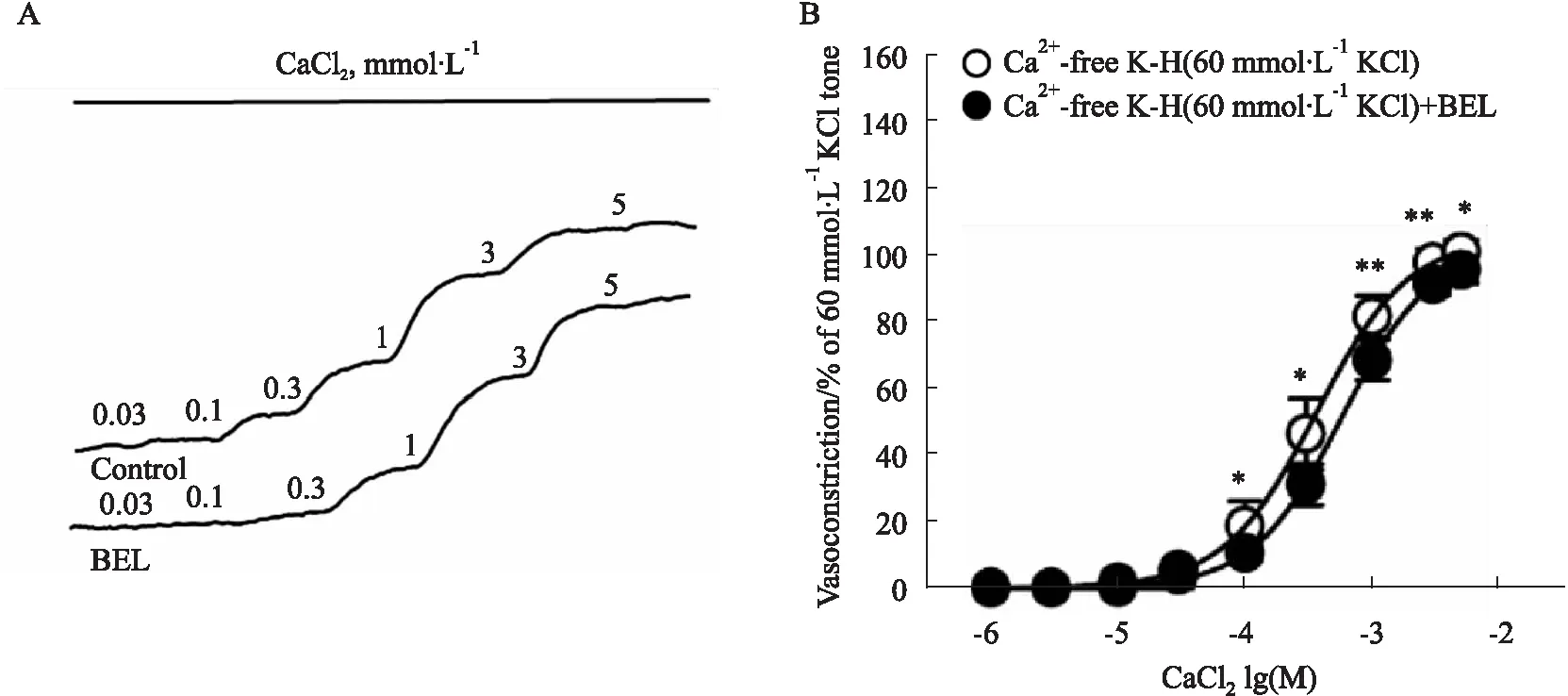
Fig 2 Effect of BEL on CaCl2 induced concentration-dependent vasoconstriction of intrarenal arteries in mice
3.3 BEL抑制肌浆网钙释放诱导的小鼠肾内动脉血管张力在Ca2+-free K-H溶液中加L型钙通道阻断剂硝苯地平(1 μmol·L-1)孵育后,采用浓度梯度法加入血管收缩剂5-HT(0.001~10 μmol·L-1)和Phe(0.001~10 μmol·L-1),此时肌浆网钙释放诱导血管收缩,在达到最大浓度后洗脱至基线,待其稳定后加入BEL(10 μmol·L-1)孵育,发现BEL孵育组与正常组对比,肌浆网钙释放诱导的浓度依赖性收缩明显下降(P<0.01),BEL孵育组对Phe诱导肾内动脉量效曲线的Emax和pEC50在两组间差异均无显著性(P>0.05);BEL孵育组对5-HT诱导肾内动脉量效曲线的Emax(11.62±9.92,n=6)低于对照组(23.65±7.09,n=7)(P<0.05),而pEC50在两组间差异无显著性(P>0.05)。见Fig 3。
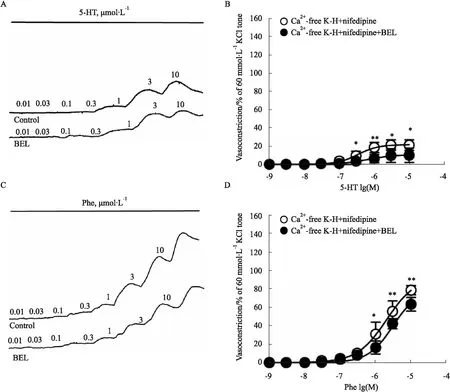
Fig 3 Effects of BEL on 5-HT and Phe-induced sarcoplasmic reticulum calcium release-induced concentration-dependent vasoconstriction of intrarenal arterial rings in mice
3.4 BEL抑制SOC通道诱导的小鼠肾内动脉血管张力在Ca2+-free K-H溶液中加入L型通道阻断剂硝苯地平(1 μmol·L-1)和诱导钙库释放的TG(2 μmol·L-1)孵育后,再加入CaCl2(2.5 mmol·L-1),此时SOC通道诱导肾内动脉血管收缩。在相同处理的另一组加BEL(10 μmol·L-1)孵育,与对照组相比,BEL孵育组SOC通道诱导血管收缩反应低于正常组(n=8,P<0.05)。见Fig 4。
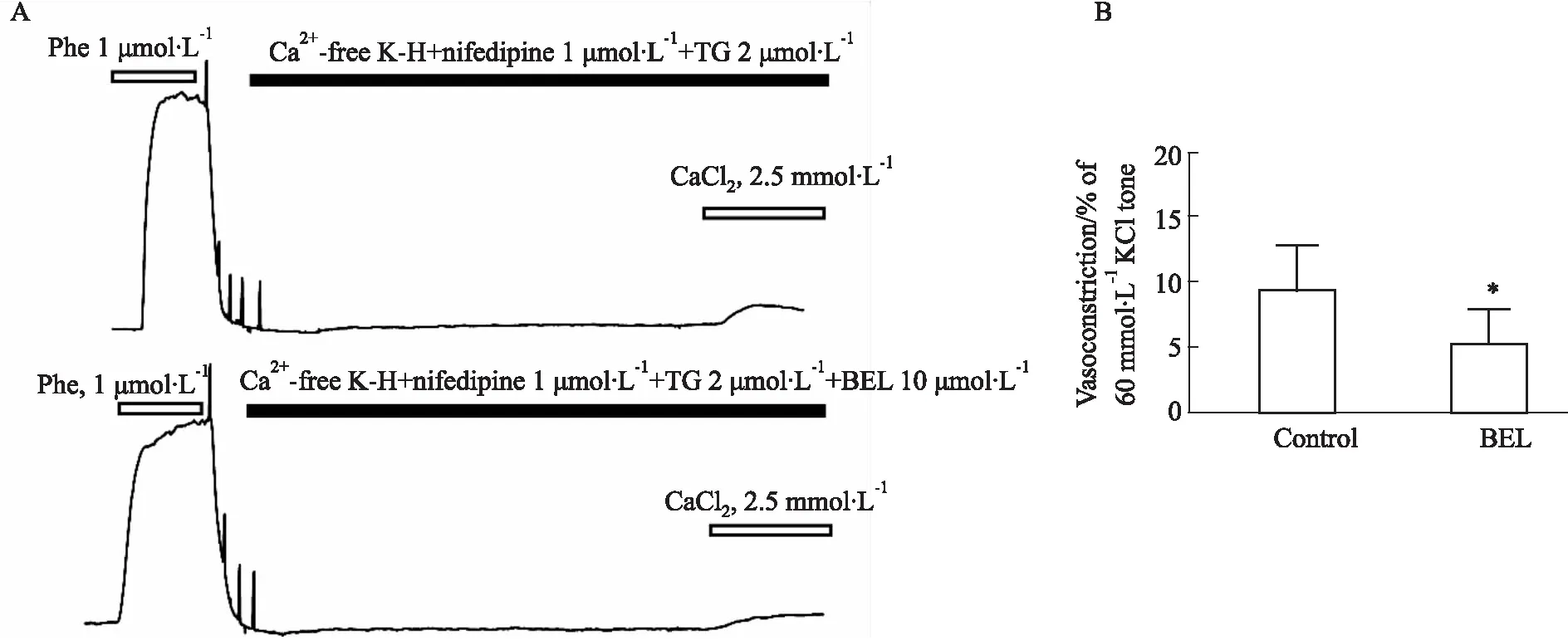
Fig 4 Effect of BEL on SOC channel-induced intrarenal artery vasoconstriction in mice
3.5 BEL抑制ARC通道诱导的钙内流于含钙台式液中,在人主动脉平滑肌细胞株中加L型钙通道阻断剂硝苯地平(1 μmol·L-1)孵育,然后在激光共聚焦显微镜下观察钙离子荧光强度变化情况,在1 min左右加入AA(8 μmol·L-1),荧光逐渐增强,细胞内钙离子浓度上升。相同处理的另一组加BEL(10 μmol·L-1)孵育,发现BEL孵育后,与正常组相比,AA诱导的钙离子荧光强度降低(ncontrol=44,nBEL=21,P<0.01)。见Fig 5。

Fig 5 Effect of BEL on calcium influx induced by ARC channels
4 讨论
血管收缩剂与细胞膜上的受体结合后,细胞内钙([Ca2+]i)增加,可与钙调蛋白结合,激活肌球蛋白轻链激酶,使肌球蛋白磷酸化,从而使平滑肌收缩[11]。[Ca2+]i增加的来源:细胞外Ca2+进入和细胞内Ca2+释放。细胞内Ca2+主要是钙库Ca2+释放,而L型钙通道,SOC及ARC等通道开放可使细胞外Ca2+内流。虽然大量研究已经表明iPLA2被抑制后[Ca2+]i受到影响,但它的具体作用机制仍未知。
本研究发现BEL孵育后肾内动脉血管张力显著降低,这表明BEL抑制血管收缩剂5-HT和Phe引起的肾内动脉血管平滑肌的收缩,已知卤代烯醇内酯与iPLA2的底物缩醛磷脂有结构相似性,可与iPLA2共价结合并不可逆地抑制它,且对其他PLA2作用微弱,BEL在各种iPLA2报道中使用居多[8],提示BEL可能通过抑制iPLA2的作用来抑制肾内动脉血管平滑肌收缩,如何抑制钙通道影响[Ca2+]i增加,接下来进行探讨。
在课题组前期实验中发现,L型钙通道是细胞外钙进入的主要途径,通过无钙高钾K-H溶液处理使血管张力基线平衡后,加入CaCl2,此时参与血管收缩的是L型钙通道[12]。与对照组相比,BEL孵育组的血管张力稍微降低,这表明BEL对L型钙通道也有一定的抑制作用。这与其他报道中,BEL可抑制KCl(60 mmol·L-1)诱导主动脉血管环收缩结果一致,表明iPLA2参与L型钙通道诱导血管收缩反应[13]。
无钙K-H溶液中加入硝苯地平阻断L型钙通道后,此时为肌浆网钙释放引起血管收缩。与对照组相比,BEL孵育后的肌浆网钙释放引起的血管张力明显下降,提示BEL抑制肌浆网钙释放的功能,即iPLA2参与肌浆网钙释放作用。无钙溶液中加入硝苯地平阻断L型钙通道,同时加入TG诱导钙库释放,此时SOC通道打开,细胞外钙内流,引起血管收缩。与对照组相比,BEL孵育后,SOC通道诱导的肾内动脉血管收缩反应下降,表示BEL抑制SOC通道,这与文献报道的结果一致[14],即iPLA2参与调控SOC通道,但报道显示钙库释放耗竭可激活iPLA2活性,从而激活SOC通道。我们实验发现,在抑制iPLA2的活性后,钙库的钙释放功能下降,这表明iPLA2也参与调控钙库的钙释放作用。
由于直接使用AA刺激肾内动脉血管收缩反应微弱,同时课题组的前期研究发现,虽然不同器官的平滑肌细胞具有不同的特征,但与冠脉平滑肌对Phe无反应的现象相反,Phe可诱导大鼠和小鼠肾内动脉与主动脉平滑肌收缩,后被证实大鼠和小鼠冠状动脉平滑肌的SOCE不介导血管收缩,在这一点上,我们认为主动脉平滑肌与肾内动脉平滑肌反应具有相似性,故选用人主动脉平滑肌细胞探索ARC通道的作用[15]。在人主动脉平滑肌细胞株中,加入硝苯地平阻断L型钙通道作用后,在细胞外含钙离子条件下加入AA,此时细胞荧光强度增加,表示细胞外钙进入胞内,此时是AA激活的ARC通道介导细胞外Ca2+内流。在BEL孵育后,细胞的荧光增强,但与未加BEL组对比,其增强幅度明显减弱,这表明BEL对ARC通道具有抑制作用,即iPLA2参与AA激活的不依赖钙库释放的ARC通道作用。
综上所述,本研究在肾内动脉平滑肌中较全面地探讨了iPLA2对钙调控作用,包括:SOC通道、L型钙通道、肌浆网钙释放和ARC通道等。发现iPLA2被抑制后,肌浆网钙释放,SOC通道,ARC通道和L型钙通道的作用均明显减弱,从而使小鼠肾内动脉平滑肌收缩反应降低。iPLA2的生理作用具有器官和组织特异性,与iPLA2在心脏、小动脉内皮细胞和肾脏中报道的保护细胞免受氧化剂诱导的细胞死亡作用不同[7],平滑肌中iPLA2与钙调蛋白相连,在无催化活性状态时,它与钙和钙调蛋白组成三元复合物[16],被激活时参与平滑肌细胞收缩反应,具体的机制有待在肾内动脉平滑肌中进一步探讨。

