基于大肠埃希菌 O157∶H7的荧光定量冻干检测试剂盒的研制
粟元 朱龙佼 曹继娟 刘建龙 许文涛
(1. 中国农业大学营养与健康系 食品精准营养与质量控制教育部重点实验室,北京 100083;2. 大连民族大学,大连 116600;3. 河北伊莱莎生物技术有限公司,涿州 072750)
食品安全问题是对公众健康的重大威胁,微生物污染是导致食源性疾病最主要的因素,食源性疾病给全球医疗、经济和粮食带来巨大负担[1]。大肠埃希菌(Escherichia coli,E.coli),于1885年被德国科学家Theodor Escherich发现,又叫大肠埃希菌、大肠杆菌[2]。根据致病作用,大肠埃希菌主要分为8个种类,即能致胃肠道感染的肠道致病性的、肠道产毒素性的、肠道侵袭性的、肠道出血性的、肠集聚性的的大肠埃希菌以及近年来发现的肠产志贺样毒素同时具有一定侵袭力的大肠埃希菌、致使尿道感染的尿道致病性的大肠埃希菌,以及最新命名的肠道集聚性的黏附大肠埃希菌[3]。大肠埃希菌的毒力因子可以分为4大类,黏附素、肠毒素、强毒力岛、致病性肠细胞脱落位点毒力岛[2-3]。
大肠埃希菌O157∶H7(E. coli O157∶H7)属于肠道出血性大肠埃希菌,其毒力基因主要分为3类,溶血素、志贺毒素(包括志贺毒素1、志贺毒素2)和对上皮细胞的粘附素,进一步,溶血素由hlyA和eaeA基因编码;志贺毒素1、2分别由stx1、stx2编码,这4个基因也是常用于实现检测的基因。
针对大肠埃希菌的检测方法主要分为三大类,传统检测方法、免疫学检测方法和分子生物学检测方法,这些方法虽应用广泛[4],但都存在一些限制。大肠埃希菌的传统检测方法(GB 4789.36-2016)的特点是需要耗时增菌培养、分离、生化鉴定,且需要专业人员操作,受到专业环境限制。免疫学方法[5-6]是依赖于抗原和抗体之间的特定组合,其种类多样,可分为酶联免疫吸附技术、免疫荧光技术、免疫印迹技术、免疫磁珠分离技术、酶联荧光免疫分析技术、免疫层析技术。免疫学方法虽检测效率高、特异性强、实现了免提取、免培养的目标,但成本较高,也需要特定环境进行操作。分子生物学技术[7]的发展,给大肠埃希菌的检测提供了更多可供选择的方法,主要分为变温扩增技术[8]、恒温扩增技术[9]和生物传感器[10-11]等。其中,1993 年发展起来的实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,qPCR)技术应用广泛[12],根据荧光信号基团的不同,qPCR可以分为染料法和探针法。针对TaqMan探针,其5′端标记荧光报告基团,3′端标记荧光淬灭基团[51],当荧光基团和淬灭基团相互靠近时,阻止了荧光基团发出荧光;当引物延伸至寡核苷酸结合位置时,Taq酶可以将其切割成小片段,使报告基团和淬灭基团分开并发出荧光[12]。
真空冷冻干燥技术,简称冻干技术,其原理是将溶液凝固后,在真空状态下将凝固的溶剂升华,再由解吸干燥除去剩余水分的技术,一般分为3个阶段,即预冻、升华、干燥[13]。其具有诸多优点,一是低温低氧不易损伤变性、二是冻干过程中保持原有结构、三是重量轻且易于储存和运输、四是复水后基本保持原有性状。冻干技术也具有不容忽视的劣势,其会使检测试剂组分形成冰晶,对其造成严重损伤,会加速样品水分流失,从而降低生物活性[14-15]。因此,为了尽可能减小冷冻干燥过程对检测试剂组分的损伤,延长保藏期,选择合适的保护剂至关重要。冻干保护剂是指样品在冻干过程能够对样品进行保护,使其免受损伤的物质,其种类多样,按照化学结构可分为6类,即糖类、氨基酸类、盐类、聚合物类、糖脂类和多元醇类,其功能也有所不同[16-18],如表1所示。
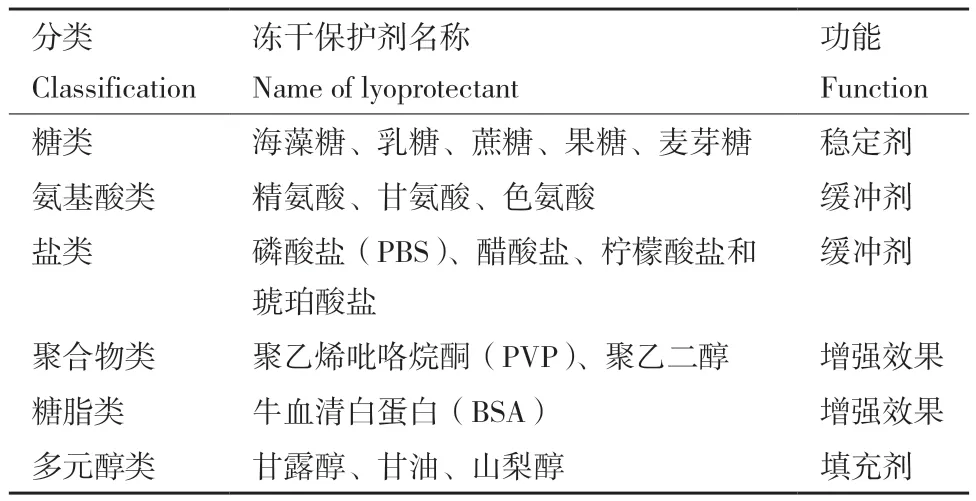
表1 冻干保护剂的分类Table 1 Classification of the lyoprotectant[16]
目前,部分公司开发了部分E. coli O157∶H7的qPCR检测试剂盒,如广东华银医药科技有限公司、北京百奥莱博科技有限公司、上海康朗生物科技有限公司、江苏科晶生物科技有限公司等,但未进行冻干,市场上存在小部分E. coli O157∶H7的荧光定量冻干检测试剂盒,国产的如广州华峰生物科技有限公司(八连排冻干),进口的如赛默飞世尔科技(96孔板冻干),两家冻干试剂中均含有特异性引物和探针,总体而言,市场上缺少本研究6种食源性致病菌的荧光定量冻干检测试剂盒,对于第三方检测机构和许多企业等,这成为迫切的需要。
本文结合qPCR技术和冻干技术,研制了一种既实现精准定量,也便于储存运输的快速检测试剂盒,用于简单、灵敏、特异鉴定E. coli O157∶H7。首先,该技术针对大肠埃希菌的eaeA基因设计引物,该设计包括一条正向引物、一条反向引物和一条荧光探针,荧光探针分别修饰FAM荧光基团和TAMRA淬灭基团;其次,通过4种成分组成的复合冻干保护剂和qPCR体系混合冻干后组装成荧光定量冻干检测试剂盒,克服了常用商品化扩增试剂盒需冷藏运输和冷冻储存的缺点,节约了冷链运输的成本,且减少了加样过程中的气溶胶污染。所提出的方法可在45 min内检测到2.1 copies/μL的E. coli O157∶H7,其检测效果优,灵敏度高,且特异性强。
1 材料与方法
1.1 材料
本研究涉及的DNA序列在上海生工生物技术有限公司(生工生物,中国上海)合成;E. coli O157∶H7 BNCC192101、鼠伤寒沙门氏菌、副溶血弧菌、单核增生李斯特菌、金黄色葡萄球菌、阪崎肠杆菌由中国农业大学农业部转基因生物安全评价(食品)重点实验室提供;超纯水是从Millipore MilliXQ系统(美国贝德福德)获得的,用于溶解引物等;rTaq酶、PCR缓冲液(10×)、dNTPs(10 mmol/L)是从TaKaRa(中国北京)购买的。细菌基因组DNA提取试剂盒是从天根(中国北京)生化科技有限公司购买的;PerfectStartTMIIProbe qPCR SuperMix是从北京全式金生物技术有限公司购买的;月桂基硫酸盐胰蛋白胨(LST)肉汤是从青岛高科技工业园海博生物技术有限公司购买的。
1.2 方法
1.2.1 菌株培养E. coli O157∶H7的培养 将50 μL E. coli O157∶H7、大肠埃希菌ATCC 25922、肠集聚性大肠埃希CICC 24186、肠产毒性大肠埃希菌CICC 10667、肠侵袭性大肠埃希菌CICC 10662加入LST液体培养基中,在(36±1)℃下以200 r/min的速度摇晃,时间为18 h-24 h。阪崎肠杆菌的培养:按照国标(GB4789.40-2016)增菌步骤进行培养。
1.2.2 基因组提取 按照细菌基因组DNA提取试剂盒说明书步骤进行操作。提取完基因组DNA,利用琼脂糖凝胶电泳鉴定完整性。具体方法:在 5 μL 样品中加入 1 μL 6×Loading buffer,在2%琼脂糖凝胶上进行点样,电泳仪的电压为 120 V,电泳时间为30 min。
1.2.3 基因组验证及模板量测定 提取DNA后,利用两条细菌16S rDNA引物对提取的E. coli O157∶H7的基因组进行PCR扩增,16S rDNA 引物如表2所示,PCR反应体系总体积为25 μL:0.5 μmol/L F1和R1,1×PCR反应缓冲液,0.8 mmol/L dNTPs,0.06 U rTaq DNA聚合酶和DNA。反应体系在95℃下预变性5 min,然后在95℃下变性10 s,在55℃下退火30 s,在72℃下延伸10 s,经过35个循环。测定基因组浓度,并根据以下拷贝数计算公式计算拷贝数:(6.02×1023copies/mol)×(浓度g/mL)/(MW g/mol)。
1.2.4 引物设计 E. coli O157∶H7的特异性引物设计是根据NCBI数据库中的大肠埃希菌eaeA基因序列(GenBank 登录号 U38618.1),使用 Primer 5.0 软件 和 Integrated DNA Technologies(IDT) 设 计 PCR反应的引物及探针(表2)。
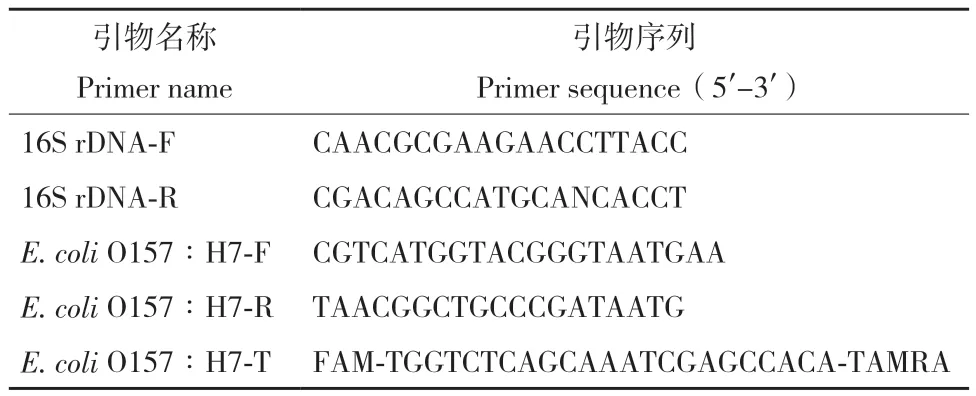
表2 qPCR引物序列Table 2 Primers’ sequences of qPCR
1.2.5 qPCR体系的建立及优化 初步建立的qPCR扩增体系如下:20 μL反应体系:PerfectStartTMII Probe qPCR SuperMix(2×),1× ;E. coli O157∶H7-F(10 μmol/L),0.3 μmol/L ;E. coli O157∶H7-R(10 μmol/L),0.3 μmol/L ;E. coli O157∶H7-P(10 μmol/L),0.3 μmol/L ;DNA 模 板,1 μL ;ROX(50×),1× ;ddH2O,6.8 μL。qPCR 系统运行体系(ABI Step One Plus):95℃,5 min;循环开始,95℃,10 s;60℃,30 s;72℃,30 s,共40个循环,每40 s记录一次荧光信号。阴性对照:阪崎肠杆菌DNA代替模板DNA,其它反应条件不变。空白对照:RNase-free水代替模板DNA,其它反应条件不变;在初步建立的体系基础上,优化引物F、R 的浓度。浓度分别为:0.2 μmol/L、0.4 μmol/L、0.6 μmol/L、0.8 μmol/L 和 1.2 μmol/L ;接着,优化引物与探针的比例,其比例分别为3∶1、2∶1、1∶1、1∶2、1∶3。即E. coli O157∶H7的探针的浓度分别为 0.13 μmol/L、0.2 μmol/L、0.4μmol/L、0.8 μmol/L、1.2 μmol/L。各实验组3个平行,qPCR系统运行体系(ABI Step One Plus):95℃,5 min;循环开始,95℃,10 s;60℃,30 s;72℃,30 s共40个循环,每40 s记录一次荧光信号,测定荧光曲线,并通过2%琼脂糖凝胶进行电泳;最后,优化退火温度,分别为50、53、56、59、62、65℃。qPCR系统运行体系(ABI Step One Plus):95℃,5 min;循环开始,95℃,10 s;50、53、56、59、62、65℃,30 s;72℃,30 s, 共40个循环,每40 s记录一次荧光信号,测定荧光曲线,并通过2%琼脂糖凝胶进行电泳。
1.2.6 qPCR体系的灵敏度及特异性分析 分别对E. coli O157∶H7基因组连续进行10倍梯度稀释,以稀释后的基因组作为模板,稀释至8个不同的浓度水平,即 2.1×108copies/μL、2.1×107copies/μL、2.1×106copies/μL、2.1×105copies/μL、2.1×104copies/μL、2.1×103copies/μL、2.1×102copies/μL、2.1×101copies/μL,在各自最优的反应条件下,分别进行qPCR扩增。用RNase-free水代替模板,设立空白对照。针对E. coli O157∶H7,提取大肠埃希菌ATCC 25922、肠集聚性大肠埃希CICC 24186、肠产毒性大肠埃希菌CICC 10667、肠侵袭性大肠埃希菌CICC 10662的基因组,分别作为qPCR扩增的模板,按照最优体系进行扩增,验证qPCR扩增体系的特异性,每种靶标3个平行,用RNase-free水代替模板,设立空白对照。
1.2.7 冻干保护剂对qPCR扩增的影响 通过前期预实验,选取4种常用的冻干保护剂,分别是海藻糖、PBS、BSA和甘露醇。基于qPCR最优扩增体系,研究海藻糖、PBS、BSA、甘露醇对qPCR扩增的影响。其他反应条件不变,海藻糖在20 μL qPCR扩增反应体系中的终浓度(质量体积分数)分别为1.5%、3.5%、5.5%、7.5%、9.5%;PBS分别为0.1×、0.2×、0.3×、0.4×、0.5×;BSA分别为0.2%、0.4%、0.6%、0.8%、1.0%;甘露醇分别为0.2%、0.4%、0.6%、0.8%、1.0%,从而优化出海藻糖、PBS、BSA和甘露醇不会对qPCR产生抑制作用的最优浓度C1。
1.2.8 冻干保护剂保护作用浓度的确定 基于1.2.7的结果,研究海藻糖、PBS、BSA和甘露醇的冻干保护作用。其他反应条件不变,海藻糖在20 μL qPCR扩增反应体系中的终浓度分别为4.5%、5.5%、6.5%、7.5%、8.5%;PBS分别为0.2×、0.3×、0.4×、0.5×、0.6×;BSA分别为0.6%、0.9%、1.2%、1.5%、1.8%;甘露醇分别为0.15%、0.25%、0.35%、0.45%、0.55%,从而优化出海藻糖、PBS、BSA和甘露醇的最优冻干保护作用质量浓度C2。
1.2.9 荧光定量冻干检测试剂盒的建立 通过试剂盒检测E. coli O157∶H7,添加19 μL水将qPCR扩增混合冻干样品加复水,向各 PCR 管中加入1 μL靶标DNA,同时设立未冻干扩增试剂和未添加冻干保护剂的冻干扩增试剂为对照,进行qPCR扩增,反应结束后,观察qPCR扩增曲线的平滑度、Ct值、荧光强度。
1.2.10 荧光定量冻干检测试剂盒的稳定性 将荧光定量冻干检测试剂盒置于常温储存15 d、1个月、2个月,定期取试剂盒进行qPCR扩增,考察不同时间储存后的检测性能,同时设立未冻干样品为阴性对照,反应结束后,观察qPCR扩增曲线的平滑度、Ct值、荧光强度。
1.2.11 荧光定量冻干检测试剂盒的重复性 研究批内变异系数的方法是在同一时间研制3个荧光定量冻干检测试剂盒置于常温储存,取试剂盒进行qPCR扩增,每个试剂盒3个平行;研究批间变异系的方法是在不同时间分别研制3个荧光定量冻干检测试剂盒置于常温储存,取试剂盒进行qPCR扩增,每个试剂盒3个平行,反应结束后,观察qPCR扩增曲线的平滑度、Ct值、荧光强度。
1.2.12 实际样品的检测 选购超市市售冷鲜牛肉1份、冷鲜猪肉1份、冷鲜鸡肉1份样品,无菌称取25 g放入盛有225 mL磷酸盐缓冲液的无菌均质杯做成1∶10、1∶1 00、1∶1 000样品匀液。分别取上述3种稀释度样液1 mL接种3管月桂基硫酸盐胰蛋白胨肉汤,置(36±1)℃ 恒温箱内培养48 h。接着,按照细菌基因组DNA提取试剂盒说明书步骤进行DNA提取,最后利用所研制的E. coli O157∶H7荧光定量冻干检测试剂盒对其进行检测。同时,用接种环取48 h后的培养液分别划线接种于伊红美蓝平板,(36±1)℃培养 18 h-24 h。
2 结果
2.1 基因组的提取及验证
如图1-A所示,提取的E. coli O157∶H7的基因组通过2%琼脂糖凝胶进行电泳,获得完整的DNA,提取的DNA条带亮,说明浓度合格;没有拖尾严重的现象,说明长度没有断裂;无杂带,说明没有RNA污染。如图1-B所示,用两条细菌16S rDNA引物对E. coli O157∶H7基因组进行PCR扩增,获得90 bp的目的条带,且无其他杂条带。

图1 琼脂糖凝胶电泳图Fig. 1 Agarose gel electrophoresis image
2.2 qPCR体系的优化
2.2.1 引物F、R的浓度优化 图2是引物F、R的浓度优化结果,如图所示,随着引物F、R浓度增高,Ct值没有一定的规律(图2-C),荧光强度逐渐增大(图2-A)。当引物F、R浓度为0.2 μmol/L时,Ct值最小,但荧光强度最低,当引物F、R浓度为0.4 μmol/L时,Ct值增加少,且荧光强度明显提升,当引物F、R浓度大于0.4 μmol/L后,Ct值逐渐增大,且扩增曲线不是很平滑。电泳图(图2-B)中,当引物F、R浓度在0.4 μmol/L后,扩增条带亮度无明显变化,当引物F、R浓度为1.0 μmol/L时,阴性对照和空白对照出现了假阳性。因此,定量图与电泳图结果一致,但qPCR比传统电泳图更加灵敏。综合考虑,引物F、R最适浓度为0.4 μmol/L。
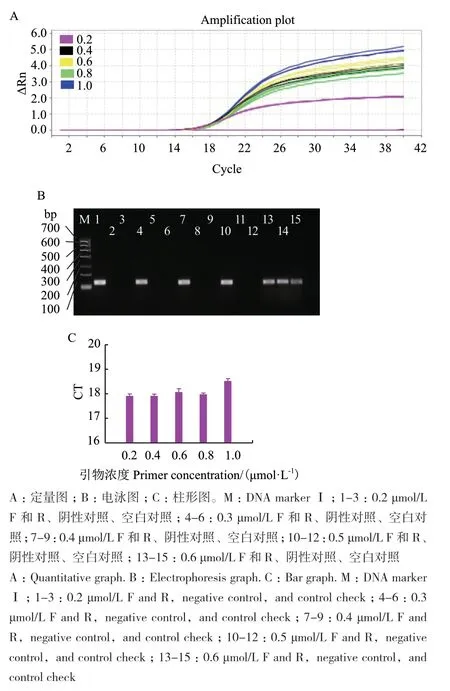
图2 大肠埃希菌O157∶H7引物 F、R 的浓度优化Fig. 2 Concentration optimization of F and R of E. coli O157:H7
2.2.2 引物与探针的比例优化 图3是引物与探针的比例优化结果,如图所示,当引物与探针的比例逐渐减小,Ct值逐渐减小(图3-C),当引物与探针的比例小于3∶1后,荧光强度逐渐增强,当引物与探针的比例为1∶3时,Ct值最小,但扩增曲线不平滑,出现了严重曲折,且重复性不佳,当引物与探针的比例为1∶1时,Ct值较小,且荧光强度高。电泳图(图3-B)中,引物与探针的比例为1∶1时,条带最亮,当引物与探针的比例为1∶2和1∶3时,阴性对照和空白对照出现了假阳性。因此,定量图与电泳图结果一致,但qPCR比传统电泳图更加灵敏。综合考虑,引物与探针的最适比例为1∶1,即探针的最适浓度为0.4 μmol/L。
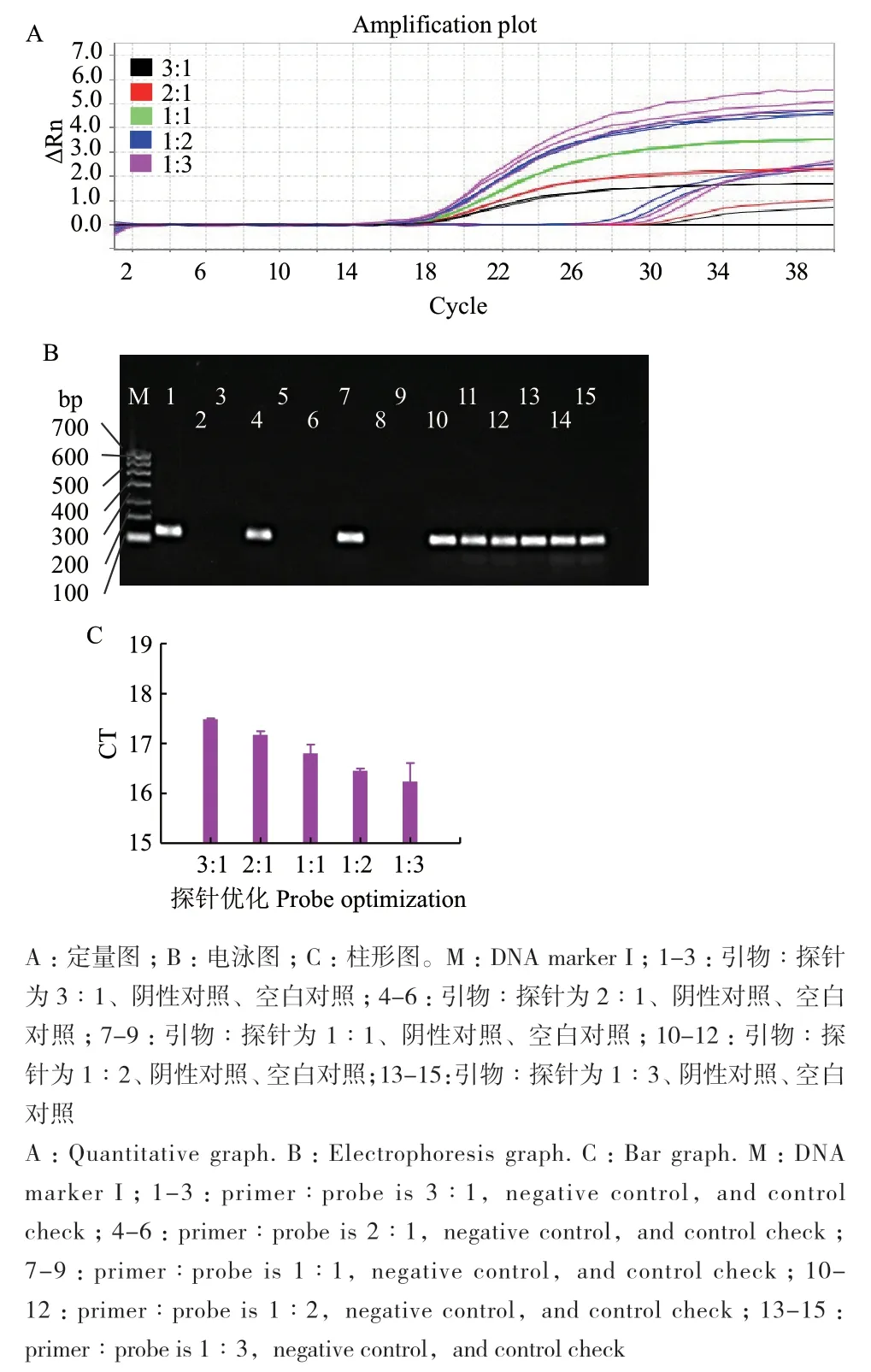
图3 大肠埃希菌O157∶H7的引物与探针的比例优化Fig. 3 Optimization of the ratios of primers to probes of E.coli O157∶H7
2.2.3 退火温度的优化 图4是退火温度的优化结果,如图所示,当退火温度逐渐增大时,荧光强度逐渐减弱(图4-A),当退火温度为50℃时,Ct值最小(图4-C),但曲线不平滑,当退火温度为53℃时,Ct值较50℃时相差不大,当退火温度大于59℃时,抑制了扩增,图4-B中,条带无明显变化。因此,定量图与电泳图结果一致,但qPCR比传统电泳图更加灵敏。综合考虑,最适退火温度为53℃。
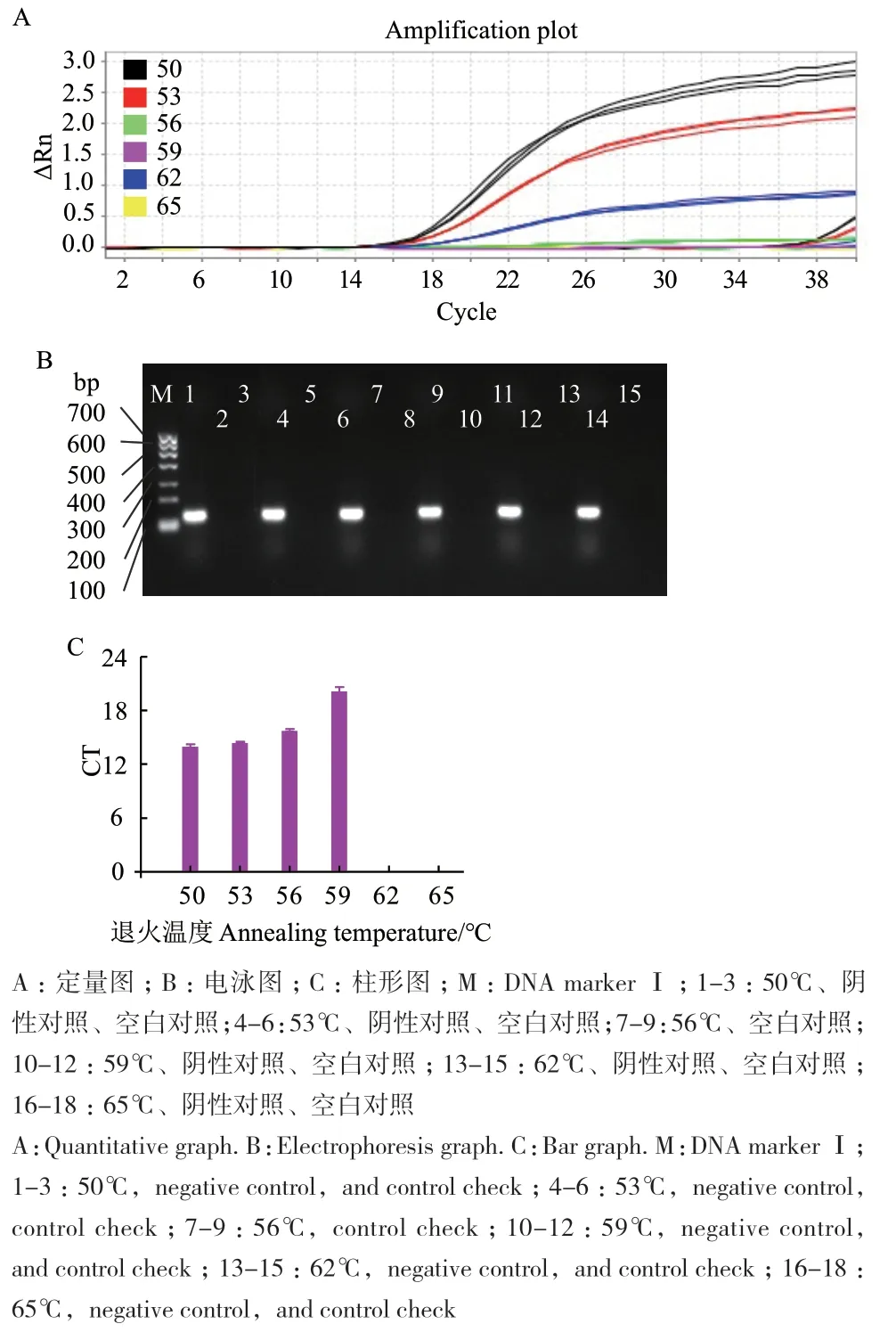
图4 大肠埃希菌O157∶H7的退火温度优化Fig. 4 Optimization of annealing temperature for E. coli O157∶H7
2.3 灵敏度和特异性
根据实验得到的最优反应体系和反应条件,进行qPCR检测方法的灵敏度分析。图5是E. coli O157∶H7的灵敏度分析结果,如图所示,Ct值随着大肠埃希菌浓度的减小而逐渐增大,且在2.1×108- 2.1×102copies/μL的浓度范围内呈良好线性关系,其回归方程为Y = -3.194 8 lgX+41.766(R2= 0.995 9),其检测限为2.1 copies/μL。因此,说明建立的qPCR检测方法具有较低的检测限和较宽的检测范围,呈现较高的灵敏度。
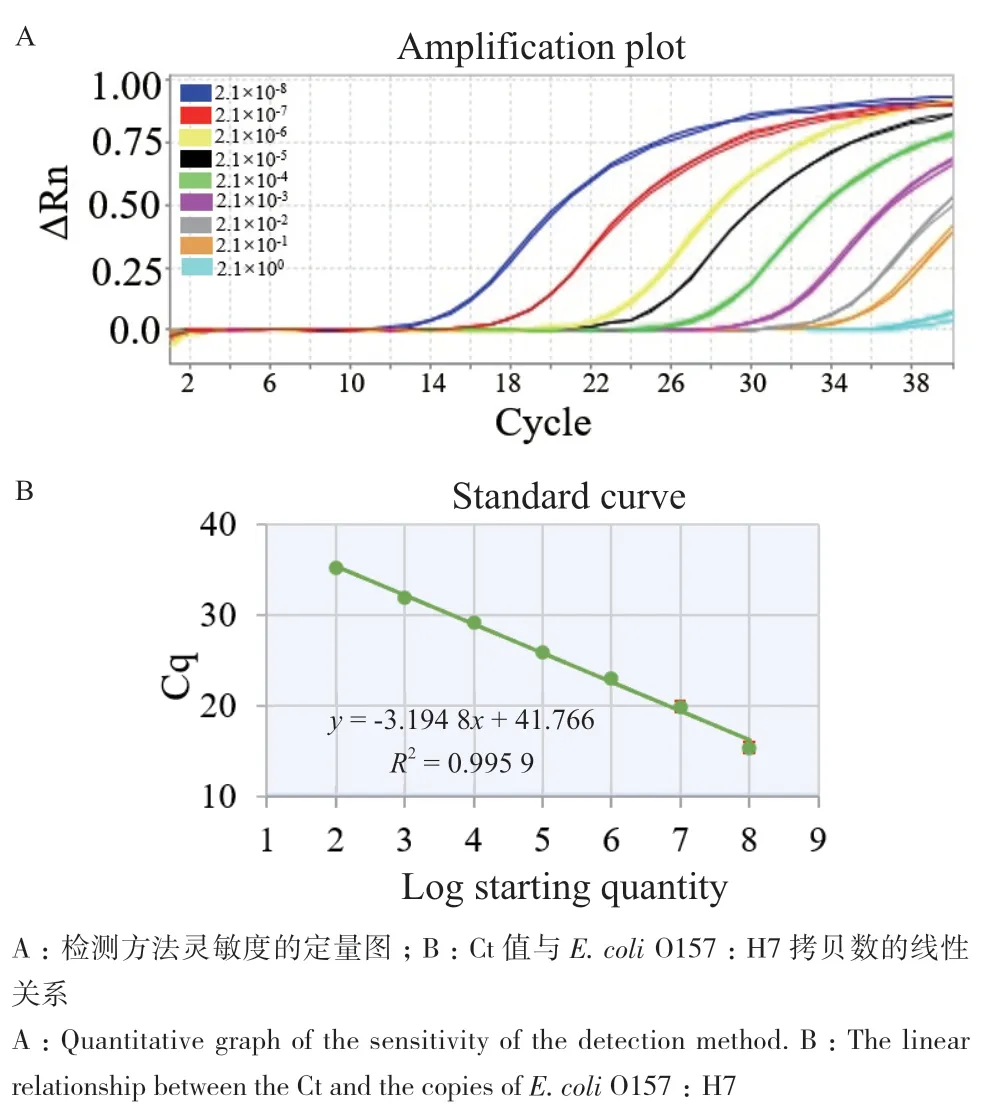
图5 建立的大肠埃希菌O157:H7检测方法的灵敏度Fig. 5 Sensitivity of the established E. coli O157:H7 detection method
根据实验得到的最优反应体系和反应条件,进行qPCR检测方法的特异性分析。图6是大肠埃希菌的特异性分析结果,如图所示,E. coli O157∶H7扩增曲线的Ct值明显小于其他菌种,且扩增曲线平滑、荧光强度最强,而其余菌种扩增曲线拐点已不清楚或没有扩增,说明构建qPCR检测方法对大肠埃希菌检测具有较好的特异性。
2.4 冻干保护剂对qPCR扩增的影响
图7-A、B是海藻糖对E. coli O157∶H7 qPCR扩增的影响,当最终质量浓度为5.5%时,Ct值最小,且扩增曲线荧光强度最强,当最终质量浓度为其余值时,Ct值增大,扩增曲线荧光强度减弱,重复性差。图7-C、D是PBS对E. coli O157∶H7 qPCR扩增的影响,当最终质量浓度为0.2×时,Ct值最小,当最终质量浓度为0.1×时,Ct值增大,当最终质量浓度大于0.3×后,Ct值增大,扩增曲线荧光强度减弱或完全抑制了扩增。图7-E、F是BSA对E.coli O157∶H7 qPCR扩增的影响,当最终质量浓度为0.6%时,Ct值最小。当最终质量浓度为其余值时,Ct增大,扩增曲线荧光减弱或重复性不佳。图7-G、H是甘露醇对E. coli O157∶H7 qPCR扩增的影响,如图所示,甘露醇对扩增的影响很明显,当最终质量浓度为0.2%时,Ct值最小,扩增曲线荧光强度最强,当最终质量浓度为其余值时,扩增曲线拐点已不清楚且荧光减弱
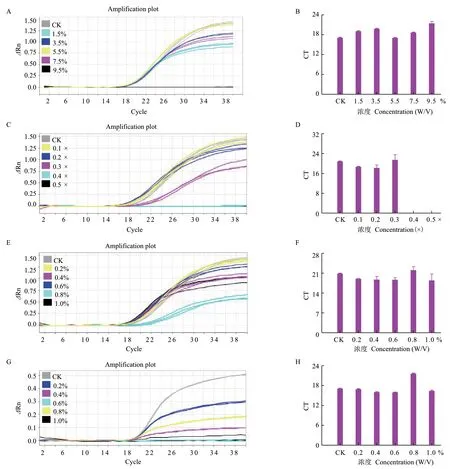
图7 冻干保护剂对 qPCR 扩增的影响Fig. 7 Effect of lyoprotectant on qPCR amplification
2.5 冻干保护剂保护作用浓度的确定
图8-A、B是海藻糖的冻干保护作用结果,当最终质量浓度为4.5%、5.5%、8.5%时,Ct值相当,扩增曲线荧光强度4.5%和5.5%较强,当最终质量浓度为其余值时,Ct值增大,扩增曲线荧光强度减弱或扩增曲线拐点已不清楚。图8-C、D是PBS的冻干保护作用结果,当最终质量浓度为0.2×时,Ct值最小,扩增曲线荧光强度最强,当最终质量浓度为0.3×时,Ct值增大,当最终质量浓度为其余值时,扩增曲线拐点已不清楚或完全抑制扩增。图8-E、F是BSA的冻干保护作用结果,当最终质量浓度为0.6%、0.9%时,Ct值和扩增曲线荧光强度相当,当最终质量浓度其余值时,扩增曲线荧光强度减弱或拐点已不清楚。图8-G、H是甘露醇的冻干保护作用结果,如图所示,当最终质量浓度为0.25%时,Ct值最小,扩增曲线荧光强度最强,当最终质量浓度为其余值时,扩增曲线拐点已不清楚且荧光强度减弱。
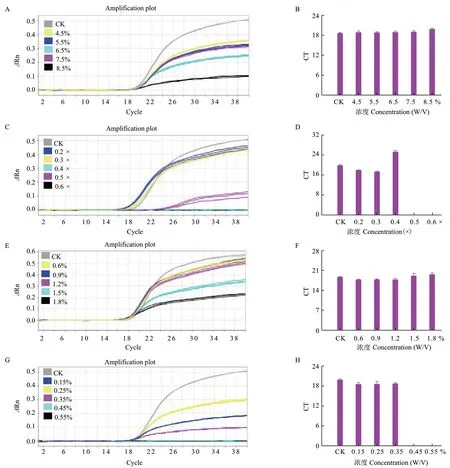
图8 冻干保护剂对 qPCR 体系的冻干保护作用Fig. 8 Freeze-drying protective effect of lyoprotectant on qPCR system
2.6 荧光定量冻干检测试剂盒的建立
基于此,冻干保护剂由5.5%海藻糖、0.2×PBS、0.6%BSA、0.25%甘露醇组成,并与qPCR体系组成试剂盒。图9-A是利用试剂盒检测E. coli O157∶H7的扩增曲线图,如图所示,当通过试剂盒检测时,实验组Ct值较小、有平缓的扩增曲线、扩增曲线荧光强度较强,与未冻干扩增试剂对照组的扩增曲线几乎重合,而未添加冻干保护剂的冻干扩增试剂的Ct值较大或扩增曲线拐点已不清楚或无扩增曲线,图9-B是由海藻糖、PBS、BSA、甘露醇组成的复合冻干保护剂与qPCR体系混合冻干后的形态,1是无冻干保护剂冻干的样品,其几乎没有形状,2是无甘露醇的复合冻干保护剂体系冻干的样品,其呈透明状,在反应管上有粘附。3是试剂盒中的样品,其呈白色海绵状,有效物质较为紧密,管壁上没有粘附。
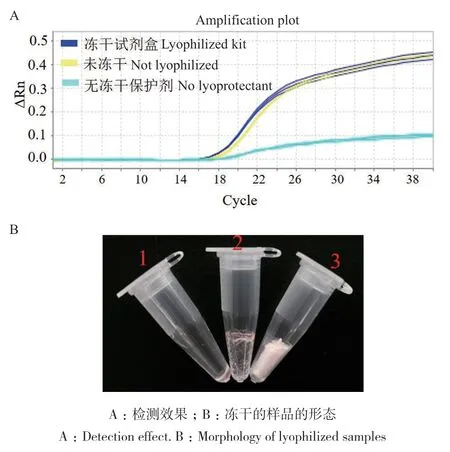
图9 荧光定量冻干检测试剂盒的建立Fig. 9 Establishment of the fluorescent quantitative lyophilized detection kit
2.7 荧光定量冻干检测试剂盒的重复性
图10-A是利用同一时间研制的3个E. coli O157∶H7荧光定量冻干检测试剂盒检测E. coli O157∶H7的检测效果,每个试剂盒分别3个平行,如图所示,荧光曲线几乎重合,3个荧光定量冻干检测试剂盒的Ct平均值分别为17.596、17.917、17.937,批内变异系数分别为0.26%、0.51%、0.3%;图10-B利用不同时间研制的3个荧光定量冻干检测试剂盒检测E. coli O157∶H7的检测效果,如图所示,荧光曲线几乎重合,3个荧光定量冻干检测试剂盒的Ct平均值分别为17.85、17.63、17.957,批间变异系数分别为0.39%、0.49%、0.093%。
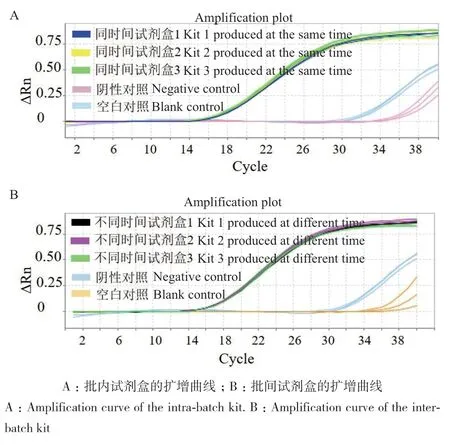
图10 荧光定量冻干检测试剂盒的重复性Fig. 10 Reproducibility of the fluorescence quantitative lyophilized detection kit
2.8 荧光定量冻干检测试剂盒的稳定性
图11是E. coli O157∶H7荧光定量冻干检测试剂盒在常温下放置2个月、4个月、半年后的检测效果,如图所示,放置3个时间段的试剂盒的扩增曲线几乎重合,因此,荧光定量冻干检测试剂盒稳定性高,储存期长。特别注意,由于空气中含有水分等可能影响冻干试剂保存效果的成分,为了使其复溶后能够达到使用目的,同时为了防止冻干试剂的形态因吸水而塌陷,使用前需要将其进行密封保存,储存环境须满足干燥、清洁、不易受到外界污染等条件。
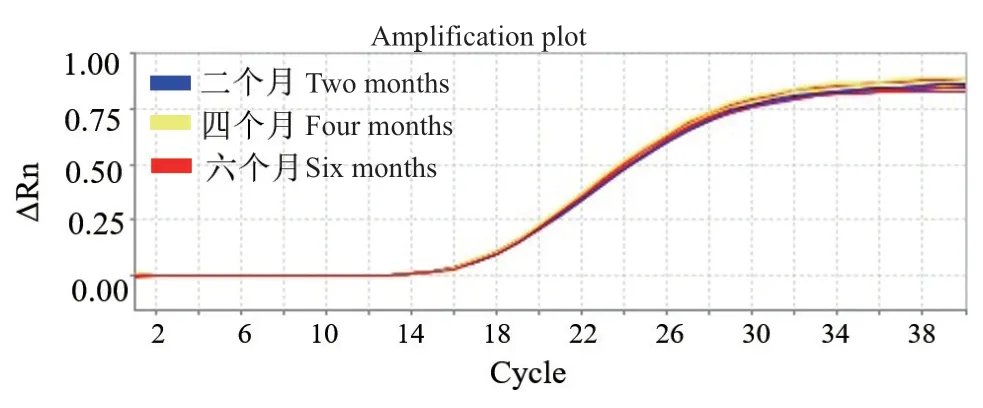
图11 荧光定量冻干检测试剂盒的检测效果Fig. 11 Detection effect of the fluorescence quantitative lyophilized detection kit
2.9 实际样品的检测
利用所研制的E. coli O157∶H7荧光定量冻干检测试剂盒分别对生牛肉、生猪肉和生鸡肉进行检测,如图12-A所示,扩增曲线无明显Ct值。同时,利用国标法进行对比,如图12-B所示,伊红美蓝平板上无黑色中心典型菌落,两种方法都表明3种实际样品均未检测出E. coli O157∶H7。
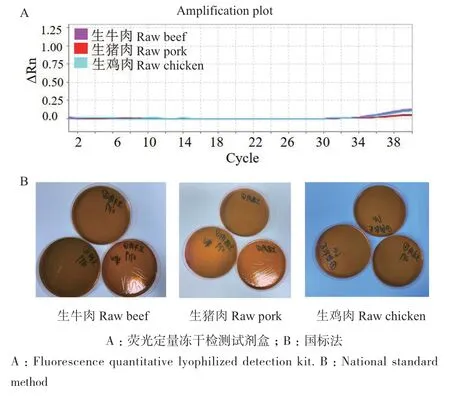
图12 实际样品的检测Fig. 12 Detection of actual samples
3 讨论
大肠埃希菌种分类较多,毒素不同,毒力因子不同,对应菌株分析特异性基因是扩增成功的决定性因素。随着qPCR技术的不断发展,国内外已有许多研究报道了针对大肠埃希菌的qPCR方法,靶标菌的特异性基因不尽相同。针对大肠埃希菌,常用的靶基因主要有rfbE、eaeA、stx1、stx2、uidA等[19-21]。qPCR体系反应条件优化对于扩增是必要的,引物浓度、引物与探针的比例、退火温度对避免扩增曲线荧光强度弱、避免引物二聚体、避免低灵敏度具有决定性作用。引物浓度低影响扩增曲线荧光强度,引物浓度过高影响特异性[7],探针浓度高影响扩增曲线平滑度和扩增特异性,退火温度过高或导致模板和引物结合不牢固,过低则容易产生非特异性扩增。Ibekwe等[8]所建立的qPCR检测方法其检测限为3.5×103CFU/mL;王建昌等[22]所建立的qPCR检测方法其检测限为103CFU/mL;柯振华等[23]采用多重实时荧光PCR技术检测靶标致病菌,对于E.coli O157∶H7的检测限为103CFU/mL。
对于冻干保护剂体系,首先要考虑到qPCR扩增是微体系扩增,加入的组分可能对扩增会有影响,因此,冻干保护剂首先要满足不对扩增产生任何抑制作用的要求,每种冻干保护剂的浓度对扩增曲线荧光强度和Ct值具有较大的影响,有的还影响扩增曲线的平滑度。另外,在冻干过程中主要发挥保护作用,每种冻干保护剂的最适浓度对冻干和扩增都很重要[16,24]。冻干保护剂种类较多,其化学结构不同,实现的功能也不同,海藻糖作为稳定剂,是目前应用最广泛的糖类保护剂,磷酸盐作为缓冲剂,BSA具有较高的玻璃化转变温度,甘露醇作为填充剂,复合保护剂能够更全面地对qPCR扩增试剂进行保护,且能够保持理想的外观,其是冻干试剂包装、运输和储存的基本要求[25]。在冻干过程中,预冻是不可忽视的,应注意要避光冻干,冻干机上方应用黑色的避光材料遮挡。储存试剂盒时,也应注意避光。对于冻干保护剂影响扩增曲线荧光强度和Ct值的机制[13,16],目前尚不清楚,需要在后续研究中进一步探讨。
我们所构建的荧光定量冻干检测试剂盒便于常温储存、常温运输,其检测限可低至2.1 copies/μL,并且在特异性检测中,也体现了良好的选择性。因此,实验结果证明该检测方法在对E.coli O157∶H7检测时体现了较高的灵敏度和特异性,体现了本检测方法的可靠性。
4 结论
本文研制了一种针对E.coli O157∶H7的荧光定量冻干检测试剂盒。本研究所提出的方法具有以下两个优势:(1)灵敏度高特异性强。对E.coli O157∶H7的eaeA基因进行特异性引物设计,建立了qPCR最优扩增体系,其检测灵敏度高,检测限为2.1 copies/μL,且特异性强。(2)试剂盒便于常温储存及运输。

