光照和温度对麦可属生长动力学的影响
李俊鹏,潘伟斌,2*,黄晓佳
光照和温度对麦可属生长动力学的影响
李俊鹏1,潘伟斌1,2*,黄晓佳1
1. 华南理工大学环境与能源学院, 广东 广州 510006 2. 工业聚集区污染控制与生态修复教育部重点实验室, 广东 广州 510006
本文以麦可属()为研究对象,研究其在不同温度、光照强度下的生长特性,基于Lehman模型、Steele模型,建立麦可属的光温模型。结果表明:当温度恒定时,麦可属生长的最佳光照强度为3 000 lx;当光照恒定,麦可属生长的最佳温度为20 ℃。光照、温度协同作用下,麦可属对光热条件的变化呈单峰响应,麦可属的最佳生长温度为20.4 ℃,最佳生长光照强度为3 203 lx,最大比生长速率可达0.426 d-1。合适的光照和温度是麦可属水华形成的重要因素,光温模型可以为麦可属水华预警提供依据。
麦可属; 光照; 温度; 生长动力学
超微型浮游植物(Picophytoplankton,≤ 3 μm)广泛分布于水生态系统中,其比表面积大、碳同化效率高,在湖、库等水体的初级生产力占比可达90%[1]。但由于超微藻尺寸较小,形态特征简单,描述和鉴定困难,超微藻水华常常被忽略,随着流式细胞技术、分子生物学技术的广泛应用,超微藻水华逐渐受到关注[2,3]。
麦可属()是典型的超微真核浮游植物,广泛分布于富营养湖泊、河流中,能适应复杂多变的环境,有报道在长江梅溪河、鄱阳湖、巢湖、东山湖等水体均出现麦可属水华[4-6]。Shi等报道,麦可属是鄱阳湖的优势浮游植物,其能适应高浊度、弱光照的环境,能适应广泛的营养环境,麦可属占绝对优势地位是导致鄱阳湖浮游植物多样性低的主要原因[6]。
光热条件等环境因素是影响浮游植物生长的主要条件。Liu C等研究了氮磷比对微胞藻、麦可属、聚球藻间竞争关系的影响[4]。Saadaoui I等筛选具有高生长速率的微藻,发现麦可属具有较高的生长速率和抗氧化能力,在光照为100 μmol·s-1·m-1,温度为30 ℃时,其比生长速率可以达到0.6 d-1[7]。Liu C等对巢湖中分离的麦可属进行基因组分析,揭示了麦可属能适应低营养水平、高浊度、低温环境的机制[8]。但目前麦可属在温度、光照等因素协同作用下的生长动力学研究还未见报道,麦可属对温度、光照等环境因素的响应特征尚不明晰。本研究在不同的光照、温度梯度下模拟培养环境,基于Lehman模型和Steele模型,建立麦可属对光热条件的生长动力学模型,以期为预测麦可属的生长动态过程及麦可属水华形成提供依据。
1 材料与方法
1.1 材料
麦可属(FACHB-2057,)购自中国科学院淡水藻种库。
1.2 麦可属培养
麦可属采用BG11培养基培育备用,培养温度为25 ℃,光照强度约为2 000 lx。实验所用玻璃器皿均经过10% HCl浸泡过夜,所用培养基和玻璃器皿均经过高压蒸汽灭菌,且操作过程处于无菌环境。
麦可属动力学实验采用分批培养实验,各批次实验的光照、温度设置如表1。麦可属样品培养在500 mL锥形瓶中,接种密度约为5×105cells·L-1,每个样品设置两个平行样,每日定时摇动锥形瓶,每日定时取样计数计算藻密度。相对于培养基总体积,样品量较少,因此可以近似认为取样过程不影响培养基的供应和藻类的生长。
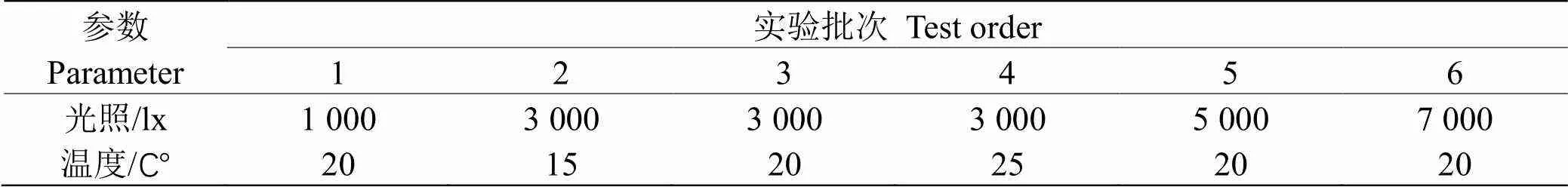
表 1 实验参数梯度设置
比生长速率是指每单位藻细胞在单位时间内增加的现存量,其计算公式:
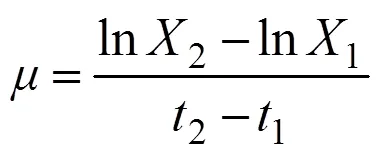
式中,1为1时刻藻类的现存量,2为2时刻藻类的现存量。当麦可属的日平均增长率低于10%时,认为藻细胞生长进入稳定期,可以停止试验[9]。
1.3 生长动力学模型
麦可属的生长过程符合S形曲线,可采用Logistic生长模型描述藻细胞的生长变化过程[10]:
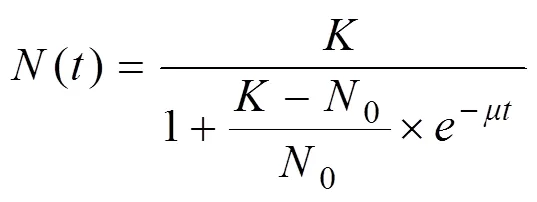
式中,()为时刻藻细胞的生物量,g·L-1;为藻细胞的最大生物量,g·L-1;0为藻细胞的初始生物量,g·L-1。
Steele模型、Lehamn模型分别可以描述连续光照、温度变化下藻细胞的生长动力学,综合Steel模型和Lehman模型,建立藻细胞在光照、温度协同作用下的生长动力学模型[11-13]:
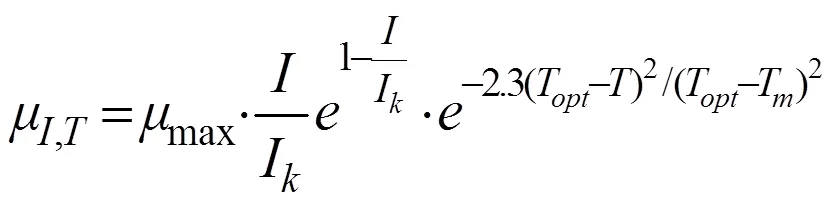
式中,μ,T为温度、光照强度下藻细胞的比生长速率,d-1;I为藻细胞的最佳光照强度,lx;T为藻细胞的最佳生长温度,℃;T为藻细胞最低生长温度,℃。
实验数据录入SPSS、Origin进行统计分析,利用非线性回归方法拟合各模型参数。
2 结果与分析
2.1 光照对麦可属的生长动力学
不同光照下,麦可属的生长过程如图1所示。麦可属的生长主要经历3个阶段:适应期、对数期、稳定期。在第0~5 d,麦可属增长缓慢,处于生长适应期。光照对麦可属的适应期的影响不大,低光照(1 000 lx)下麦可属的生长适应期略长。第5 d后,麦可属开始快速增长,进入对数生长阶段。随着养分的消耗和代谢产物的积累,藻细胞生长速率逐渐降低,麦可属生长进入稳定期。
采用Logistic模型拟合麦可属的生长曲线,各拟合参数如表2所示。1 000 lx、3 000 lx、5 000 lx、7 000 lx光照强度下,麦可属的最大生物量分别为3.2、8.0、7.3、4.0 g·L-1,略低于Logistic模型的拟合值,实际值约为模拟值的89%~95%。在低光照(1 000 lx)环境下,麦可属的最大生物量较低,在中光照(3 000~5 000 lx)环境下最大生物量较高,而高光照(7 000 lx)环境下麦可属生物量大幅下降,仅为3 000 lx时的51.5%,说明过量光照抑制了麦可属的生长。在1 000~7 000 lx光照环境下,麦可属的比生长速率分别为0.363、0.366、0.360、0.343 d-1,光照强度为3 000 lx时麦可属的比生长速率最大,光照强度为7 000 lx时最小。
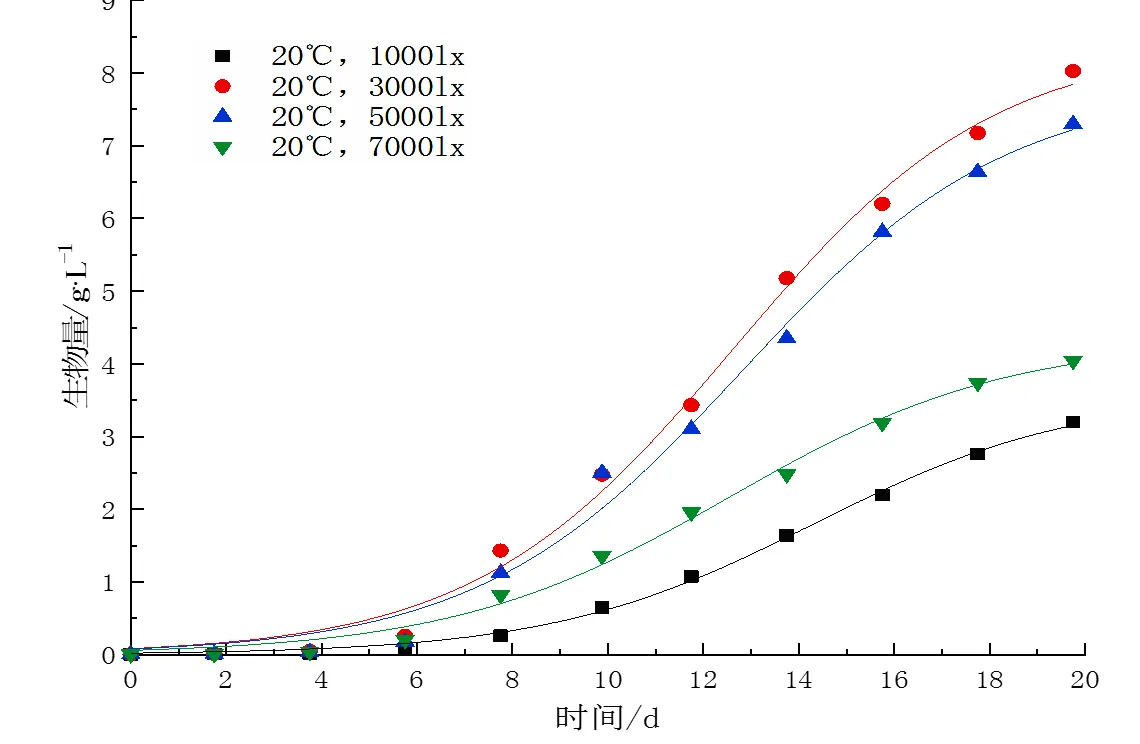
图 1 不同光照强度下麦可属生物量变化

表2 不同光照强度下麦可属的生长参数
光照对麦可属的生长呈现出低光照促进、高光照抑制的现象,适当提高光照强度能有效促进麦可属的生长,但过低或过高的光照均不利于麦可属的生长。相比于大型浮游植物,超微型浮游植物通常更能适应弱光环境,而当光照强度超过藻细胞的光饱和点,会产生过量活性氧抑制藻细胞的生长[14]。
2.2 温度对麦可属的生长动力学
不同温度下,麦可属的生长过程如图2所示。与不同光照环境下麦可属的生长过程相似,在培养的前5~6 d,麦可属生长速率缓慢,处于适应期;随后藻细胞增长速度加快,进入对数增长期;随着营养物质消耗和代谢产物积累,麦可属生长速率降低,16~20 d后麦可属进入稳定期。
采用Logistic模型拟合麦可属的生长曲线,各拟合参数如表3所示。光照强度为3 000 lx,温度为15、20、25 ℃时,麦可属最大生物量分别为4.0、7.2、5.2 g·L-1。与光照梯度实验相似,温度梯度实验的麦可属最大生物量略小于Logistic模型的拟合值。在温度为20 ℃的培养环境最利于麦可属的生长,此时麦可属的生物量生物量最大,分别是培养温度为15 ℃、25 ℃时的1.7倍、1.4倍。在温度为15 ℃、20 ℃、25 ℃的环境下,麦可属的最大比生长速率分别为0.366 d-1、0.395 d-1、0.381 d-1,20 ℃时麦可属的比生长速率达到最大值,而温度继续升高反而抑制了麦可属的生长。
麦可属的生长对温度变化表现为单峰响应,合适的温度能有效促进麦可属的生长。温度是影响藻细胞内的代谢过程的重要因素,在低于最适生长温度时,温度的升高对藻细胞生长有积极的作用,而在超过最适温度时,由于热胁迫影响,酶活性会出现急剧下降,通常超微蓝藻对高温依赖性较高,而真核超微藻对温度的适应性较强[15,16]。麦可属的比生长速率在20 ℃时达到最大,属于喜温类群,但麦可属在较大稳定范围内均可维持较高比生长速率,为其成为自然水体中春秋季的优势类群提供条件。
2.3 麦可属生长动力学模型
光照、温度是影响麦可属生长的重要因素,自然环境中的藻类生长往往同时受到多个环境因素的共同影响。研究表明,藻类的温度敏感性对光感受器有重要作用,通过温度调节的感光机制使得藻细胞可以对光照、温度等环境信息进行整合[17,18]。为了探索光照、温度对麦可属生长的协同作用,构建了麦可属对光照、温度的动力学模型。麦可属的光温模型如图3所示。根据光温模型拟合,麦可属的最佳生长温度为20.4 ℃,最佳生长光照强度为3 203 lx,最大比生长速率为0.426 d-1。麦可属的比生长速率对温度、光照呈现单峰响应。
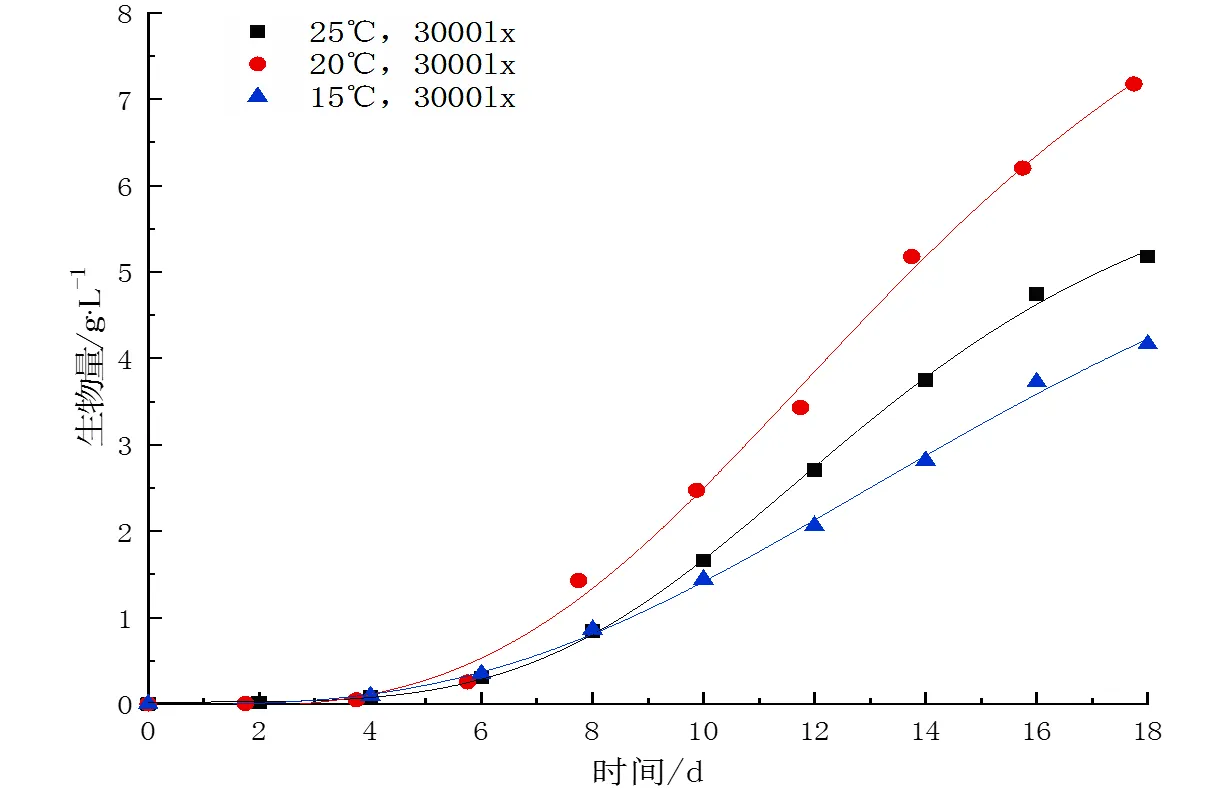
图2 不同温度下麦可属生物量变化

表3 不同温度下麦可属的生长参数
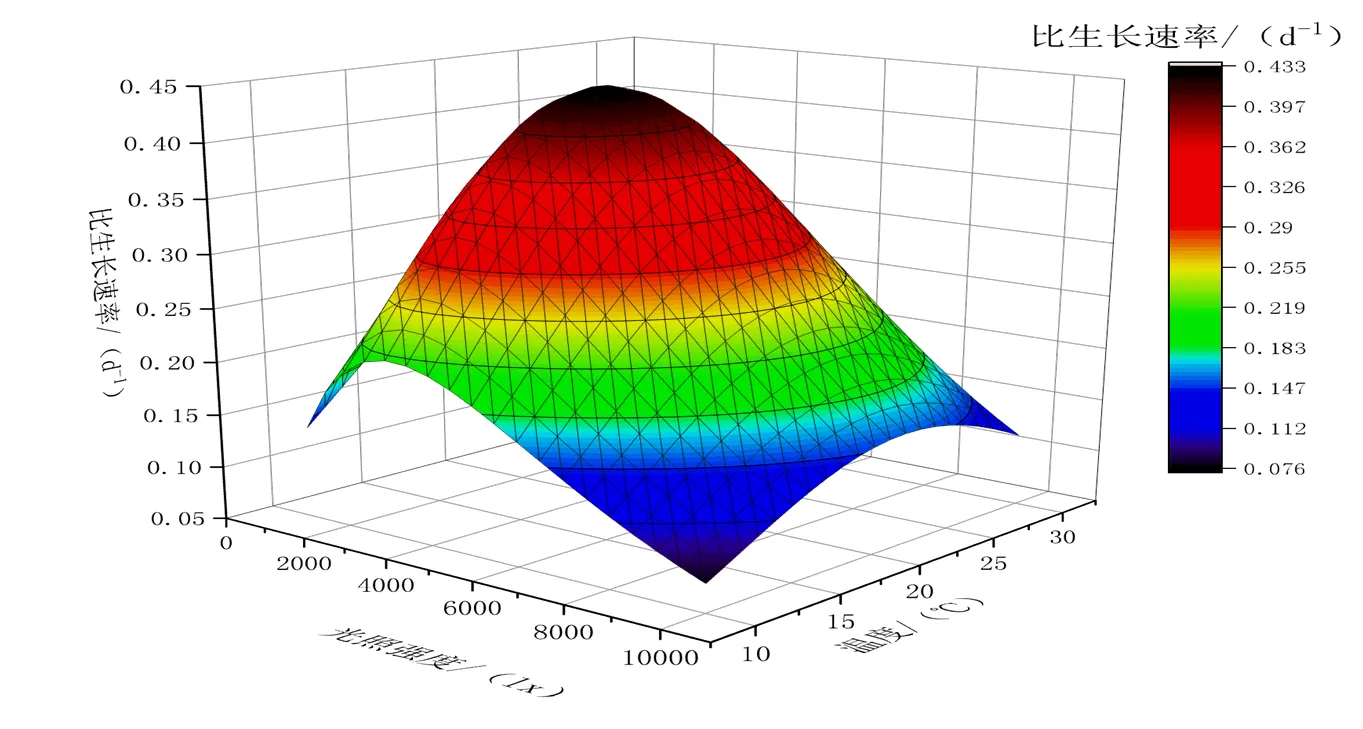
图 3 麦可属的光温模型
3 讨论
3.1 麦可属对光照的响应
藻类能通过改变胞内色素组成或光合酶量适应光照强度的变化,在适度范围内,光照强度与光合作用光合作用几乎线性相关,而高光照强度可能会对藻类产生抑制作用[19,20]。本实验中,低光照水平下,麦可属依然可以维持相对较高的比生长速率(1 000 lx,0.363 d-1),这可能是因为麦可属对光照变化具有很强的适应性,能通过多种光色素的表达适应光照环境的变化。Liu C等研究,麦可属具有趋光素、隐色素、光敏色素的同源基因而缺乏视紫素,因而可以吸收红光和蓝光,不能吸收绿光,同时麦可属具有大量捕光色素蛋白复合体,保证了麦可属弱光环境的适应能力[8]。另外,麦可属具有叶黄素循环机制和超氧化物歧化酶(如Fe-Mn SOD),能通过耗散过剩光能、清除过量活性氧,缓解强光对麦可属抑制作用[8,21]。这些机制保证了即使在弱光或强光环境中,麦可属依然能保持较高的比生长速率,提高了麦可属对光照变化的适应能力。
Shi X等报道,麦可属主导了巢湖的真核浮游植物群落,而在低日照、低水体透明度的春冬季,真核藻类占浮游植物77~97%,远高于日照充沛的夏季[6],说明麦可属对弱光环境的适应有利于其在高浊度、低光强的水体中大量繁殖成为优势藻种。
3.2 麦可属对温度的响应
麦可属有多种对应对低温胁迫的机制:(1)具有吡咯啉-5-羧酸还原酶的编码基因,可以合成脯氨酸来缓解寒冷引起的渗透胁迫;(2)含有抗氧化酶(如Fe-Mn SOD、CAT、APX等)和抗氧化剂(如谷氨酸和β-胡萝卜素)的生物合成途径,可以清除低温胁迫下产生的过量活性氧;(3)高含量的不饱和脂肪酸降低了麦可属细胞膜的相变温度[8]。这些机制保证了麦可属在低温环境下保持一定活性,即使在温度为15 ℃的环境下,麦可属的比生长速率依然可以达到0.366 d-1。
研究表明,高温胁迫会使得藻细胞体内活性氧含量增高、抗氧化系统活性降低,影响藻细胞生长[22,23]。当稳定超过20 ℃时,麦可属的比生长速率逐渐下降。在20~25 ℃时,麦可属可以维持较高的比生长速率,该温度接近于鄱阳湖、东山湖等温带湖泊春秋季水温,一定程度解释了麦可属水华发生的原因。麦可属对温度胁迫具有多种响应机制,为麦可属的广泛分布提供的合适的温度条件。
3.3 光温模型分析
综合Lehman温度动力学模型和Steel光照动力学模型,建立麦可属的光温模型。当温度为20~25 ℃,光照强度为2 000~4 000 lx时,麦可属可以维持较高的比生长速率,该光热条件接近于春秋季的高浊度水体,与自然水体中麦可属水华发生时的光热条件基本相一致,说明该模型可以较好反映温度、光照协同作用对麦可属的影响。
4 结论
(1)温度恒定时,麦可属生长的最佳光照强度为3 000 lx;光照恒定时,麦可属生长的最佳温度为20 ℃,适当的光照和稳定有利于麦可属的生长和生物量的积累;
(2)根据光温模型拟合,麦可属生长特性对温度、光照变化单峰响应,麦可属的最佳生长温度为20.4 ℃,最佳生长光照强度3 203 lx,最大比生长速率为0.426 d-1。当温度为20~25 ℃,光照强度为2 000~4 000 lx时,麦可属可以维持较高的比生长速率。该光热条件接近于麦可属水华发生的自然水体环境,光热模型较好反映了实际水体中光热条件对麦可属的影响,为麦可属水华的预警提供依据。
[1] 李胜男,陈豪宇,彭华,等.丰水期东洞庭湖超微型浮游藻类时空分布特征及其影响因子[J].环境科学,2020,41(6):2679-2687
[2] 李艳晖,胡明明,沈银武,等.中国淡水绿藻纲新记录属——麦可属()[J].水生生物学报,2013,37(3):473-480
[3] 吴凡,任名栋,陈非洲,等.抚仙湖超微型浮游藻类群落结构空间分布特征[J].生态学报,2021,41(2):737-746
[4] Liu C, Shi X, Fan F,. N:P ratio influences the competition ofwith its picophytoplankton counterparts,and, under nutrient enrichment conditions [J]. Journal of Freshwater Ecology, 2019,34(1):445-454
[5] Hu Y, Liu X, Xing W,. Marker gene analysis reveals the spatial and seasonal variations in the eukaryotic phytoplankton community composition in the yangtze river, three gorges reservoir, China [J]. Journal of Plankton research, 2019,41(6):835-848
[6] Shi X, Li S, Fan F,.dominates the photosynthetic picoeukaryotes in Lake Poyang, a river-connected lake [J]. FEMS Microbiology Ecology, 2019,95(1):1-11
[7] Saadaoui I, Cherif M, Rasheed R,.(Chlorophyceae): a promising feedstock for high quality feed production in the arid environment [J]. Algal Research, 2020,51:102021
[8] Liu C, Shi X, Wu F,. Genome analyses provide insights into the evolution and adaptation of the eukaryotic Picophytoplankton[J]. BMC Genomics, 2020,21(1):477
[9] 郑朔方,杨苏文,金相灿.铜绿微囊藻生长的营养动力学[J].环境科学,2005,26(2):152-156
[10] 曹阳阳.细菌生长曲线的模型拟合及聚类分析[D].上海:华东师范大学,2020
[11] 殷志坤,李哲,王胜,等.磷限制下光照和温度对水华鱼腥藻生长动力学的影响[J].环境科学,2015,36(3):963-968
[12] Lehman JT, Botkin DB, Likens GE. The assumptions and rationales of a computer model of Phytoplankton population dynamic? [J]. Limnology and Oceanography, 1975,20(3):343-364
[13] Steele JH. Environmental control of Photosynthesis in the sea [J]. Limnology and Oceanography. 1962,7(2):137-150
[14] 高静思,朱佳,董文艺.光照对我国常见藻类的影响机制及其应用[J].环境工程,2019,37(5):111-116
[15] 李胜男,周建,魏利军,等.淡水超微型浮游植物多样性及其研究方法[J].生态学杂志,2015,34(4):1174-1182
[16] Manhaeghe D, Michels S, Rousseau DPL,. A semi-mechanistic model describing the influence of light and temperature on the respiration and photosynthetic growth of[J]. Bioresource Technology, 2019,274:361-370
[17] Li X, Slavens S, Crunkleton DW,. Interactive effect of light quality and temperature ongrowth kinetics and lipid synthesis [J]. Algal Research, 2021,53:102127
[18] Jones MA. Using light to improve commercial value [J]. Horticulture Research, 2018,5:47
[19] 刘世明,朱雪竹,张民.铜绿微囊藻()和蛋白核小球藻()生长及光合活性 对温度和光照交互作用的响应[J].湖泊科学,2014,26(5):773-779
[20] 刘春光,金相灿,邱金泉,等.光照与磷的交互作用对两种淡水藻类生长的影响[J].中国环境科学,2005,25(1):32-36
[21] 贾虎森,李德全,韩亚琴.高等植物光合作用的光抑制研究进展[J].植物学通报,2000,17(3):218-224
[22] 臧晓南,张学成,张璐,等.藻类高温胁迫分子响应的研究进展[J].武汉大学学报(理学版),2008,54(6):732-738
[23] 鹿宁,臧晓南,张学成,等.逆境胁迫对藻类抗氧化酶系统的影响[J].武汉大学学报(理学版),2012,58(2):119-124
Effects of Light and Temperature on Growth Kinetics of
LI Jun-peng1, PAN Wei-bin1,2*, HUANG Xiao-jia1
1.510006,2.510006,
was selected for the study. The effects of interaction between light and temperature on the growth ofwere evaluated by a designed experiment with gradients of light and temperature. Based on Lehman model and Steele model, the photo-thermal model ofis established. The results showed that the optimum light intensity was 3000 lx under constant temperature. While the light intensity was constant, the optimum temperature was 20 ℃. Under the synergistic effects of light and temperature, the optimum growth temperature was 20.4 ℃, the optimum growth light intensity was 3203 lx and the maximum specific growth rate ofwas 0.426 d-1. Appropriate light intensity and temperature are importance for the formation ofblooms. The photo-thermal model will provide important foundation for prediction ofblooms.
; light; temperature; growth kinetics
X171
A
1000-2324(2022)02-0240-06
10.3969/j.issn.1000-2324.2022.02.009
2021-09-30
2021-10-26
2019年广东粤海水务股份有限公司项目:湖泊水生态系统健康评价及生态恢复对策研究(D5190580)
李俊鹏(1996-),男,硕士研究生,主要从事生态工程与环境修复研究. E-mail:595139040@qq.com
Author for correspondence. E-mail:pwbpan@scut.edu.cn

