78c对胶原诱导性关节炎小鼠的治疗效果及其机制
张小钰 王洪星2 常晓天
(1 青岛大学附属医院医学研究中心,山东 青岛 266003; 2 山东大学齐鲁医院检验科)
类风湿关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病,主要症状为关节疼痛、肿胀和僵硬,但其发病机制尚不完全清楚[1]。研究证明,RA患者滑膜组织和外周血中CD38的表达水平明显升高[2-3]。CD38是一种具有受体和酶功能的细胞表面蛋白,能够催化烟酰胺腺嘌呤二核苷酸生成二磷酸腺苷核糖以及环腺苷二磷酸核糖(cADPR)[4]。cADPR是调节细胞钙流量的第二信使[5]。CD38通过控制细胞外核苷酸稳态和细胞内钙离子流动,参与肿瘤、免疫和衰老等多种生理病理活动[6]。目前研究发现CD38基因敲除小鼠的胶原诱导性关节炎(collagen induced arthritis,CIA)明显减轻,提示抑制CD38可以缓解CIA的发生发展[7]。78c即thiazoloquin(az)olin(on)es,属于噻唑喹啉类有机化合物,是CD38的抑制剂[8]。最新研究发现,78c具有延缓衰老的作用[9],但78c对RA的作用及机制尚不清楚。本研究通过建立CIA模型,并以CD38的抑制剂78c进行治疗,探讨78c对CIA小鼠的治疗作用及其机制。
1 材料与方法
1.1 材料和设备
6周龄C57BL/6J雄性小鼠共18只,体质量约为20 g,购自北京维通利华实验动物技术有限公司(许可证号:SCXK 2016-0006)。78c试剂购自美国MedChemExpress公司,鸡Ⅱ型胶原蛋白购自美国Chondrex公司,流式抗体购买自美国BioLegend公司,流式细胞仪购自美国ACEA Biosciences公司。
1.2 方法
1.2.1动物分组和处理 18只小鼠适应性喂养1周,饲养温度控制在20~22 ℃,相对湿度40%~70%。随机分为正常对照组、CIA对照组和CIA治疗组,每组6只小鼠。CIA对照组和CIA治疗组小鼠均先进行模型制备,首先将鸡Ⅱ型胶原与完全弗氏佐剂等量混合液注射于小鼠尾根部皮内,剂量为每只0.1 mL;2周后,每只再次注射0.1 mL鸡Ⅱ型胶原与不完全弗氏佐剂等量混合液进行加强免疫。模型制备成功后,CIA治疗组小鼠以20 mg/kg剂量的78c(置于体积分数0.10 DMSO和体积分数0.90玉米油混合液中避光溶解)腹腔注射,每周2次,连续3周;正常对照组、CIA对照组小鼠注射相同剂量的上述DMSO和玉米油混合液,每周2次,连续3周。给药结束后麻醉各组小鼠,内眦取血法采集各组小鼠外周血。断颈处死所有小鼠,快速解剖,取出小鼠踝关节备用。
1.2.2小鼠足趾厚度变化的检测 各组小鼠分别于腹腔注射的第0、4、8、12、16、20天(T0~T20)用游标卡尺测量并记录小鼠的足趾厚度。
1.2.3小鼠关节组织病理检查 取各组小鼠踝关节,去除多余肌肉组织后放置于40 g/L多聚甲醛中固定保存。制备石蜡切片,苏木精-伊红(HE)染色,光学显微镜下观察小鼠关节组织病理学变化。
1.2.4小鼠外周血中淋巴细胞亚型的检测 抽取各组小鼠外周血,裂解红细胞后离心以沉淀白细胞,采用PBS重悬细胞,加入流式抗体,用流式细胞仪检测各淋巴细胞亚型,并且计算各细胞亚型占淋巴细胞的比例。
1.2.5小鼠血清中Th1/Th2的检测 分离各组小鼠血清,流式细胞仪检测小鼠血清中IFN-γ、IL-6、IL-10、TNF-α水平。Th1细胞主要分泌IFN-γ、TNF-α等,Th2主要分泌IL-4、IL-10等。根据上述细胞因子浓度计算Th1/Th2(TNF-α/IL-10、IFN-γ/IL-10)比值[10]。
1.3 统计学处理
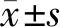
2 结 果
2.1 各组小鼠足趾厚度变化比较
时间、组别对小鼠足趾厚度有明显影响(F时间=5.85,F组别=75.14,P<0.05),时间与组别交互作用对小鼠足趾厚度没有明显影响(F交互=1.83,P>0.05)。CIA对照组不同时间点足趾厚度比较差异无显著性(P>0.05);正常对照组、CIA治疗组不同时间点足趾厚度比较差异均有显著性(F=16.19、7.73,P<0.05);相同时间点各组间比较差异均有显著性(F=27.10~52.83,P<0.05)。见表1。
2.2 各组小鼠关节组织病理学变化比较
正常对照组小鼠关节腔内干净,软骨细胞形态结构正常,滑膜未见明显增生(图1A);CIA对照组小鼠滑膜增生明显,组织中可见较大量的炎性细胞浸润(图1B);CIA治疗组小鼠滑膜增生程度减轻,组织中炎性细胞浸润明显减少(图1C)。
2.3 各组小鼠外周血中各细胞亚型占淋巴细胞比例比较
各组小鼠外周血中的B细胞、NK细胞、CD38+NK细胞、Treg细胞占淋巴细胞比例的比较差异有显著性(F=4.15~10.50,P<0.05),CD3+T细胞、CD4+T细胞占淋巴细胞比例比较差异均无显著性(P>0.05)。与正常对照组相比较,CIA对照组小鼠B细胞、NK细胞、CD38+NK细胞比例升高(P<0.05),Treg细胞比例降低(P<0.05);与CIA对照组相比,CIA治疗组小鼠NK细胞以及CD38+NK细胞比例降低(P<0.05),Treg细胞比例升高(P<0.05)。见表2。
2.4 各组小鼠血清中Th1/Th2比值比较
各组小鼠血清中Th1/Th2比值比较差异有显著性(F=7.67、16.33,P<0.05)。CIA对照组与正常对照组血清中Th1/Th2比值比较差异有显著性(P<0.05),CIA治疗组与CIA对照组血清中Th1/Th2比值比较差异有显著性(P<0.05)。见表3。
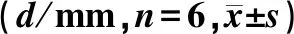
表1 各组小鼠足趾厚度随时间变化比较Tab.1 Comparison of toe thickness changes over time of mice in each group (d/mm, n=6,
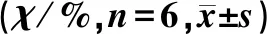
表2 各组小鼠外周血中各细胞亚型占淋巴细胞比例比较Tab.2 Comparison of the proportion of each cell subtype in lymphocytes in the peripheral blood of mice in each group
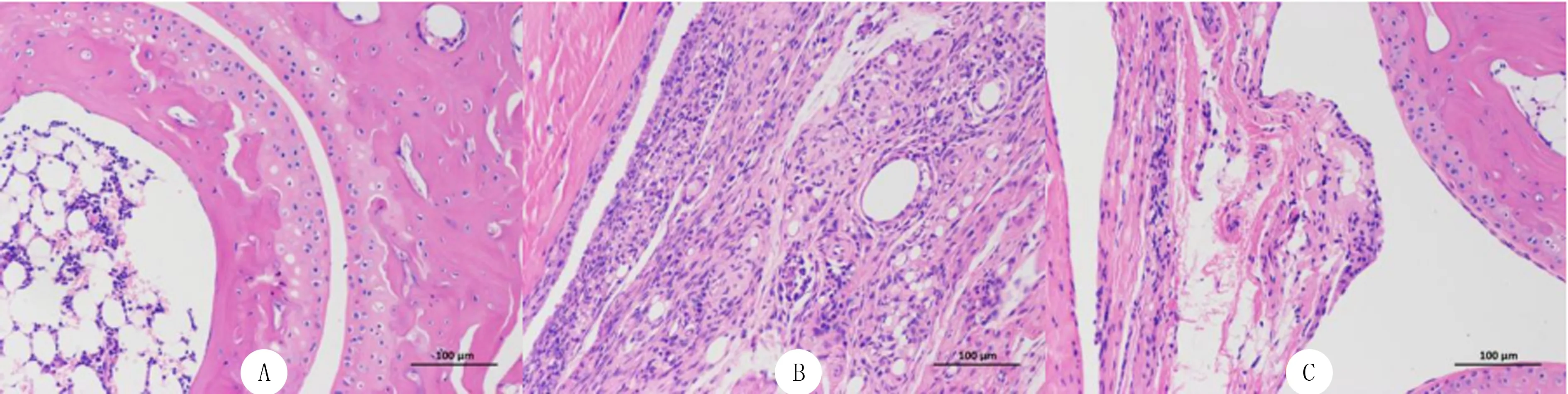
A:正常对照组,B:CIA对照组,C:CIA治疗组,HE染色法,200倍图1 光镜下各组小鼠踝关节组织病理学变化Fig.1 Histopathological changes of ankle joint of mice in each group under light microscope
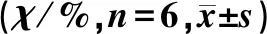
表3 各组小鼠Th1/Th2比值比较
3 讨 论
RA是一种以多关节炎为主要临床表现的慢性自身免疫性疾病,全球患病率为0.2%~1%[11]。CIA模型是临床上常用的RA模型,其足趾肿胀厚度是反映关节炎症的常用指标[12]。本研究结果显示,CIA治疗组小鼠足趾厚度显著低于CIA对照组,这表明经78c治疗后,小鼠关节炎症得到缓解,对于CIA可能有保护作用。病理检查同样是诊断CIA的指标之一[13]。本研究结果显示,CIA对照组小鼠关节腔内有坏死、脱落的组织块,伴有炎性细胞浸润,滑膜明显增生,CIA治疗组小鼠滑膜细胞增生减少,滑膜组织炎性细胞浸润明显减少,提示78c亦可以保护关节组织结构,减轻关节组织炎症反应,对CIA小鼠发挥了保护作用。
有研究表明,NK细胞既可以通过调节骨代谢,介导骨侵蚀[14],又可通过影响分泌TNF-α、IFN-γ等细胞因子调节B细胞以及T细胞等免疫细胞参与RA的进展[15]。CD56是NK细胞重要的标志物,有研究发现CD38+CD56+细胞在RA患者外周血中比例显著提高[16]。本研究结果显示,CIA对照组与正常对照组相比,小鼠外周血中NK细胞比例升高;CIA治疗组与CIA对照组相比,小鼠外周血中NK细胞比例降低。提示NK细胞可能在CIA的进展中发挥促进作用,经78c治疗可以缓解炎症反应。CD38广泛表达于各种免疫细胞中,参与T、B细胞以及NK细胞的信号转导、调节细胞的生长增殖和分化、诱导细胞因子的产生[5],并且在促进NK细胞的活化中发挥重要作用[17]。最新研究报道,CD38+NK细胞可以启动多发性骨髓瘤患者的免疫系统,并发挥重要的治疗作用[18]。CD38+NK细胞在RA发生发展中也发挥着重要作用。CD38+NK细胞在CIA和RA中的比例均增加[16,19],这提示CD38+NK细胞参与了RA和CIA的发病过程。WANG等[19]研究发现CD38天然抑制剂矢车菊素-3-O-葡萄糖苷可以通过抑制CD38+NK细胞比例缓解大鼠CIA的进展。本研究结果显示,CIA对照组与正常对照组相比,小鼠外周血中CD38+NK细胞比例显著升高;CIA治疗组与CIA对照组相比,小鼠外周血中CD38+NK细胞比例显著降低,提示78c具有降低CD38+NK细胞比例、缓解CIA进展的作用。Treg细胞仅占外周血中CD4+T细胞的5%~10%,但在维持机体免疫耐受中发挥重要的作用,是免疫稳态的重要调节因子,通过抑制炎症反应、促进自身耐受来调节免疫反应[20]。在多种自身免疫性疾病中观察到Treg细胞比例降低以及功能受损[21]。RA中Treg细胞比例显著降低,并与RA的活动程度呈负相关[22-23]。许多研究指出,提高Treg细胞比例或修复Treg细胞功能是治疗自身免疫性疾病的有效策略[21,24]。LI等[25]也曾观察到外源性Treg细胞治疗CIA模型大鼠后,关节炎症明显减轻。本研究结果显示,CIA对照组与正常对照组相比较,小鼠外周血中Treg细胞比例显著降低;CIA治疗组与CIA对照组相比较,小鼠外周血中Treg细胞比例显著升高。提示78c可能通过提高Treg细胞比例,对CIA发挥保护作用。
在RA患者活动期,血清中某些致炎细胞因子如IFN-γ、IL-6、TNF-α水平明显高于健康人,这些致炎细胞因子在滑膜病变中起决定作用,并在病情缓解期或治疗后水平明显降低;而抗炎因子如IL-10水平显著低于健康人,可以起到加剧关节损伤的作用[26]。Th1细胞主要介导细胞免疫应答,分泌IL-2、IFN-γ、TNF-α等细胞因子;Th2细胞介导体液免疫,主要分泌IL-4、IL-5、IL-10和IL-13等细胞因子[27]。其中IL-10被认为具有双向免疫作用,其免疫抑制功能主要表现在抑制Th1细胞分泌的IFN-γ和IL-2,使Th1、Th2处于免疫平衡状态[28]。另一方面可对T、B淋巴细胞产生免疫反应,在RA疾病过程中具有保护作用。研究显示,Th1/Th2比值失衡促进了自身免疫性疾病的发生发展[29]。在活动性RA中,Th1细胞和Th2细胞间的平衡被破坏[30]。WANG等[31]利用CD4+T细胞与CD38+NK细胞共培养模型发现,CD38抑制性抗体可以通过CD38+NK细胞调节Th1/Th2细胞的平衡。本研究结果显示,CIA对照组与正常对照组相比,小鼠Th1/Th2比值升高;CIA治疗组与CIA对照组相比,小鼠Th1/Th2比值降低,由此可以推测78c可能通过恢复Th1/Th2细胞的平衡,缓解CIA小鼠的关节损伤。
综上所述,本研究结果显示,CD38的化学抑制剂78c可以显著缓解CIA关节炎症,其作用机制可能与降低CD38+NK细胞比例、升高Treg细胞比例,恢复Th1/Th2细胞的平衡有关。CD38抑制剂在改善RA关节损伤方面有良好临床应用前景,其确切的机制还有待进一步深入研究。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
伦理批准和动物权利声明:本研究涉及的研究对象均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL266-23)。实验动物遵照《中华人民共和国实验动物管理条例》的规定饲养和处理。
EthicsApprovalandAnimalRight: The subjects involved in this study were reviewed and approved by The Ethics Committee of The Affiliated Hospital of Qingdao University (Approval Letter No.QYFYWZLL26623). The experimental animals were kept and handled in accordance with the provisions of the Regulations of the People’s Republic of China on the Administration of Experimental Animals.
作者贡献:常晓天参与了研究设计;张小钰、王洪星参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byCHANGXiaotian. The manuscript was drafted and revised byZHANGXiaoyuandWANGHongxing. All the authors have read the last version of the paper and consented submission.

