术前血清中性粒细胞-淋巴细胞比值对动脉瘤性蛛网膜下隙出血术后行气管切开的预测价值
叶景, 李业海, 林建浩, 黄佛宝, 何桂录, 刘泽斯, 张良
动脉瘤性蛛网膜下隙出血(aneurysmal subarachnoid hemorrhage, aSAH)是常见的脑血管疾病,约占自发性蛛网膜下隙出血的85%[1]。该病起病急,病情重,可严重损伤中枢神经系统并对多器官产生病理生理影响,死亡率约为50%[1]。对于aSAH患者,尤其是重症患者,气道管理尤其重要,是影响患者治疗效果及疾病转归的关键因素。气管切开术可以降低气道阻力,改善气道顺应性,减少呼吸道并发症,可作为预计需要长期机械通气(>2周)患者的气道管理策略。因此,早期确定是否需要行气管切开术并及时进行干预,可能可以改善这部分患者的预后[2-3],但这也是临床治疗过程中面临的主要困难。
血清中性粒细胞-淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)是一种炎症标志物,已被证实可用于预测aSAH的并发症和预后[4-8]。但目前NLR是否能预测及甄别aSAH患者行气管切开的必要仍不明确。本研究拟通过分析入院时患者的血清NLR水平与术后行气管切开术的相关性,探讨血清NLR预测aSAH术后行气管切开的应用价值。
1 对象与方法
1.1 对象 回顾性收集2013年1月— 2021年1月
笔者医院行脑动脉瘤手术的385例患者,其中男性150例,女性235例,年龄(53.7±11.3)岁。纳入标准:(1)年龄>18岁。(2)术前血管造影检查提示aSAH,肺部CT检查排除肺部感染。(3)入院前未在外院接受治疗。(4)入院后接受开颅夹闭或介入栓塞手术。(5)对回顾性研究知晓并签署知情同意书。排除标准:(1)医疗记录信息不完整。(2)既往或者术前行气管切开。(3)长期服用类固醇、抗凝药或免疫抑制剂。(4)合并其他重大疾病,如系统性红斑狼疮等免疫性疾病及恶性肿瘤。
1.2 方法 收集患者的年龄、性别、并发症等一般性资料,格拉斯哥昏迷评分(Glasgow coma scale, GCS)、Hunt-Hess分级、世界神经外科联盟分级量表(world federation of neurological societies scale, WFNS)、mFisher评分等病情评估量表,术前血清检测指标,动脉瘤大小与位置,手术时长与手术方式,手术后是否行气管切开等资料。根据术后是否行气管切开将患者分为气切组与未气切组。患者的诊断和治疗过程均根据aSAH的管理指南[9]实施。患者入院时病情评分由经验丰富的高年资神经外科医生完成,包括:GCS评分、Hunt-Hess分级、WFNS分级及mFisher评分。GCS评分根据患者睁眼反应、语言反应及肢体运动进行评估。Hunt-Hess分级根据患者的症状、意识、神经功能障碍、并发症情况进行评估。WFNS分级根据GCS评分情况、神经功能障碍、偏瘫及失语情况进行评估。mFisher评分根据CT检查反应的蛛网膜下隙出血的出血量、积血薄厚、弥散或局部、有无脑室内积血进行评估。动脉瘤的大小与方位由经验丰富的影像科医生做出评估,开颅夹闭手术及介入栓塞治疗由两位经验丰富的神经外科医生执行。气管切开指征:(1)具有明显的呼吸困难,监测动脉血氧分压≤60 mmHg(1 mmHg=133.3 Pa)及血氧饱和度≤90%,予以吸氧处理后无明显改善。(2)神志深昏迷且预计短时间内无法恢复清醒,伴有痰多或频繁呕吐,存在误吸风险。(3)呼吸道不畅或梗阻,咳嗽反射减弱,伴有肺部感染。根据患者的病情和临床指征,由神经外科医师与重症医学科、耳鼻咽喉科医师共同商议,对预计需要2周以上的人工气道及呼吸支持的患者进行气管切开。所有患者在入院后进行包括血常规在内的术前常规检查。根据血常规结果计算炎症指标如下:NLR,淋巴细胞-单核细胞比值(lymphocyte-monocyte ratio, LMR),血小板-淋巴细胞比值(platelet-lymphocyte ratio, PLR)。由于C反应蛋白(C-reactive protein, CRP)及降钙素原(procalcitonin, PCT)等炎症指标并非所有患者常规术前检查指标,不纳入统计。
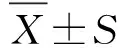
2 结 果
2.1 一般资料比较 气切组36例,男性17例,女性19例,年龄(59.2±9.68)岁;未气切组349例,男性133例,女性216例,年龄(53.2±11.3)岁。气切组NLR水平较未气切组高[16.04 (11.39~19.97)vs6.95 (4.11~11.19),P<0.001]。此外,气切组的年龄、Hunt-Hess分级、WFNS分级、mFisher分级、合并高血压病、合并糖尿病、入院收缩压、术前白细胞水平、术前中性粒细胞水平、术前PLR、动脉瘤大小、后循环动脉瘤、迟发性脑缺血、迟发性脑血管痉挛发生率明显高于未气切组(P<0.05),GCS评分、术前淋巴细胞水平、术前血小板水平、术前LMR明显低于未气切组(P<0.05,表1)。

表1 气切组和未气切组的一般性资料比较Tab.1 Comparison of general characteristics between postoperative tracheostomy group and non-postoperative tracheostomy group
2.2 单因素与多因素logistic回归分析评估NLR与气切组患者的相关性 单因素logistic回归分析发现,年龄、GCS评分、Hunt-Hess分级、WFNS分级、mFisher评分、高血压病、糖尿病、入院收缩压、白细胞水平、中性粒细胞水平、淋巴细胞水平、单核细胞水平、血小板水平、NLR、PLR、手术时长、动脉瘤大小、后循环动脉瘤与气切组患者独立相关。多因素logistic回归分析(forward)发现,年龄(OR=1.05, 95% CI:1.00~1.10)、WFNS分级(OR=3.47, 95% CI:2.41~4.98)、NLR(OR=1.09,95% CI:1.02~1.16)、后循环动脉瘤(OR=3.07, 95% CI:1.08~8.74)是气切组患者的独立预测因素(表2)。
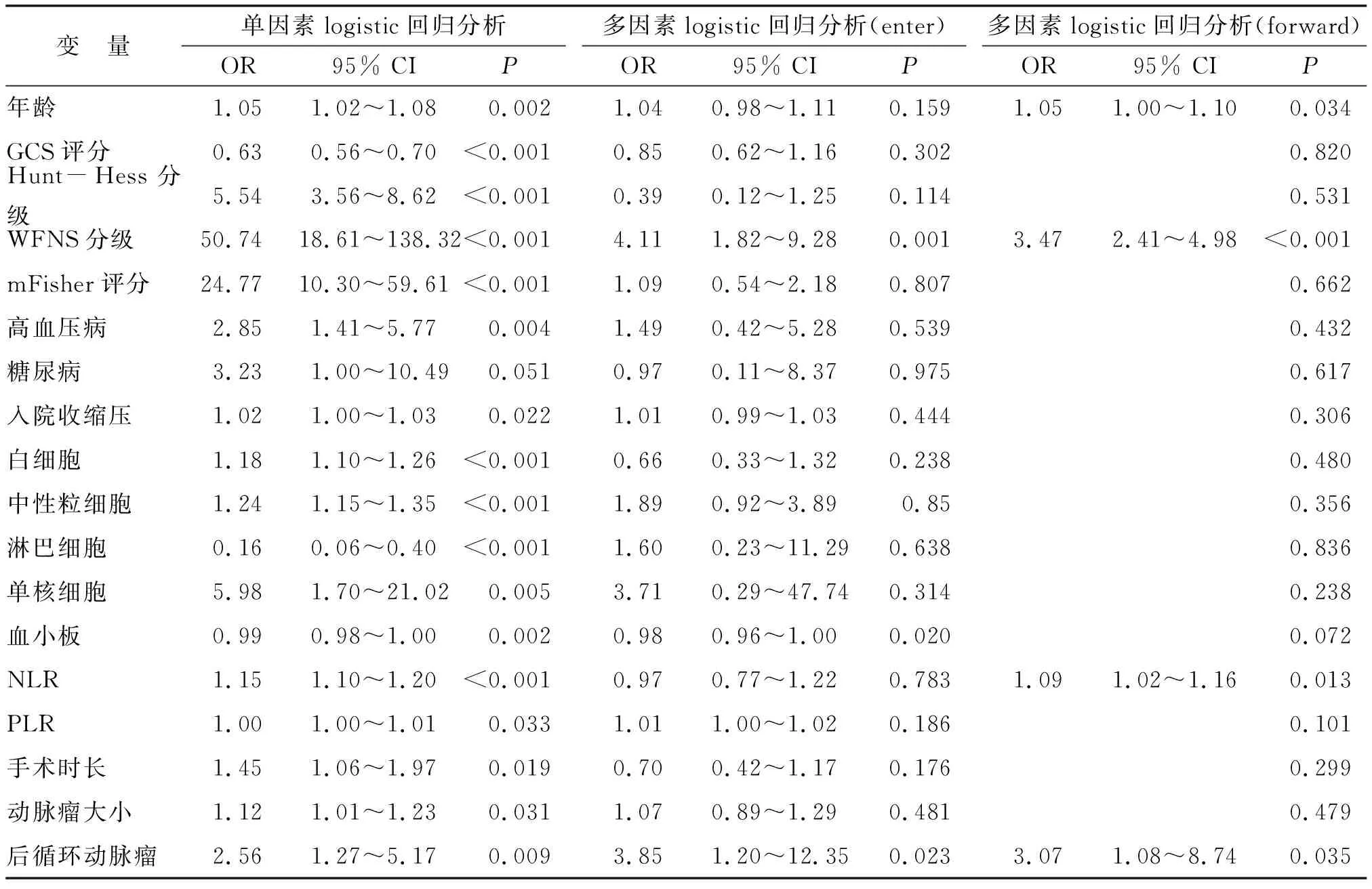
表2 与气切组患者可能相关的因素的单因素与多因素logistic回归分析Tab.2 Univariate and multivariate logistic analysis of factors possibly associated with patients in postoperative tracheostomy group
2.3 ROC曲线和Delong检验分析NLR对气切组患者的预测性能 采用ROC曲线分析发现(图1),NLR预测气切组患者的曲线下面积为0.824(95% CI:0.782~0.861),最佳界值为11.03,敏感性为83.33%,特异性为74.79%,约登指数为0.581。年龄、WFNS分级及后循环动脉瘤预测气切组患者的曲线下面积分别为0.665(95% CI:0.616~0.712)、0.922(95% CI:0.890~0.947)、0.603(95% CI:0.553~0.653),敏感性分别为50.00%、86.11%及44.44%,特异性分别为77.65%、89.11%及76.22%,约登指数分别为0.277、0.752 及 0.207。Delong检验分析发现,NLR的预测性能较WFNS分级差(Z=3.182,P=0.002),但优于年龄(Z=2.905,P=0.004)和后循环动脉瘤(Z=4.016,P<0.001)。
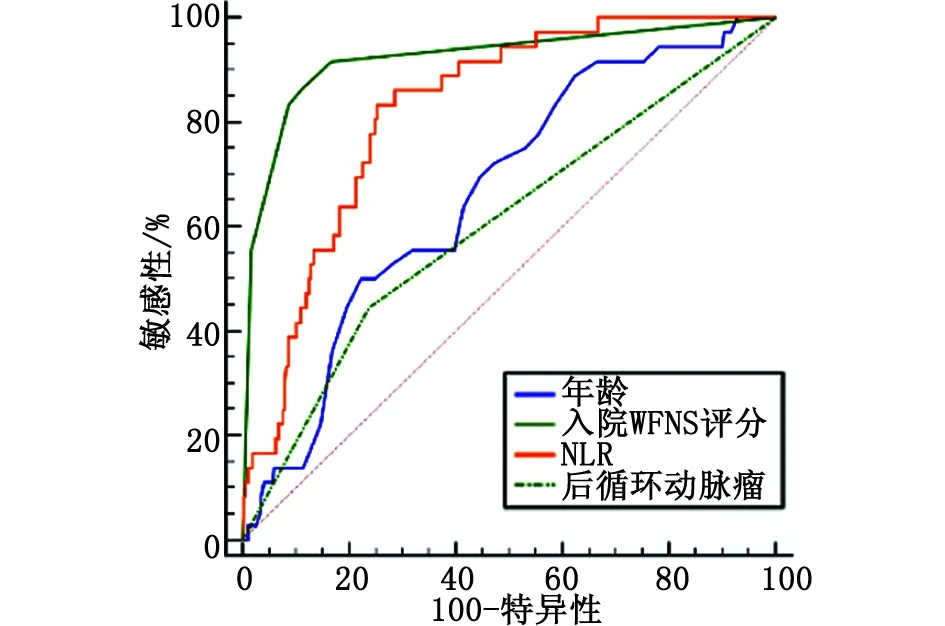
NLR:中性粒细胞-淋巴细胞比值。图1 年龄、WFNS评分、NLR与后循环动脉瘤预测气切组患者的ROC曲线Fig.1 Receiver operating characteristic curves of age, WFNS score, NLR, and posterior circulation aneurysm for predicting patients in postoperative tracheostomy group
入院Hunt-Hess分级、入院mFisher评分、术前白细胞水平预测气切组患者的曲线下面积分别为0.881(95% CI:0.845~0.912)、0.855(95% CI:0.815~0.888)、0.734(95% CI:0.687~0.778),敏感性分别为83.33%、80.56%及44.44%,特异性分别为85.39%、85.67%及91.12%,约登指数分别为0.687、0.662、0.356。Delong检验分析发现,NLR的预测性能与入院Hunt-Hess分级、入院mFisher评分相当(Z=1.619,P=0.106;Z=0.893,P=0.372),优于术前白细胞水平(Z=2.128,P=0.033)(图2)。
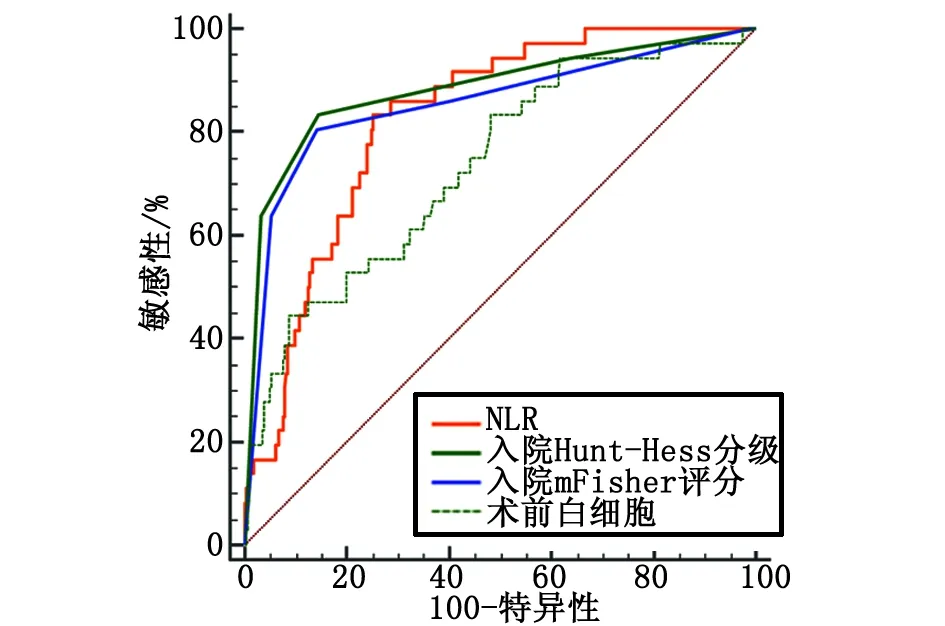
NLR:中性粒细胞-淋巴细胞比值。图2 NLR、入院Hunt-Hess分级、入院mFisher评分、术前白细胞预测气切组患者的ROC曲线Fig.2 Receiver operating characteristic curves of NLR, admission Hunt-Hess grade, admission mFisher score, and preoperative leukocyte level for predicting patients in postoperative tracheostomy group
3 讨 论
许多aSAH的患者常伴有不同程度的意识障碍,需要机械通气以辅助呼吸。然而,部分长期机械通气的患者存在拔管和脱机困难,需要切开气管以达到早期脱机。与气管插管相比,及时的气管切开可改善呼吸力学,如降低气道压、提高顺应性。另外,有研究表明,早期气管切开可以缩短住院时间,改善卒中患者的预后[2-3]。但目前针对aSAH患者,如何早期判断与甄别是否需要行气管切开仍未明确。因此,寻求能预测aSAH患者需要行气管切开的指标具有重要的临床意义。NLR已被证实可用于术后肺炎的预测,受到了广泛的关注[4]。
本研究发现,与未气切组比较,气切组的aSAH患者入院时的NLR水平明显更高(P<0.001)。进一步行单因素回归分析发现,包括NLR在内的诸多因素如GCS评分、Hunt-Hess分级、高血压病、糖尿病、入院收缩压、手术时长等是aSAH患者术后行气管切开的相关因素。多因素logistic回归分析显示,NLR(OR=1.09,95% CI:1.02~1.16,P=0.013)、年龄、WFNS分级及动脉瘤位置是气切组患者的独立预测因素。GCS评分、Hunt-Hess分级等其他因素被证实不是术后气管切开的独立预测因素。高龄、高WFNS分级可反映患者病情的严重程度及预后[10-13]。既往研究表明,后循环aSAH的患者气管切开发生率要高于前循环[14],本研究结果与此一致。进一步通过ROC曲线分析发现,NLR预测气切组患者的性能良好(AUC>0.8)。与年龄、术前WBC、入院Hunt-Hess分级、入院mFisher评分、WFNS分级及动脉瘤位置比较,NLR的预测性能虽不如WFNS分级(P<0.05),但与入院Hunt-Hess 分级、入院mFisher评分相当(P>0.05),且优于患者年龄、术前WBC和动脉瘤位置(P<0.05)。AL-MUFTI等[15]发现,NLR可以作为aSAH患者发生迟发性脑缺血的预测因素,高NLR的aSAH患者可能处在更加强烈的炎症和免疫失调状态,这可能导致迟发性脑血管痉挛或迟发性脑缺血等临床上不易察觉的并发症,而这些并发症可加重患者的意识障碍,增加气管切开概率,这是未来进一步研究的重点。
综上所述,本研究发现,NLR可作为aSAH患者术后行气管切开的独立预测因素,与年龄、动脉瘤位置比较,显示出较好的预测性能。本研究也存在诸多不足之处。首先,本研究是单中心资料,病例收集的代表性存在一定的局限性。其次,样本量的相对不足可能造成一定的偏倚,介入治疗病例较少。再者,NLR作为非特异性的炎症标志物,干扰因素较多,特异性有所欠缺。因此,未来仍需要大样本、多中心的前瞻性的研究来验证NLR预测aSAH患者术后行气管切开的价值。

