酸性环境中的铝锂合金腐蚀行为及其元胞自动机模拟
郭 一 田 干 刘德俊 张有宏 常新龙
火箭军工程大学导弹工程学院,西安,710025
0 引言
为缩短液体导弹发射前的准备时间,提高其机动性和快速应对战争的能力,长期加注贮存的模式已经成为液体战略导弹的发展趋势。N2O4作为火箭推进剂的一种常用组分,在各种航天飞行器上广泛应用。N2O4在生产和使用的过程中极易吸收水分生成HNO3[1],从而对金属产生腐蚀[2]。空气动力学领域中,2195铝锂合金是一种理想的轻质高强度结构材料[3-4],被NASA用于制作航天飞机的低温推进剂罐。
多项研究表明,铝锂合金比常规铝合金具有更好的耐蚀性[3,5],但Li元素会导致合金复杂的腐蚀行为[6]。铝锂合金选择性腐蚀的产生与析出加强相在晶体中的分布息息相关[7-8]。目前,对铝锂合金在酸性介质中的腐蚀研究报道较少[9-11]。无应力加载条件下,铝锂合金一般为局部腐蚀(包括点蚀和晶间腐蚀)。腐蚀坑小而浅时,腐蚀前沿的阳极电解液极易被整体介质的对流带走,使得基体溶解停止,腐蚀坑出现钝化[12];随着腐蚀时间的延长,腐蚀坑的深度、个数增长速率减缓[13]。
近年来,元胞自动机逐渐用于金属腐蚀领域,为研究金属的腐蚀损伤机理提供了新的思路。CAPRIO等[14]使用元胞自动机描述了金属的局部腐蚀和均匀腐蚀,为深入了解动力学和腐蚀前沿形貌之间的关系提供了依据。PÉREZ-BROKATE等[15]基于介观元胞自动机,从点蚀坑尺寸、形貌和电解液的酸度来研究点蚀的演变。
为探究2195铝锂合金在模拟推进剂条件下的腐蚀历程,笔者通过电化学测试技术和全浸试验对2195-T8铝锂合金在HNO3中的腐蚀机理进行分析,使用电化学交流阻抗法和电化学极化法,改进腐蚀过程中的拟合等效电路,得到合金在HNO3中的腐蚀动力学参数。最后,基于改进的Logistic分布概率的元胞自动机对合金在HNO3中的腐蚀过程进行模拟。
1 试验与模型建立
1.1 试剂与仪器
试验的试剂如下:HNO3(AR级,质量分数为63%~65%)、耐博检测技术(上海)有限公司生产的CM-3快速环氧王(树脂+固化剂)、国标单股芯BV1.5铜导线、双面胶导电布、双导铜箔胶带。
试验仪器有M-ET型分析天平、扫描电镜/能谱仪、电化学工作站、智能恒温槽、R0232饱和甘汞电极、L型Pt310(10 mm×10 mm)辅助电极、电解池。
1.2 试样的制备
试验材料为2195-T8铝锂合金,其化学成分的质量分数见表1。

表1 2195-T8铝锂合金的化学成分的质量分数
试样尺寸为10 mm×10 mm×6 mm。试验前对试件进行预处理,基本步骤如下:脱油、200号砂纸研磨、去离子水清洗、无水乙醇清洗、干燥。然后,利用双面胶导电布和双导铜箔胶带将单股铜导线固定在试件表面;封装试剂选用环氧树脂调制,其中,环氧树脂与固化剂的质量比为2∶1,然后对非工作面进行封装,如图1所示。试验前,利用2000号砂纸对试样进行打磨,然后清洗、放入干燥皿中待用。

图1 封装后的电化学试样
参照GBT37306.1—2019、GBT6398—2017设计的试样如图2所示。试验前对试件预处理,其基本步骤是:除油、砂纸打磨、去离子水冲洗、酒精冲洗、试样编号、去离子水冲洗、酒精冲洗、置于烘箱中干燥(60 ℃)、在通风状态下自然冷却、称重。试件保存于干燥器,试验时取出使用。

图2 浸泡试样尺寸
1.3 试验方法
1.3.1电化学试验方法
使用电化学工作站测量极化曲线和电化学阻抗谱。试验采用经典的三电极(自制的电化学试样为工作电极,饱和甘汞电极为参比电极,网状铂电极为辅助电极)系统。将封装好的电化学试样分别浸入不同质量分数(10%~60%)的HNO3中进行测试。电化学阻抗测试的扰动电位为±5 mV,频率范围0.01 Hz~100 kHz;极化曲线测试的扫描速率为1 mV/s。
1.3.2浸泡腐蚀试验方法
采用全浸试验,将制备好的浸泡试样放入以304L不锈钢为外壳、聚四氟乙烯为内衬的自制容器并加入30%(质量分数η,下同)的HNO3,介质容量与试样表面积的比控制为20~200 mL/cm2。然后将容器压紧、密封,浸入水浴恒温槽(温度设为20 ℃)。每隔1 d、3 d、7 d、15 d和31 d分别取出3组平行试样,清洗干燥后称重,并进行表面形貌分析。
1.4 元胞自动机模型的建立
将金属-腐蚀介质系统设定为m×n的二维空间,用周期性边界条件来模拟无限空间,采用von Neumann型四方形网格对空间进行划分。系统主要包含以下几种元胞:①腐蚀电解质元胞E即HNO3溶液,位于系统的上半部分,离子元胞可在其中自由移动;②金属元胞M即2195-T8铝锂合金,位于系统的下半部分,固定不动;③氧化膜元胞O即Al2O3,位于合金的表面一层,固定不动;④H+元胞H,腐蚀反应发生的主要成分,可在E中自由移动;⑤Al3+元胞M+,生成后进入元胞E,不影响腐蚀反应的进行。
图3为系统在初始状态下的元胞示意图。每个时间步长内,可自由移动的元胞随机扩展到相邻点位。H元胞自由移动时,有以下三种情况:①邻居点位被同类元胞占据时,元胞不动,下一个步长时再随机选择一个方向;②邻居点位为M或O元胞时,H元胞占据邻居点位,生成的M+元胞进入E元胞;③邻居点位为空时,若有其他类型元胞也以该点位为目标,则H元胞不动,选择其他方向;若没有其他类型元胞以该点位为目标,则H元胞跳向该点位。

图3 系统初始状态下的元胞示意图
2 结果与讨论
2.1 电化学试验分析
图4所示为试样在不同质量分数HNO3中的极化曲线,极化曲线变化规律相似,即电流随电位的升高先降低后升高。在阴极区,试样的腐蚀电流呈现急速下降的趋势。试样表面阴极区发生的主要是析氢反应:

图4 试样在不同质量分数HNO3中的极化曲线

在阳极区,腐蚀电流历经急速升高、缓慢增长、再次急速升高三个阶段,表明在浸泡初期,试样表面存在相同的腐蚀过程,即发生铝的溶解反应:

随着腐蚀的发展,试样表面逐渐生成一层致密的腐蚀产物,对试样基体产生保护作用,此时的腐蚀电流处于缓慢增长的状态。当电极电位的继续增大至一定值时,试样表面生成的腐蚀产物膜被击穿,腐蚀介质浸入基体,腐蚀电流再次急速升高。
根据图4所示的极化曲线可得试样在不同质量分数HNO3中的自腐蚀电位Ecorr、孔蚀电位Eb、腐蚀电流密度Icorr,如表2所示。随着HNO3质量分数的增大,Ecorr呈先降低后升高的趋势。自腐蚀电位反映发生腐蚀的倾向性,试样的自腐蚀电位越低,越容易发生腐蚀。试样在30%HNO3中的自腐蚀电位最低,约为-0.22 V,表明此时的反应最为剧烈。HNO3的质量分数继续增大时,试样表面会发生钝化作用,表面形成的钝化膜延缓了腐蚀的进一步加剧。HNO3的质量分数为60%时,试样的自腐蚀电位最高,达到0.13 V,表明试样表面生成的腐蚀产物对基体的保护性最好。试样在不同质量分数HNO3中的点蚀电位都大于1.0 V,表明HNO3中有一定的钝化作用。腐蚀电流密度反映腐蚀速度的大小,能衡量合金的抗腐蚀性能,腐蚀电流越大,腐蚀越快。随着HNO3质量分数的不断增大,试样的腐蚀电流密度先增大后减小,并在30%时达到最大值2.417×10-4A/cm2,这表明试样在30%HNO3中的腐蚀速率最大。HNO3的质量分数为60%时,试样的腐蚀电流密度为0.806×10-4A/cm2,这表明即使是在钝化区,试样表面也以较高的腐蚀速率发生溶解-成膜平衡反应。

表2 试样在不同质量分数HNO3中的自腐蚀电位、孔蚀电位和腐蚀电流密度
图5为试样在不同质量分数HNO3中的Nyquist图,可以看出,试样在HNO3中的电化学阻抗谱都由一条高频容抗弧和一条低频容抗弧构成,它们分别是由试样初始表面及腐蚀后的界面所造成。在-Z″<0、Z′>0区域出现了感抗弧,曹楚南等[16]认为低频区域的感抗弧是由被钝化膜覆盖的金属表面在孔蚀诱导期产生的。溶液发生的电化学过程为简单的充放电行为,高频区域的容抗弧半径较大,表明试样此时处于钝化状态,基体表面有一层氧化膜;低频区域氧化膜遭到破坏,基体表面被电解液侵蚀,表明试样在HNO3的强腐蚀性环境中生成的腐蚀产物难以稳定存在于试样的表面,不能有效保护金属基体,因此腐蚀速率进一步提高;-Z″<0、Z′>0区域出现的感抗弧应是试样在溶解时,基体中的Li、Mg等元素以溶解-再沉积的形式在钝化膜表面形成。

图5 试样在不同质量分数HNO3中的Nyquist图
对比图5中的容抗弧半径可以看出,随着HNO3质量分数的增大,容抗弧半径先增大后减小,变化趋势与表2中腐蚀电流密度变化趋势相反,两者相互验证。30%HNO3的容抗弧半径最小。根据Stern-Geary方程可知,腐蚀速率V、腐蚀电流密度I与极化电阻Rp之间有如下关系:
V∝I=B/Rp
(1)
式中,B为Stern-Geary系数。
由于容抗弧半径近似等于Rp,而Rp与I成反比,因此可以推断试样在30%HNO3中的极化电阻最小,腐蚀反应速率最快。
结合试验中的腐蚀体系,借鉴文献[17-18],对腐蚀过程中拟合的等效电路进行改进,利用Zview软件拟合试样在点蚀诱导期的电化学阻抗谱,如图5所示。等效电路如图6所示,图中,Rs为腐蚀电解质电阻,C1、R1分别为试样表面腐蚀再沉积产物膜的电容和电阻;C2为试样基体与腐蚀再沉积产物膜的双电层电容;R2为试样表面反应电阻;R3为点蚀活性点的反应电阻;L为吸附性中间产物的感抗。

图6 试样在HNO3中拟合的等效电路
表3所示为试样在不同质量分数HNO3中的腐蚀反应动力学参数。Rs在HNO3浓度较低时相差不大;HNO3质量分数增至50%时,溶液的钝化作用明显,腐蚀减缓,腐蚀产物减少,导致Rs减小。随HNO3浓度的增大,R1先增大后减小。随着反应速率的不断增大,沉积在试样表面的Mg等元素逐渐增多,导致试样在30%HNO3中的R1最大。随着HNO3质量分数的增大,R2先减小后增大,这表明试样表面的活性先增大后减小,30%HNO3的溶解速率最大。随着反应速率的增大,试样的腐蚀程度不断加剧,腐蚀历程进入到稳定点蚀阶段。质量分数大的HNO3对铝合金有钝化作用,所以C2与n在HNO3的质量分数大于30%后不断增大。试样在HNO3中的反应速率越大,表征合金点蚀活性点的R3和中间产物吸附沉积的L越小,这表明合金的钝化膜不断变薄,直至在合金表面均匀溶解。

表3 试样在不同质量分数HNO3中的腐蚀反应动力学参数
由于试样在30%HNO3中的腐蚀最为严重,故采用SEM对动电位极化后的试样表面形貌进行观察。如图7所示,试样表面有大量且弥散均匀的点蚀坑(开口尺寸约为5~20 μm)。对表面的点蚀坑及其附近铝基体进行EDS分析,结果如表4所示。
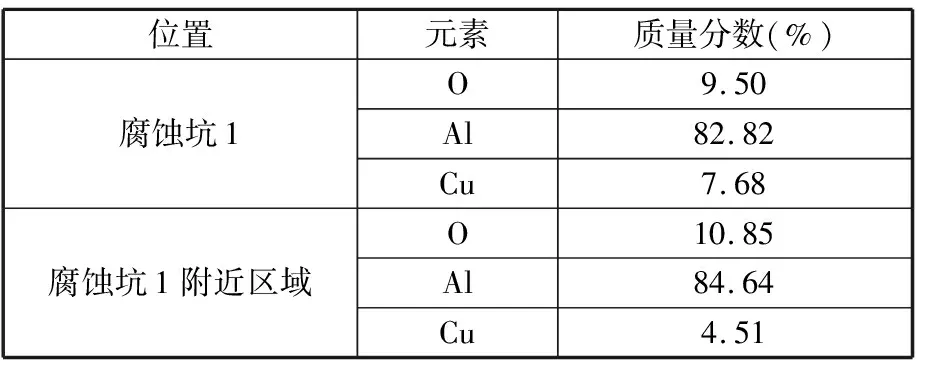
表4 试样在30%HNO3中动电位极化后典型区域的EDS结果
由图7b可以看出,点蚀坑底部有较多的白色颗粒相,初步推测为铝合金的析出相。EDS结果表明白色颗粒相中Cu的质量分数为7.68%,高于附近金属基体中Cu的质量分数,所以白色颗粒应为含Cu的析出相。由于含Cu析出相比Al基体的电极电位更高,二者之间形成腐蚀微电池,使试样Al基体在腐蚀介质中先发生腐蚀,含Cu析出相残留在基体上,从而产生图7所示的点蚀形貌。同样,由于试样中的Al基体与金属间化合物存在电位差,所以腐蚀会在基底表面形成大小不一的微电池,导致合金表面溶解速度不同。溶解过程中,合金表面的氧化膜受到腐蚀破坏,使得合金内部的θ′相局部分解[19-20]。

(a)典型区域形貌 (b)蚀坑内部
2.2 浸泡腐蚀试验分析
表5与图8分别为试样在30%HNO3中的腐蚀失重数据及失重率变化图。试样的腐蚀失重率为

图8 试样在30%HNO3中的失重率变化

表5 试样在30%HNO3中浸泡腐蚀失重数据
v=Δm/(At)
(2)
式中,Δm为试样的平均失重,mg;A为试样与腐蚀介质接触的面积,cm2;t为试样浸泡的时长,h。
随着浸泡腐蚀时间的延长,试样在30%HNO3中的腐蚀失重不断增大。在浸泡的初始阶段(1 d),试样的腐蚀失重率较小,试样表面的氧化膜等延缓了腐蚀的发生。随着浸泡时间的延长,试样表面的氧化膜被侵蚀,基体逐渐暴露在腐蚀介质中,此时,试样的腐蚀失重率在0.076 mg/(cm2·h)附近波动。结合图8中曲线可知,在浸泡中后期,试样的腐蚀失重率稳定,表明试样在30%HNO3中以恒定的腐蚀速率被侵蚀。
图9为试样在30%HNO3中的腐蚀形貌图。浸泡1 d时,砂纸打磨的痕迹清晰可见,腐蚀坑主要沿着划痕的周围排布,见图9a。图9b、图9c中,腐蚀坑的密度和面积不断增大,相邻的腐蚀坑不断聚集、扩展连成一片,形成了更大的腐蚀坑,布满了试样表面,局部范围伴随着片状剥落的现象。试样浸泡15 d、31 d后,腐蚀形貌变化较小,试样形成剥落腐蚀,腐蚀介质侵蚀下一层基体。试样在浸泡初期的腐蚀速率较慢,随着浸泡时间的延长,试样逐渐形成了剥落腐蚀,腐蚀速率较为稳定,与腐蚀失重数据相吻合。在图9e中发现大量的合金析出相,选取典型的区域进行EDS分析,其结果如表6所示。两处区域的EDS分析结果与表4的结果相似,表明析出相主要仍是合金的含铜析出相。

(a)t=1 d (b)t=3 d
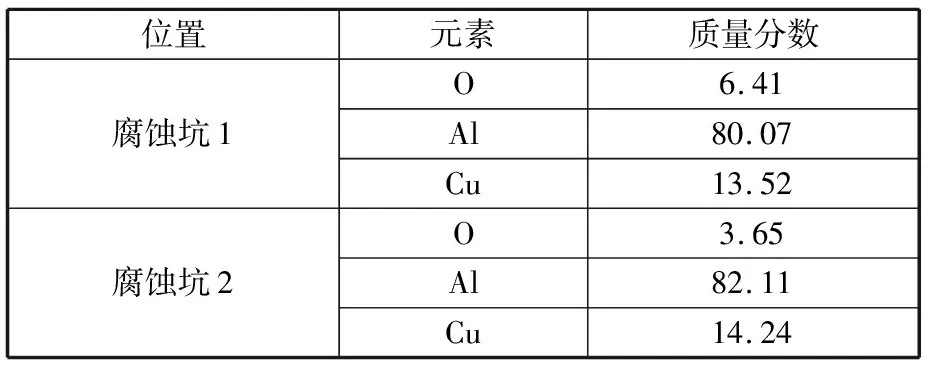
表6 试样在30%HNO3中浸泡31 d的EDS分析结果
2.3 试样在30%HNO3中腐蚀行为的仿真分析
采用元胞自动机法对2195-T8铝锂合金在30%HNO3中的腐蚀行为进行模拟,结合2.1节、2.2节的实验结果,根据合金在30%HNO3中的腐蚀机理,建立试样腐蚀损伤演化过程的模型并与试验结果相对照,以验证模型的可靠性。
基于课题组前期对铝合金腐蚀统计规律的研究,建立了Logistic分布概率[21]。Logistic分布函数为
(3)
式中,μ为位置参数;σ为尺度参数。
以Logistic分布概率为腐蚀概率临界条件,以1.4节建立的模型为基础,得到的仿真结果如图10所示,图中,黄色区域表示合金,深蓝色区域表示溶液介质,浅蓝色区域表示H+。对图10中不同模拟时间(单位为1)腐蚀的Al元胞面积及其比例进行统计,结果如表7所示。



表7 不同模拟时间步长下腐蚀的Al元胞面积及其比例
3 结论
(1)本文拟合的腐蚀过程等效电路反映了2195-T8铝锂合金在HNO3中的腐蚀历程;电化学交流阻抗谱图中第四象限出现感抗表明合金中的Li、Mg等元素以溶解-再沉积的形式在钝化膜表面形成。
(2)2195-T8铝锂合金在30%HNO3中的初期腐蚀以点蚀为主,随后合金表面的点蚀坑横向发展,逐渐形成剥落腐蚀;试样以恒定的腐蚀速率被侵蚀,腐蚀失重率约为0.076 mg/(cm2·h)。
(3)基于元胞自动机法,以Logistic分布概率为腐蚀概率临界条件对2195-T8铝锂合金在HNO3中的腐蚀过程进行模拟,仿真结果与浸泡试验中的腐蚀形貌相似,同时,Al元胞的腐蚀速率也保持恒定,验证了模型的准确性。

