饲用甜高粱青绿饲喂肉羊技术及其效应
李嘉,周恩光,王虎成
(兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业教育部工程研究中心,兰州大学草地农业科技学院,甘肃 兰州 730020)
甜高粱也被称为糖高粱,具有生物量大、适应性强,生长迅速等特性,对缓解饲料资源短缺、解决人畜争粮的矛盾具有重要意义[1-4]。在我国大力推进农业供给侧改革和“粮改饲”背景下,甜高粱作为优质的饲草作物被广泛种植,目前全国甜高粱种植规模已达50多万亩[5-6]。甜高粱青贮作为动物的粗饲料得到了广泛应用,张霞等[7]研究表明肉羊饲喂甜高粱青贮可以提高动物的肝脏健康,降低高血脂及机体酮症酸中毒等;侯明杰等[8]和王婷等[9]研究表明甜高粱青贮饲喂肉羊并未对其血液生理参数产生不良影响;李春宏等[10]和白晶晶等[11]研究表明动物饲喂甜高粱青贮和适宜精料能提高动物的采食量、日增重及饲料转化效率,育肥效果明显;邰发红等[12]研究表明甜高粱青贮能满足肉牛对优质饲草料的需求,降低饲养成本,增加经济效益;黄勇[3]等研究表明甜高粱秸秆替代部分全价饲粮能显著提高四川白鹅的生长性能、屠宰性能和肌肉品质。尽管甜高粱饲草具有诸多饲用优点,但其青绿饲料中的氢氰酸及硝酸盐可使动物产生中毒风险,且其品种及饲喂方式会对动物产生不同的效应。课题组通过生产实践调研发现,围绕甜高粱青饲肉羊是否可行,相关技术推广部门及养殖户看法不一。据农户及甜高粱饲草技术推广部门反映,在陇东地区甜高粱青绿饲料被用于肉羊的育肥并产生良好的效应,而陇中地区利用甜高粱青绿饲料舍饲饲喂肉羊时却时有中毒现象的发生。为此,本研究在全舍饲条件下,通过对甜高粱青绿饲料饲喂肉羊的生产性能、血液生理指标、瘤胃内环境参数及微生物多样性、屠宰性能和肉品质的监测,旨在研究甜高粱作为青绿饲料舍饲饲喂肉羊效应及安全饲喂技术,为其安全高效用于草食畜生产提供科学实证。
1 材料与方法
1.1 饲料
饲用青绿甜高粱为大奖3180,种子购自甘肃省农业科学院,种植于甘肃省定西市安定区香泉镇。甜高粱裹包青贮购自甘肃民祥牧草有限公司。甜高粱青绿饲料、甜高粱青贮的营养成分见表1。
1.2 动物及管理
试验于2017年8月至2017年11月在甘肃省定西市祥泰养殖场进行,选择12只2~3月龄体况一致的健康小尾寒羊(15.0±0.2 kg;♂)。饲养试验为期112 d,适应期7 d,试验期105 d分为2个阶段,第一阶段(1~20 d)试验羊自由采食刈割铡短至3 cm左右的青绿甜高粱;第二阶段(21~105 d)试验羊自由采食铡短的青绿甜高粱和甜高粱青贮,并依试羊体重的2%饲喂精料补充料[14]。试验前对试验羊只进行剪毛和驱虫,试验羊进行群饲,精补料分别为于8∶00和19∶00,分2次投喂,自由饮水,试验羊整个试验期自由舔食营养舔砖。

表1 青绿甜高粱及甜高粱青贮的营养成分(干物质基础)
1.3 测定指标及方法
1.3.1 生长性能指标 平均日增质量(ADG):于试验第1、20、105天对试验羊称质量,计算各阶段平均日增质量。
平均日干物质采食量(ADFI):在试验期内,每天准确记录试验羊的给料量、剩料量,计算平均日采食量。
料质量比(F/G):平均日采食量和平均日增质量之比即为料质量比。
1.3.2 血液生理指标 于试验的第一阶段(试验开始的第20天)和第二阶段(试验开始的第50天)分别在晨饲前经颈静脉采血1~2 mL于抗凝管中,4 h内使用全自动血液分析仪(迈瑞BC-3000plus)进行血常规分析。检测指标为白细胞数目(WBC)、红细胞数目(RBC)、血红蛋白含量(HGB)、红细胞压积(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、平均血小板体积(MPV)、血小板分布宽度(Platelet Distribution Width,PDW)。
1.3.3 瘤胃pH和微生物多样性 于试验的第一阶段(试验开始的第20天)和第二阶段(试验开始的第50天)分别在晨饲前用瘤胃液采集器(科立博A1164K)经口腔抽取相同4只羊的瘤胃液100 mL,即刻用四层纱布过滤,测定其pH后存放于-20 ℃冰箱中以备细菌多样性测定。使用Omega Stool DNA试剂盒(Y5-51304)提取瘤胃液微生物DNA,用于16sRNA V3+V4区Illumina HiSeq高通量分析(集思慧远生物科技有限公司)。微生物DNA利用细菌通用引物进行PCR扩增,引物为515F(5′-GTGCCAGCMGCCGCGG-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′),反应体系为18 μL,包括2 μL 5×FastPfu Buffer,11.8 μL ddH2O,2.0 μL 2.5 mmol/L dNTPs,上下游引物各0.4 μL,微生物DNA样品1 μL。
1.3.4 屠宰性能和肉品质指标 试验的第105天进行屠宰实验(7只),屠宰方法参照莫负涛[14],根据赵有璋[15]的方法测量并计算屠宰率、眼肌面积、背膘厚、失水率、嫩度、GR值。取背最长肌,测定肉色(日本美能达CR-400色彩计)中的亮度(L*)、红度(a*)、黄度(b*),并计算色度[C,C=(a*2+b*2)1/2][16]。并测定屠宰后45 min(pH1)和24 h(pH24)的pH(pH测定仪Testo205)、嫩度(肉品嫩度测定仪RH-N50)、失水率(系水力测定仪RH-1000)、熟肉率和滴水损失[14]。
1.4 数据处理与分析
2 结果与分析
2.1 青绿甜高粱及其青贮饲喂肉羊的生长性能
饲养试验的第10天试验羊死亡2只,第17天、第18天、第19天试验羊陆续各死亡1只,死亡率为42%。于第20天对试羊进行称质量,并选择体况相近的4只羊采集瘤胃液,同时提供甜高粱青贮及精料补充料(第二阶段开始)。第一阶段(第1~20天)试羊对青绿甜高粱的ADFI为440 g,试羊的ADG为-72.11 g;第二阶段(第21~105天)试羊对饲粮的ADFI为1 189.57 g,其中对青绿甜高粱的ADFI为209.75 g,约占饲粮的18%左右,试羊ADG为199.57 g,料质量比(F/G)为5.96(表2)。

表2 青绿甜高粱及其青贮饲喂肉羊的生长性能
2.2 青绿甜高粱及其青贮饲喂肉羊的血液生理指标
试羊血液中第一阶段的白细胞数目(WBC)显著低于第二阶段(P<0.05),第二阶段的血红蛋白浓度(HGB)与第一阶段差异不显著(P>0.05),第一阶段的平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)和平均血小板体积(MPV)极显著高于第二阶段(P<0.001),第二阶段的红细胞数目(RBC)和红细胞压积(HCT)极显著高于第一阶段(P<0.001,表3)。
2.3 青绿甜高粱及其青贮饲喂肉羊的瘤胃pH及细菌多样性
试羊2个阶段的瘤胃pH值差异不显著(P>0.05),在97%相似度水平下,2个阶段试羊的瘤胃微生物DNA序列的OUT数、Chao1指数和Simpson指数差异均不显著(P>0.05),反映2组之间的丰富度的Shannon指数差异显著(P<0.05,表4)。
试羊第一阶段和第二阶段瘤胃细菌中拟杆菌门和厚壁菌门是含量最丰富的菌门(表5)。第一阶段软壁菌门(Tenericutes)相对丰富度显著高于第二阶段(P<0.05),其他菌门在2组间的差异不显著(P>0.05)。
试羊第一阶段和第二阶段的普雷沃氏菌属(Prevotella_1)的丰富度均是最高,第二阶段琥珀酸菌属(Succiniclasticum)的相对丰度显著高于第一阶段(P<0.05),第一阶段的瘤胃球菌属(Ruminococcus_1)和丁酸弧菌属2(Butyrivibrio2)的相对丰度显著高于第二阶段(P<0.05),其他菌属相对丰度在两组间差异不显著(P>0.05,表6)。

表3 青绿甜高粱及其青贮饲喂肉羊的血液生理指标

表4 青绿甜高粱及其青贮饲喂肉羊的瘤胃pH及细菌多样性

表5 青绿甜高粱及其青贮饲喂肉羊的瘤胃细菌门水平结构

表6 青绿甜高粱及其青贮饲喂肉羊的瘤胃细菌属水平结构Table 6 Effect on the genus level of rumen bacteria of sheep feed with fresh or/and silage of sweet sorghum forage %
2.4 甜高粱饲草饲喂肉羊的屠宰性能和肉品质
试羊平均宰前活质量为32.10 kg,屠宰率为48.24%,眼肌面积为13.70 cm2,GR值为20.92(表7)。所检测试验羊的背最长肌的色度C为13.90,熟肉率和失水率分别为62.68%和14.91%,pH24(6.34)相对于pH1(6.68)降低了0.34,剪切力为8.55 kg/cm2(表8)。
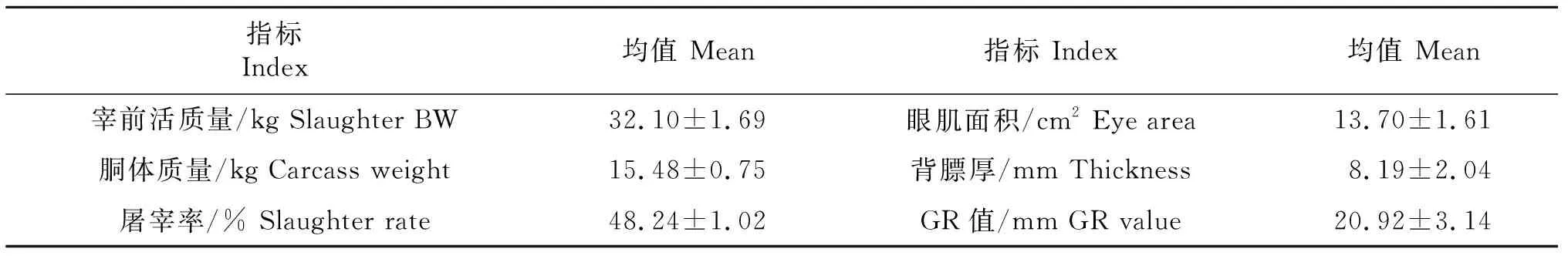
表7 甜高粱饲草饲喂肉羊的屠宰性能

表8 甜高粱饲草饲喂肉羊的肉品质
3 讨论
3.1 青绿甜高粱及其青贮饲喂肉羊的生长性能
反刍动物在饲养过程中除了给动物提供充足的粗饲料之外,适当添加精料能有效地提高动物的生长性能[17-18]。研究表明动物饲料缺乏或营养缺乏,动物会出现机体的病理性反应,造成动物生长缓慢、停滞、甚至死亡[19]。青绿甜高粱作为一种优质青绿饲粮,因其鲜嫩多汁,含糖量高,适口性好,家畜比较喜爱采食,但甜高粱生长早期植株内氢氰酸含量较高,应与其他饲料配合饲喂,避免动物发生中毒现象[20]。试验的第一阶段只饲喂甜高粱青饲,试验羊出现了体质量减轻甚至死亡的现象,这可能是该阶段试验羊只饲喂青绿甜高粱造成营养不能满足试验羊的维持需要,导致体质量下降,日增质量为负值,且甜高粱在早期生长阶段其茎叶内氢氰酸含量较高致使试验羊发生中毒死亡。房丽宁等[21]研究表明动物在饲喂鲜嫩多汁的青绿甜高粱会发生氢氰酸中毒,引起动物死亡等严重后果。在试验的第二阶段添加甜高粱青贮与精料后(此时的青绿甜高粱ADFI占日粮比例为18%)日增质量明显提高,达到199.57 g/d。朱昊鹏等[22]研究表明提高锦江黄牛精料补饲水平能显著提高日增质量降低料质量比。白晶晶[23]研究也表明饲喂饲用型甜高粱秸秆青贮和精料试验羊的日增质量效果较好,达到145.11 g/d。
该试验羊第二阶段料质量比较低,由于其补偿性增长,饲料利用率比较高,同样Ryan等[24]研究表明动物经过限饲后补偿性生长的饲料的利用效率会更高。也可能是在第二阶段试验羊大约4月龄,处于快速生长阶段。初汉平[25]研究也表明小尾寒羊4月龄左右会出现生长高峰。李志农[26]也认为羔羊的4~6月龄肌肉和体质量增长最快,饲料报酬也高。
3.2 青绿甜高粱及其青贮饲喂肉羊的血液生理指标
血液常规检测是通过对动物机体红细胞、白细胞和血小板等形态和数量的变化的测定,表明动物体生理机能及代谢状况,也是衡量动物健康的重要参考依据[27]。其经常会受到动物的品种、性别、季节等的影响[28]。白细胞数目(WBC)具有抵抗外侵细菌的能力,为身体组织和细胞间起到防御作用,是反应动物炎症的重要指标。与卢宗藩[29]研究比较表明本试验两个阶段的WBC均处在正常范围且第二阶段试验羊的WBC显著高于第一阶段,这可能是因为在采集血液时羊的应激所致,侯明杰等[8]研究表明动物WBC会受到餐后、剧烈运动、寒冷、疼痛和恐惧等影响。红细胞(RBC)、血红蛋白浓度(HGB)和红细胞压积(HCT)具有运输血液中的氧和二氧化碳的作用[30]。试验羊两个阶段的RBC均低于正常值,且第二阶段极显著高于第一阶段,红细胞压积(HCT)第一阶段低于正常范围,第二阶段处于正常范围之内且极显著高于第一阶段。这可能是因为第一阶段试验羊只饲喂甜高粱青饲致使试验羊营养不良,而第二阶段对试验羊进行补饲甜高粱青贮和精料后RBC和HGB有所恢复。Blanco等[31]研究表明动物血液中HGB和HCT随着蛋白质的摄入量减少而降低。也可能是在第一阶段时正处于当地秋雨绵绵的季节,致使试验羊HGB和HCT降低。陈付英等[32]研究均表明阴雨绵绵会使动物维持净能升高,此时应增加动物饲喂量,否则动物血液中的HGB和HCT会降低,产生病理反应。平均红细胞体积(MCV)、平均红细胞肌红蛋白(MCH)和MCHC分别反应了红细胞的色素含量、色素饱满度和体积大小,被称为贫血三项[33]。MCV和MCH在第二阶段均处于正常范围之内,第一阶段均高于正常范围且极显著高于第二阶段。这可能是因为第一阶段只饲喂了青绿甜高粱,而植物性饲料中普遍缺乏维生素B12,致使动物血液中MCV和MCH增多,动物表现为维生素B12缺乏性贫血[34]。MCHC在两个阶段均高于正常范围, 可能是在抽血时发生了溶血现象致使MCHC增多,王琳琳等[35]研究也表明抽血引起的溶血,检测结果红细胞减少,红细胞压积变低,导致MCHC增高。
3.3 青绿甜高粱及其青贮饲喂肉羊的瘤胃pH及细菌多样性
瘤胃pH是作为反映反刍动物瘤胃发酵状态最直观的一项指标,可以综合反映瘤胃微生物、代谢产物、有机酸的产生、吸收及中和的状况,正常的瘤胃pH一般维持在5.5~7.5,瘤胃稳定的pH对瘤胃内环境稳定具有主导作用。饲粮结构、唾液分泌量等都会影响瘤胃pH[36]。本试验研究表明2个阶段的羊瘤胃pH均在正常范围,且差异不显著,说明两个阶段的不同饲粮均对瘤胃pH没有产生显著的影响。瘤胃微生物在反刍动物消化吸收饲料养分、抵御病原微生物感染等方面发挥着重要作用[37]。日粮的营养水平与组成均会对瘤胃微生物产生影响[38]。周航[39]研究发现饲喂精粗比为6∶4的延边黄牛的Shannon多样性指数显著高于精粗比为7∶3的一组。高雨飞[40]研究也表明相比低精料日粮组,高精料日粮显著降低锦江公牛的瘤胃微生物多样性指数。本试验研究表明,第一阶段的Shannon多样性指数显著高于第二阶段,这说明只饲喂青绿甜高粱能提高肉羊的瘤胃微生物多样性。刘大程[41]研究表明较高的粗饲料水平能提高瘤胃纤维分解菌的数量和微生物多样性。
本试验中,门水平丰富度上2阶段羊的优势菌群基本一致,从高到低依次为拟杆菌门,厚壁菌门,变形菌门,疣微菌门,软壁菌门,其中拟杆菌门在瘤胃中丰度最高,这与Wang[42]研究结果一致。第一阶段的软壁菌门的丰度显著高于第二阶段,可能的原因是第二阶段饲粮中含有一定量的精料。刘玉洁[43]等研究表明高谷物日粮导致山羊瘤胃液中的软壁菌门的相对丰度显著低于干草组山羊。
普雷沃氏菌属在瘤胃中发挥着重要的作用,在瘤胃中属于优势菌属,在淀粉、多糖、小肽等的消化吸收方面发挥着重要作用[44]。本试验中普雷沃氏菌属在两个阶段试验羊的瘤胃中含量均最高。本试验第一阶段的瘤胃球菌属和丁酸弧菌属的相对丰度显著高于第二阶段,表明单一饲喂青绿甜高粱能提高纤维分解菌属的相对丰度。琥珀酸菌属作为主要的淀粉分解菌可以利用琥珀酸并将其转化为反刍动物的中的葡萄糖最主要的前体物质-丙酸[45]。本试验第二阶段的琥珀酸菌属的相对丰度显著高于第一阶段,这可能是第二阶段日粮中添加了精料,进而提高了琥珀酸菌属的相对丰度。刘玉洁等[43]研究表明山羊饲喂高谷物饲粮导致琥珀酸菌属相对丰度显著升高。
3.4 甜高粱饲草对肉羊的屠宰性能和肉品质的影响
日粮的营养水平与羊的屠体指标有着紧密的联系[46]。本研究试验羊屠宰时约6月龄,宰前活质量为32.10 kg,屠宰率和眼肌面积分别为48.24%和13.70 cm2,均高于初汉平[25]所测得6月龄小尾寒羊的屠宰率和眼肌面积(43.48%和13.50 cm2),说明在饲喂青绿甜高粱后,通过一定水平的补饲甜高粱青贮和精料后可使肉羊屠宰性能得以恢复,前人的研究也有佐证。如:Abouheif[47]等研究表明绵羊限饲后再对其进行补饲对绵羊的胴体质量基本没有影响;张兴隆[48]等研究也表明限饲后的育肥牛通过补偿生长能达到直线育肥牛的屠宰性能;黄勇等[3]研究也表明用青绿甜高粱秸秆替代部分基础饲粮对四川白鹅的生产性能无显著影响。
肉色是评判肉品质的重要指标之一,肌肉的色度受肌肉中的色素含量影响很大,特别是血红蛋白、肌红蛋白、不饱和脂肪酸等[49]。国际上分别以L、a、b表示肉的亮度、红度、黄度,C值表示色度值,C值越高表明肉色越鲜艳,肉色越好[50]。本试验羊C值为13.90,略高于陈晓勇等[51]所测得6月龄小尾寒羊的C值(12.57),说明该试验羊肉的肉色良好。肉的pH值是反映动物在宰后肌糖元酵解速度的重要指标,也是判断生理正常肉或异常肉质的重要依据,并受多种因素的影响[52]。高爱琴等[53]研究表明正常羊肉的pH1为5.9~6.5,pH24为5.3~5.5。本试验羊的肉pH1和pH24分别为6.68和6.34,均高于正常值,这可能与试验羊第一阶段仅饲喂甜高粱青绿饲料有关,此时的试验羊日粮中能量和蛋白摄入严重不足,虽然经过后期的补偿性生长,肉品质依然无法恢复正常。Abdullah等[54]认为日粮能量水平较低时,动物在满足自身需要外,贮存的糖原相对较少,宰后酵解消耗ATP产酸减少,pH值就变大。兰儒冰等[55]研究也表明对蒙古羊的日粮营养限制水平越高,动物恢复的越慢。
郭元等[50]研究表明6月龄小尾寒羊的熟肉率为56.96%、滴水损失为2.40%。本试验羊的熟肉率为62.68%、滴水损失为2.96%,说明此种饲喂模式可提高对试验羊的熟肉率(9.72%)但会升高滴水损失(0.56%)。该试验测得的羊肉嫩度和失水率分别为8.55 kg/cm2和14.91%,高于郭元等[50]的6月龄小尾寒羊的背最长肌嫩度4.45 kg/cm2和付晓悦[56]的6月龄小尾寒羊肌失水率13.37%。肌肉嫩度受多种因素的影响,本试验中肌肉嫩度较差可能是试验前期仅饲喂青绿甜高粱导致试验羊的营养摄入不足,抑制肌纤维细胞生长,补偿生长后,充足的能量激发了肌纤维细胞生长潜能,线粒体含量迅速增加,虽然肌纤维数量不变,但细胞生长速度超过正常水平,肌纤维细胞体积变大,肌肉的系水力减弱,嫩度变小[57]。张勇等[58]研究表明猪在限饲后再补偿生长,肌肉嫩度差于自由采食组,而且作为降低肌肉嫩度的钙蛋白抑制剂Calpastation丰度亦低于自由采食组。
4 结论
在全舍饲条件下,单一的青绿甜高粱会使试验羊发生减质量甚至死亡的后果,并增加其患维生素B12缺乏性贫血的几率,对其健康存在一定风险,但在其日粮中辅以青贮饲料和精料,会增加瘤胃中淀粉分解菌的数量并使其生长性能和屠宰性能得以改善。因此,全舍饲育肥肉羊时,甜高粱青绿饲料的比例不宜过高。

