香茅草离体快繁体系的建立
魏秋兰 肖玉菲 张晓宁 钟连香 覃子海 陈博雯 张烨 覃玉凤


摘 要:以香茅草地下茎段为外植体,研究了不同基本培养基和植物生长调节剂组合对芽诱导、增殖和生根的影响。结果表明:适于香茅草芽诱导的培养基为WPM + 6-BA 1.0 mg·L-1 + NAA 0.1 mg·L-1,芽诱导率可达81.1%;适于芽增殖的培养基为WPM + 6-BA 2.5 mg·L-1 + NAA 0.4 mg·L-1,增殖倍数达5.0;适于生根的培养基为1/2 WPM + IBA 0.5 mg·L-1 + IAA 1.0 mg·L-1,生根率达95.8 %,平均根条数5.5;经炼苗后移栽至椰糠基质中,成活率为98%。
关键词:香茅草;组织培养;离体快繁;培养基
中图分类号:Q943.1 文献标志码:A
Establishment of in Vitro Rapid Propagation System of Cymbopogon citratus
WEI Qiulan,XIAO Yufei,ZHANG Xiaoning,ZHONG Lianxiang,QIN Zihai,CHEN Bowen,ZHANG Ye,QIN Yufeng*
(Guangxi Forestry Research Institute,Nanning,Guangxi 530002,China)
Abstract:The effects of different combinations of basic media and plant growth regulators on buds induction,multiplication and rhizogenesis were studied with rhizomes of Cymbopogon citratus as explants. The results showed that the most optimum medium for induction of adventitious buds was WPM + 6-BA 1.0 mg·L-1 + NAA 0.1 mg·L-1,on which the germination rate reached 81.1% .The most optimum subculture medium was WPM + 6-BA 2.5 mg·L-1 + NAA 0.4 mg·L-1,on which the multiplication ratio was 5.0. The most optimum rooting medium was 1/2WPM + IBA 0.5 mg·L-1 + IAA 1.0 mg·L-1,on which the rooting rate reached 95.8%,and average number of roots was 5.5. The seedlings were transplanted into coconut bran substrate after being hardened-off,and the survival rate was 98%.
Key words:Cymbopogon citratus;tissue culture;in vitro rapid propagation;culture medium
香茅草(Cymbopogon citratus)为禾本科(Graminaeae)香茅属(Cymbopogon)植物,茎叶具有浓郁的柠檬香气,故又称柠檬草,是一种多年生草本香料植物[1],也是园林造景不可缺少的植物之一,具有观赏、绿化、美化等功能。香茅草全草可入药,茎叶因含有柠檬醛[2],具有调节情绪、疏风解表、缓解疼痛、清除自由基[3]、降压等功效,能治疗肌肉拉伤、头痛、肺热咳嗽等症[4]。随着健康理念的发展,集生态与药用价值一体的香茅草,市场需求量增大。香茅草的繁殖方式一般是利用根长出的幼株,从根部分株移栽,这种无性繁殖的方式速度极慢,产量很低,无法满足市场的需求,而且长期分株,操作不当,就会严重损伤根部,导致细菌感染,种源抗性降低,品质变差。采用组织培养技术,既可保持优良的品种特性,又可加快繁殖速度[5],对提高香茅草的产量和品质有很大的促进作用。目前,有关香茅草的研究主要集中在精油含量[6-9]、提取工艺[10]等方面,有关组织培养技术方面的研究报道甚少,蔡宣梅[11]以茎尖和鞠玉栋[12]以顶芽作为外植体,研究了植物生长调節剂对组培苗生长各阶段的影响。香茅草组织培养技术研究中,国内外未见报道利用地下带芽茎段作为外植体、以及除了植物生长调节剂对组培苗生长的影响外并未涉及其它影响因子的研究。本试验以香茅草地下带芽茎段为外植体,探究了不同基本培养基、植物生长调节剂组合对芽诱导、增殖和生根的影响,以及组培苗移栽基质筛选等,建立了香茅草高效组培繁殖体系,为良种苗木规模化生产提供技术支持。
1 材料与方法
1.1 试验材料及处理
香茅草采自广西林科院试验基地的优良植株,1年生,长势好,无病虫害,以地下茎段为外植体。切去叶片、根部,剥尽地下茎的叶鞘,用小软刷刷洗干净,自来水冲洗1 h,嫩茎剪成2~3 cm的茎段(带1个芽以上),按木质化程度分类置于消毒瓶内,在超净工作台上用75 %酒精消毒30 s,无菌水冲洗2~3次,再浸入0.1%氯化汞溶液消毒10 min,无菌水清洗5~6次,无菌滤纸吸干茎段表面水分接种到培养基内培养。
1.2 试验方法
1.2.1 芽诱导培养
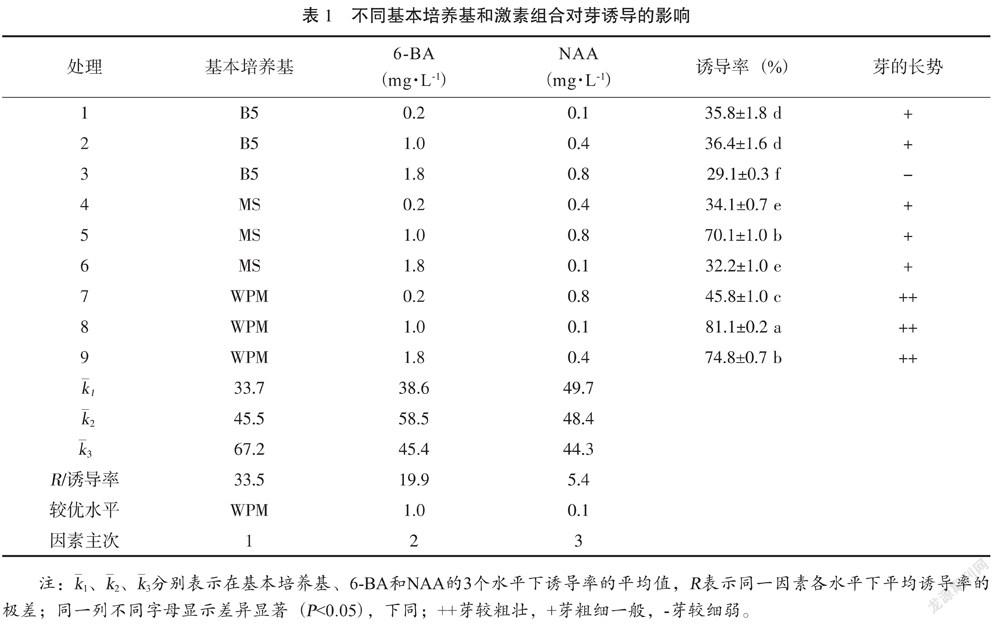
以不同基本培养基(MS、WPM、B5)、6-BA(0.2 mg·L-1、1.0 mg·L-1、1.8 mg·L-1)、NAA(0.1 mg·L-1、0.4 mg·L-1、0.8 mg·L-1)为试验因素设计L9(34)正交培养基组合,共9个处理,每个处理接30瓶,每瓶接种1个外植体,重复3次,培养30 d,观察记录芽形态特征,统计外植体萌芽率,用直观分析法筛选出最优的培养基组合。
1.2.2 芽增殖培养
1.2.2.1 不同激素组合对芽增殖的影响
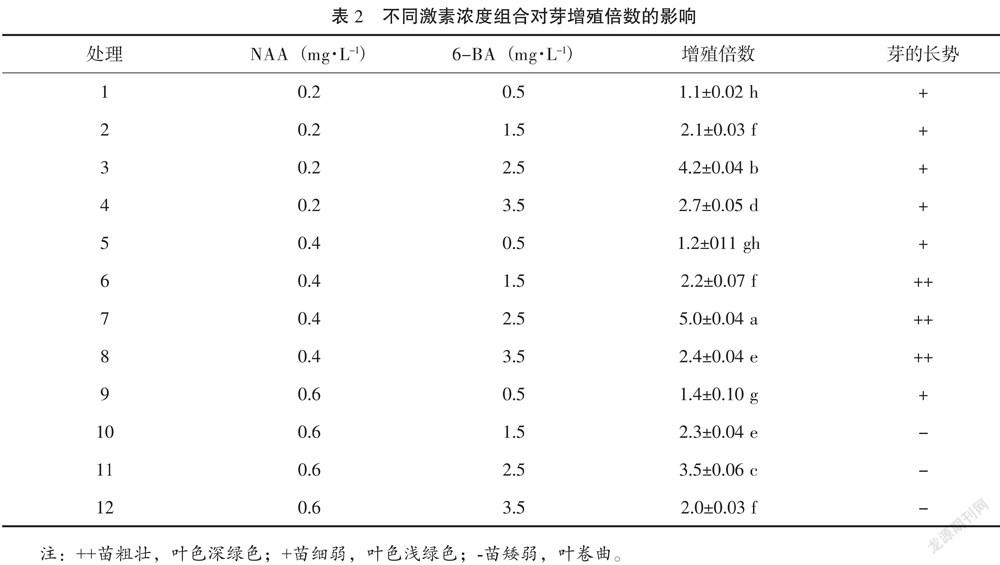
将诱导丛芽(高1~2 cm)接种于增殖培养基:基本培养基WPM,分别添加6-BA 0.5 mg·L-1、1.5 mg·L-1、2.5 mg·L-1、3.5 mg·L-1、NAA 0.2 mg·L-1、0.4 mg·L-1、0.6 mg·L-1,采用完全随机区组设计,12个处理,每个处理30瓶,每瓶接种5个丛芽,重复3次,培养30 d统计新增芽数,计算增殖倍数。
1.2.2.2 不同蔗糖浓度对芽增殖的影响
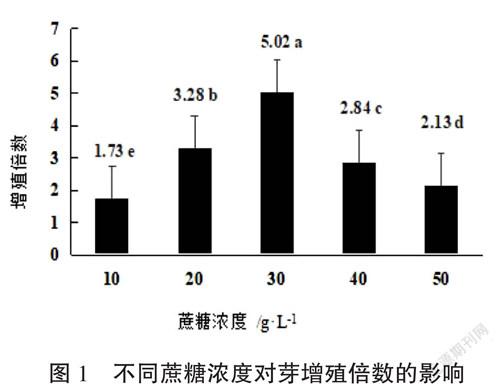
培养基采用WPM,并添加1.2.2.1筛选出的最佳激素组合、设计5个水平的蔗糖浓度分别为10 g·L-1、20 g·L-1、30 g·L-1、40 g·L-1、50 g·L-1,采用完全随机区组设计,5个处理,每个处理30瓶,每瓶接种5个丛芽,重复3次,培养30 d统计新增芽数,计算增殖倍数。
1.2.3 根诱导培养
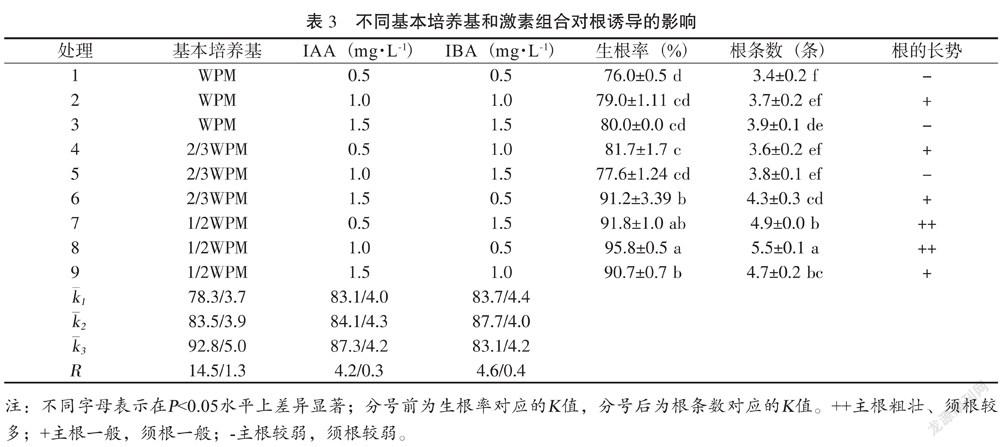
将芽接入根诱导培养基:基本培养基为(1/2WPM、2/3WPM、WPM),分别添加不同浓度的IBA、IAA和不同蔗糖浓度(见表3),采用完全随机区组设计,9个处理,每个处理6瓶,每瓶接种5个芽,重复3次,培养30 d统计生根率、生根条数,观察根系质量状况。
1.2.4 炼苗与移栽
当生根瓶苗培养30 d后,把它移入散射光下的阳光棚内,先闭盖5 d,后开盖6 d进行炼苗,移栽基质是红泥、椰糠和全沙,采用完全随机区组设计,3个处理,每个处理移栽30株,重复3次,移栽30 d后统计成活率和苗高,确定最佳的移栽基质。
1.3 培养条件
除生根培养基含蔗糖15 g·L-1,其余培养基中均含蔗糖30 g·L-1,琼脂4 g·L-1,pH值5.5~6.0,光照强度800~4 000 lx,光照时间10~12 h·d-1,温度25 ℃。
1.4 数据处理
采用Excel 2007和SPSS 20.0对数据进行处理分析,对各试验因素进行显著性分析和极差分析。
萌芽率(%)=萌芽的外植体数/接种的外植体总数×100。
增殖倍数=芽发出丛生芽的总数/接种时单芽总数。
成活率(%)=成活株数/移栽总株数×100。
生根率(%)=生根的芽数/接种的芽总数×100。
2 结果与分析
2.1 培养基对芽诱导的影响
将消毒获得的无污染带芽茎段接种于芽诱导培养基上,5~7 d茎段的芽点开始萌动,10~15 d芽体慢慢膨大长出绿色小芽,20 d芽长至1~2 cm高。从表1的多重比较可看出,各处理之间诱导率差异显著,8号处理的诱导率最高为81.1%,且苗长势好,茎粗壮,叶绿色。极差R分析表明(表1),三因素对外植体芽诱导影响大小顺序为R基本培养基>R6-BA>RNAA,表明在组织培养中,通过调整6-BA浓度和基本培养基类型是提高芽诱导率的两个关键因素。基本培养基之间对外植体芽诱导率存在显著性差异,对芽诱导影响大小顺序为WPM>MS>B5。WPM培养基对芽诱导率分别比MS、B5的高21.7%、33.5%。6-BA的3个水平之间存在显著差异,以1.0 mg·L-1 对芽平均诱导率最高,为58.5%,NAA的 3个水平之间存在显著性差异,以0.1 mg·L-1对芽平均诱导率最高,为49.7%。综合分析,芽诱导最佳培养基组合是WPM+ NAA 0.1 mg·L-1 + 6-BA 1.0 mg·L-1,芽诱导率最高为81.1%。
2.2 芽增殖培养
2.2.1 不同激素组合对芽增殖的影响
由表2可知,当NAA质量浓度由0.2 mg·L-1提高到0.4 mg·L-1时,芽增殖倍数随之提高,NAA质量浓度提高到0.6 mg·L-1,芽的增殖倍数随之降低,芽的愈伤组织出现较明显;同一浓度NAA中,6-BA质量浓度由0.5 mg·L-1增加到2.5 mg·L-1时,芽的增殖倍数随之提高,当6-BA质量浓度达到3.5 mg·L-1时,芽的增殖倍数随之降低。不同濃度6-BA和NAA组合对香茅草芽增殖倍数的影响各处理之间差异显著。7号处理的芽增殖倍数最大为5.0,从芽的长势看,苗健壮,叶色深绿色。因此,最适于香茅草芽增殖的激素组合是7号处理,即NAA 0.4 mg·L-1+6-BA 2.5 mg·L-1。
2.2.2 不同蔗糖浓度对芽增殖的影响
由图1可知,不同蔗糖浓度对香茅草芽增殖倍数的影响差异显著,增殖倍数随着蔗糖浓度的增加出现先上升后下降的趋势。当蔗糖浓度由10 g·L-1增加到30 g·L-1时,芽增殖倍数随之上升,最高增殖倍数是5.02(30 g·L-1),蔗糖浓度超过30 g·L-1时,芽的增殖倍数随之下降。从芽生长状况来看,当蔗糖浓度小于30 g·L-1时,芽的长势状态不佳,芽弱小,叶浅黄色,当蔗糖浓度大于30 g·L-1时,芽生长一般,但叶明显出现玻璃化现象,当蔗糖浓度为30 g·L-1,芽生长旺盛、健壮,叶深绿色。综合来看,香茅草芽的增殖培养基中蔗糖浓度最佳为30 g·L-1。
2.3 根诱导培养
将株高2~3 cm、健壮的继代单芽分别接入表3的生根培养基中,诱导生根。由表3可知,不同基本培养基、IAA和IBA组合对香茅草生根率和根条数的影响差异均显著。极差R分析表明,3个因素对生根率影响,各因素极差分别为R基本培养基=14.5,RIAA=4.2,RIBA=4.6,即3因素影响生根率的主次关系为:R基本培养基>RIBA>RIAA,则影响生根率的最优培养基为:1/2WPM+IBA 1.0 mg·L-1+IAA 1.5 mg·L-1,培养30 d,生根率达90.7 %。
针对根条数这个指标,各因素的极差分别为:R基本培养基=1.3,RIAA=0.3,RIBA=0.4,即3个因素影响由主到次依次为:R基本培养基>RIBA>RIAA,则最优培养基为:1/2WPM+IBA 0.5 mg·L-1+IAA 1.0 mg·L-1,生根条数为5.5。
从根系质量状况来看,7号和8号处理的根系质量较好,主根健壮,须根分明、生根条数较多,根部产生的愈伤组织非常少。综上所述,根诱导最佳培养基为8号处理,即1/2WPM+IBA 0.5 mg·L-1 +IAA 1.0 mg·L-1,生根率为95.8%,生根条数为5.5。
2.4 炼苗与移栽
从表4可看出,栽培基质对香茅草移栽成活率的影响差异显著,处理3的移栽成活率最高达98%,平均苗高5.7 cm,明显高于其它处理。对苗高的影响,红心土和椰糠基质之间差异不显著。综合分析得出,移栽效果最好的基质是椰糠。
本研究已经建立了一套香茅草离体快繁体系(图2),并在生产实践中应用。
3 讨论与结论
植物细胞具有全能性,任何完整的单个植物细胞都有可能形成新的完整植株。研究表明,地下带芽茎段有较强的细胞分裂能力,是最佳的外植体[13]。外植体生长阶段所需的营养主要来源于基本培养基[14],而基本培养基类型种类繁多,它们所含的营养成分各不相同。本试验采用香茅草地下带芽茎段为材料,通过MS、B5、WPM 3种基本培养基比较表明,供试验的3种基本培养基中无机盐含量为MS>B5>WPM。含高浓度无机盐的MS培养基最不适合香茅草培养,原因可能是MS培养基中的硝酸盐、钾和铵的含量较高,尤其铵和硝酸盐对不少培养物的生长有抑制作用,而含低浓度无机盐的WPM基本培养基是香茅草最佳的诱导和继代增殖培养基,1/2WPM是最佳的诱导生根培养基,说明低浓度无机盐更有利于香茅草培养。张树河[15]研究了香茅草离体快速繁殖,以茎尖为外植体、MS为基本培养基,并附加6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1作为增殖培养基,得到香茅草丛生芽的增殖倍数是4.05,与本试验的结论(增殖倍数5.0)不一致,可能是与采用香茅草外植体不同有关或同一种植物不同器官的细胞中所含的激素水平不尽相同也有关。
植物生长调节剂的合理组合对不定芽的萌发、增殖及生根有较大的影响作用[16]。在植物组织培养中,广泛应用的生长调节剂是细胞分裂素和生长激素[17],通过调节培养基中激素组合的含量,使芽分化速度和增殖倍数大大提高,缩短种苗繁殖时间,并且可保持品种的优良品质和提高产量[18]。本试验6-BA和NAA联合使用,芽诱导的培养基为WPM+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1,诱导率高达81.1%以上,继代增殖培养基为WPM+6-BA 2.5 mg·L-1+NAA 0.4 mg·L-1,增殖倍数达5.0,且芽生长旺盛、粗壮,根诱导的培养基为1/2 WPM+IBA 0.5 mg·L-1+IAA 1.0 mg·L-1,生根率达95.8%以上,平均生根条数为5.5,根系质量效果较好,可见提高了香茅草的萌芽率及增殖倍数,与上述结论相一致。
移栽是植物組织培养至关重要的环节,苗的根系质量以及移栽前炼苗和基质选择对移栽成活率有很大的影响[19],如果不注意以上关键环节,很可能导致成活率急剧下降,造成不必要的经济损失。组培瓶苗在室内恒温、无菌的优越环境条件下培养,体表的保护组织很薄、蒸腾速率和净光合速率很低,幼苗抗逆能力弱,适应外界能力很差[20]。本试验发现,提高组培苗移栽成活率的关键是移栽前进行组培苗炼苗,炼苗方式是选择在室外散射光的大棚里、闭盖炼苗5 d、开盖炼苗6 d,这种方式很大程度上提高了组培苗对外界环境的适应能力。此外,选择合适的移栽基质并对基质消毒也是提高组培苗成活率的重要因素。研究结果表明,移栽在沙、红心土基质中的组培苗成活率比在椰糠基质中的成活率低,椰糠基质中的成活率达98%以上,平均苗高5.7 cm,根系发达、苗健壮、叶深绿色,这可能与椰糠疏松透气性强,并含有苗生长所需的丰富养分有直接关系,而移栽在全沙基质中的组培苗,成活率和苗高表现均较差,可能是因为全沙的储水能力弱且含氧少的原因导致。
参考文献
[1] 陈宗良,庄华德.中国植物志(第十卷,第二分册)[M].北京:科学出版社,1997:197.
[2] Nakahara K,Alzoreky N S,Yoshihashi T,et al. Chemical Composition and Antifungal Activity of Essential Oil from Cymbopogon nardus (Citronella Grass)[J]. Japan Agricultural Research Quarterly,2003,37(4):249-252.
[3] 梁芳,叶绘晟,龚志强,等.广西与云南两地香茅草含量测定及清除自由基能力的研究[J].湖南师范大学自然科学学报,2020,43(1):63-67.
[4] Billerbeck V G,Roques C G, Bessière J M,et al. Effects of Cymbopogon nardus (L.) W. Watson essential oil on the growth and morphogenesis of Aspergillus niger.[J]. Canadian Journal of Microbiology,2011,47(1):9-17.
[5] 陳晓明,莫尚伟,蓝肖,等.杉木组织培养茎段灭菌技术[J]. 广西林业科学,2014,43(4): 426-430.
[6] 刘晓宇,陈旭冰,陈光勇. β-石竹烯及其衍生物的生物活性与合成研究进展[J].林产化学与工业,2012,32(1): 104-110.
[7] Rocha K A D S,Rodrigues N V S,Kozhevnikov I V,et al. Heteropoly acid catalysts in the valorization of the essential oils:Acetoxylation of β-caryophyllene[J]. Applied Catalysis A General,2010,374(1-2):87-94.
[8] Jevgeni P, Joona N,Iuka k et al. Preparation of beta-caryophyllene oxidation products and their determination in ambient aerosol samples[J]. Analytical and Bioanalytical Chemistry,2008,390(3):913-919.
[9] 赵建芬,韦寿莲,陈子冲.香茅草挥发油的提取及其化学成分分析[J].食品研究与开发,2015,36(19): 55-58.
[10] 杨帆,杨凯瑜,李科锋,等.抗氧化香茅草水提液浸提工艺的优化[J].宁夏大学学报(自然科学版),2020,41(3):279-284,290.
[11] 蔡宣梅,郭文杰.香茅草离体快速繁殖[J].中国花卉园艺,2016(22):32.
[12] 鞠玉栋,吴维坚,杨敏,等.柠檬香茅组培快繁技术研究[J]. 中国园艺文摘,2016,32(8):15-17.
[13] 刘金英,徐有明,李双来,等.佛手山药组织培养的研究[J]. 植物研究,2006,26(3):323- 328.
[14] 辜夕容,石大兴. 圆柏组织培养繁殖研究[J].亚热带植物通讯,2000,29(2):40-42.
[15] 张树河,林加耕,吴维坚,等.香茅草组织培养快速繁殖技术[J].广西热带农业,2005(5):10-11.
[16] 牟海飞,刘洁云,黄永才,等.火龙果离体培养茎段灭菌及芽诱导增殖研究[J]. 西南农业学报,2017,30(6):1439-1444.
[17] 王忠.植物生理学[M].北京:中国农业出版社,2002.
[18] 曹孜义,刘国民.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,1996:45- 50.
[19] 张静,牛喆,范卫芳,等.狭叶黄芩组织培养再生体系的建立[J]. 植物研究,2020,40(1):50-57.
[20] 刘庆昌.植物细胞组织培养[M].北京:中国农业大学出版社,2010.
基金项目:广西科技计划项目(桂科AD18281083,桂科AB18221058);广西林业科技推广示范项目(gl2018kt09)。
作者简介:魏秋兰(1973-),女,工程师,主要从事生物技术研究,E-mail:274490087@qq.com。
*通信作者:覃玉凤(1981-),女,硕士,工程师,主要从事生物技术研究,E-mail:51519198@qq.com。
收稿日期:2021-12-03

