饲喂抗生素前后7龄思茅松毛虫幼虫肠道细菌的变化
李雕益 熊忠平 包书军 李选文 熊智 罗曼




摘要:通过对饲喂抗生素前后7龄思茅松毛虫幼虫肠道细菌变化的研究,进一步探索肠道菌群变化对其生长发育的影响。采用传统的平板稀释涂布培养法从思茅松毛虫7龄幼虫肠道内分离纯化获得好氧细菌,对其进行多项生理生化测定,利用16S rDNA基因扩增技术对所得菌株进行多样性分析。结果显示,饲喂抗生素前获得4种不同的单菌落A1、A2、A3、A4,饲喂抗生素后获得5种不同单菌落B1(同A2)、B2(同A3)、B3、B4、B5,对获得的9株细菌进行基因序列测定,结果得到以芽孢杆菌属( Bacillus )、克雷伯菌属( Klebsiella )、赖氨酸芽孢杆菌属( Lysinibacillus )、微小杆菌属( Exiguobacterium )等为主的肠道细菌。其中,饲喂抗生素前所得菌为芽孢杆菌属( Bacillus )和克雷伯菌属( Klebsiella ),饲喂抗生素后细菌种类多了赖氨酸芽孢杆菌属( Lysinibacillus )及微小杆菌属( Exiguobacterium )。说明饲喂抗生素对松毛虫腸道菌群有影响。
关键词:7龄思茅松毛虫;抗生素;肠道细菌;16SrDNA;生长发育
中图分类号:S433.4;S763.42 文献标志码: A
文章编号:1002-1302(2022)07-0112-06
收稿日期:2021-07-01
基金项目:国家自然科学基金(编号:3166010405);云南省重大科技专项(编号:202002AA10007)。
作者简介:李雕益(1996—),女,云南大理人,硕士研究生,主要从事肠道微生物研究。E-mail:2697642932@qq.com。
通信作者:熊 智,博士,教授,主要从事微生物学和分子生物学研究。E-mail:zhix-swfu@qq.com。
思茅松毛虫( Dendrolimu kikuchii ),又称禇色松毛虫,隶属于鳞翅目(Lepidopera)枯叶蛾科(Lasiocampidae)松毛虫属( Dendrolimus ),因最早是在云南思茅发现而命名[1],主要分布于云南、四川、湖南、湖北、贵州等省[2],在云南主要分布于安宁、临沧、昌宁等地。思茅松毛虫是我国危害最为严重的6种松毛虫之一,是我国分布最广、危害最重的针叶类植物食叶害虫[3],具有繁殖潜能大、数量波动明显、迁移能力强、暴食性明显等特征[4]。当其大面积暴发时,会使大量松科植物枯萎死亡,状如火烧,严重影响相关地区的生态环境和旅游业,给当地人们的生产生活带来极大不便[5]。
目前,对于思茅松毛虫的防治方法主要为营林防治[6]、物理防治[7]、化学防治[8-9]及生物防治[10]。近年来,抗生素的使用,在昆虫体内产生了一定的抗药性,成为新型的防治方式。有研究表明,500 μg/mL 利福霉素、庆大霉素、氨苄青霉素、链霉素对家蚕的生长无显著影响[11];喂食抗生素后,红棕象甲的肠道菌群结构发生了明显的改变[12];氯霉素、氨苄青霉素和四环素对小菜蛾肠道的除菌能力较差[13];抗生素影响了斜纹夜蛾的消化能力[14];四环素处理后稻水象甲成虫体内的沃尔巴克体属显著降低,而经四环素、庆大霉素处理对体内的细菌无显著影响[15];杀蚜素对家白蚁具有致死作用,而井冈霉素和庆丰霉素对家白蚁无显著作用[16]。可见不同种类的昆虫,其肠道群落组成和肠道微环境不同,因此对抗生素的抵御能力有所不同。由以上结果,本研究得出采用抗生素来饲喂思茅松毛虫,可能会改变其肠道中的优势菌,使其种类发生变化,因此研究饲喂抗生素前后思茅松毛虫幼虫肠道菌的变化具有重要意义。
肠道是昆虫体内重要的消化系统,昆虫肠道菌的种类会因宿主不同存在很大的差异[17]。昆虫肠道菌的种类还会因取食食物不同而表现出不同肠道优势菌,不同昆虫肠道中的优势菌差别很大,这些差别不仅体现在种类上,同时体现在数量上,这些差异的存在对不同种类昆虫的生理、免疫等方面具有重要作用[18]。林晓丽以小菜蛾为研究对象,采用传统纯培养法和DGGE电泳法研究其肠道微生物的多样性,发现幼虫肠道中分离得到的细菌最多,且沙雷氏菌属( Serratia)和假单胞菌属(Pseudomonas )占优势地位[13]。思茅松毛虫为全变态昆虫,要经过蜕皮、化蛹、羽化,这些变化过程中肠道的外骨骼内膜要随变态过程蜕出,因此在思茅松毛虫发育的每个阶段,其肠道需要重建。 重建过程中,肠道微生物也必然随之重建,因此,思茅松毛虫幼虫肠道微生物的多样性具有很大的研究意义。
本研究从肠道细菌出发,探讨饲喂抗生素前后思茅松毛虫肠道菌的变化,初步揭示抗生素对思茅松毛虫肠道菌的改变和影响,为后续探讨菌群变化抑制思茅松毛虫宿主的生长发育,从而进一步利用抗生素开发新的杀虫剂提供依据和参考,最终达到对思茅松毛虫防治的目的。
1 材料与方法
1.1 试验材料
试验时间为2018年7月至2019年3月。
试验地点为西南林业大学生命科学学院实验室。
思茅松毛虫7龄幼虫样本(图1)采自云南省安宁市草铺镇森林地区(24°31′~25°6′N、102°8′~102°37′E),平均海拔1 968 m。根据安宁市森林的情况在方圆1 km2范围内随机挑选10个样品点,每个样品点采集7头健康7龄幼虫,共计70头,并连同7龄幼虫所在的树枝带回实验室饲养,为后续研究做准备。
1.2 分离培养基与试剂、容器
平板分离纯化培养基采用牛肉膏蛋白胨培养基(NA)[19]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15~20 g,蒸馏水定容至1 000 mL,pH值7.0~7.2,121 ℃灭菌20 min。
培养基及生理生化鉴定所用分析纯、化学试剂,均购自西陇化工股份有限公司;Ezup 柱式细菌基因组DNA抽提试剂盒,购自天根生化科技(北京)有限公司;PCR扩增体系试剂,购自硕擎生物科技有限公司。
1.3 肠道细菌的分离纯化
选取50头健康7龄幼虫,在恒温22~24 ℃、恒湿80%~85%条件下用无菌水喂养幼虫,40 h后待其排空体内食物残渣后进行试验。将思茅松毛虫幼虫置于冰上3~5 min,待其昏迷;采用70%乙醇擦拭虫体表面30 s,0.25%次氯酸钠冲泡1 min,无菌水冲洗3次;将体表消毒好的虫子固定于无菌蜡盘上,在无菌环境下操作,使用灭菌后的细尖钳将昆虫腹部剖开,取出整个肠道,并立即用0.9%无菌NaCl溶液冲洗表面2次,然后将肠道取出后置于无菌离心管中,向离心管中加入1 mL PBS缓冲液研磨成匀浆、备用。
将上述肠道匀浆吸取1 mL置于9 mL PBS缓冲液中,稀释成10-1,按照10的倍数梯度稀释,制成10-2、10-3、10-4、10-5的稀释液,吸取每个浓度稀释液100 μL分别涂布于NA培养基中,每个梯度涂3个平板,作为试验组。取最后1次清洗的无菌水100 μL涂布于NA培养基上,作为空白对照。涂板均匀后将培养平板倒置于37 ℃培养箱中培养,3 d后观察空白对照是否有菌落形成,若无菌落长出,则选择单菌落数在30~300培养皿,根据涂有肠道内容物悬液培养皿上的单菌落的不同特征,挑取单菌落至新的NA培养基平板上,采用分区划线法进行纯化,直至菌株形态基本一致,得到纯菌株。将得到的菌种保藏于NA斜面培养基中,4 ℃保存备用。取利福霉素、氨苄青霉素、链霉素、庆大霉素各0.5 g溶解于1 000 mL无菌水中,配制成混合的抗生素溶液,置于4 ℃冰箱备用。将配制的抗生素溶液均匀喷洒于油杉叶片后放入培养皿中,待7龄松毛虫食用1周后再提取其肠道细菌,方法同上,设置3个重复。
1.4 7龄幼虫肠道可培养菌株的形态观察
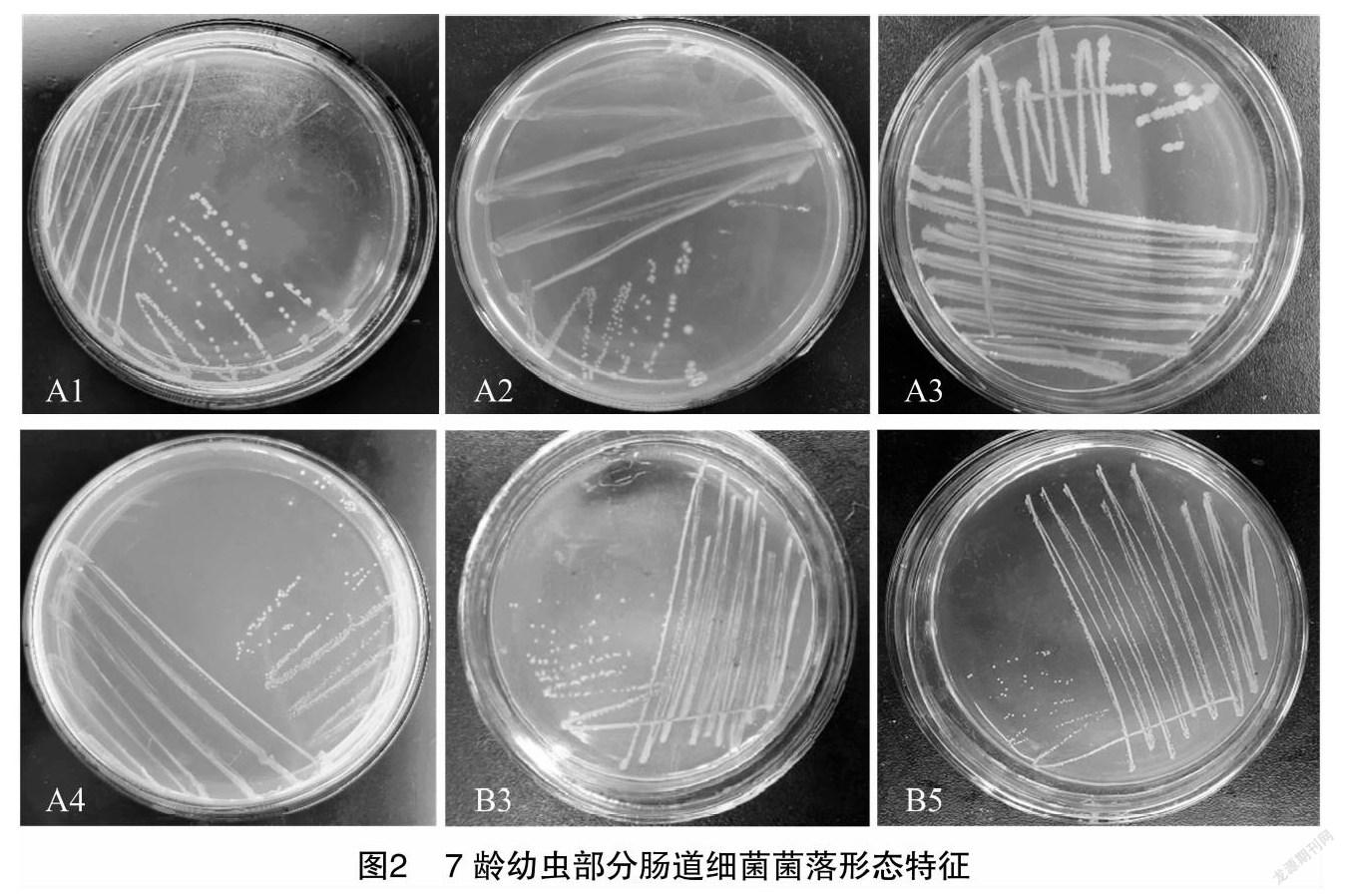
将经分离纯化得到的纯菌株用平板划线法接种于新的NA平板上,在37 ℃下培养24~48 h,待菌落长成后,参考《微生物学实验指导》[20]对菌落进行染色,并在显微镜下观察菌株的形态(图2、图3),依据《常见细菌系统鉴定手册》[21]对其特征进行描述鉴定。
1.5 7龄幼虫肠道可培养菌株的生理生化鉴定
按照朱旭芬等的微生物生理生化鉴定方法[22-23],对分离纯化后所有菌进行淀粉水解、油脂水解、明胶液化的生理生化测定及抗生素抗性测定,包括氨苄青霉素、红霉素、新霉素硫酸盐和链霉素的抗性测定。4种抗生素分别取5、50、100、300 μg/mL 等4个浓度进行抗性测定。对7龄幼虫肠道细菌进行生理生化鉴定。
1.6 7龄幼虫肠道细菌16S rDNA分子鉴定
1.6.1 肠道细菌基因组DNA提取及PCR扩增
将1 mL过夜培养的细菌菌液按照Ezup 柱式细菌基因组DNA 抽提试剂盒提取7龄幼虫肠道细菌基因组DNA。提取出的细菌基因组DNA采用1.0%琼脂糖凝胶检测,得到片段符合细菌基因组DNA大小后,将检测合格的DNA产物作为16S rDNA序列扩增模板。扩增引物[23]选择正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)。PCR扩增体系:25.0 μL 2× Taq PCR MasterMix;3.0 μL模板DNA;10.0 μmol/L 正向引物27F和反向引物1492R各1.0 μL;双蒸水补充至50.0 μL。PCR扩增程序:94 ℃ 预变性5 min;94 ℃变性1 min,56 ℃退火 1 min,72 ℃延伸3 min,30 个循环;72 ℃终延伸 5 min,-20 ℃保存。取4.0 μL PCR扩增后的产物用1%琼脂糖凝胶进行电泳检测,将检测合格的PCR扩增产物送至硕擎生物科技有限公司测序。
1.6.2 7龄幼虫肠道细菌系统发育树构建
测得的序列通过DNAMAN 6.0软件进行矫正及拼接,拼接完成后的16S rDNA序列在http://www.ncbi.nlm.nih.gov/中与GenBank数据库中的序列进行BLAST同源性比对,选出与菌株相似度最高的序列,运用软件MEGA 7.0构建Neighbor-Joining系统发育树,自检法检测1 000次判定其分类学关系。
2 结果与分析
2.1 7龄松毛虫肠道好氧细菌的分离
7龄松毛虫中肠道匀浆悬液经倍比稀释涂布培养后,松毛虫肠道细菌经4次划线纯培养后,饲喂抗生素前获得4种不同的单菌落A1、A2、A3、A4,饲喂抗生素后获得5种不同的单菌落B1(同A2)、B2(同A3)、B3、B4、B5,表明抗生素饲喂能有效改变松毛虫肠道菌群。
2.2 7龄幼虫肠道细菌形态特征
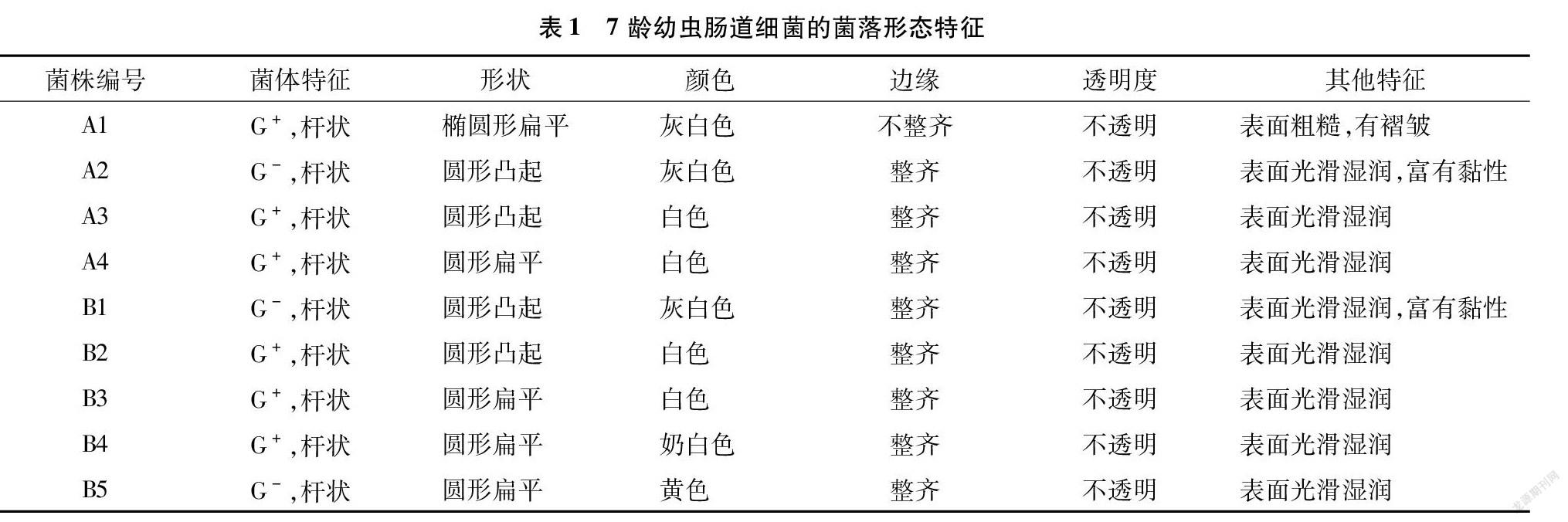
由表1可知,9株菌株中多数菌株的革兰氏染色结果呈阳性,仅有3株呈阴性。所有菌株均为杆状;大部分菌株边缘整齐,A1边缘呈锯齿状;所有菌株在固体培养基上不透明。
2.3 松毛虫肠道细菌生理生化鉴定及多样性分析
经过聚类分析可知,在欧式距离3左右处,可将9个细菌类群划分为2个遗传聚类组,B4、B5自成一类,其他7个细菌类群为一类。其中,A2、B1属于一类,A1、A3、A4、B2、B3属于一類(图4)。
结合生理生化指标(表2、图4)、细菌的形态特征(图2)、菌落(图3)及显微形态特征(表1),查询细菌鉴定手册后,将分离到的9种细菌初步鉴定为:A1、A3、A4、B2、B3均属于芽孢杆菌属( Bacillus sp.),A2、B1为克雷伯菌属( Klebsiella sp.),B4为赖氨酸芽孢杆菌属( Lysinibacillus sp.),B5为微小杆菌属( Exiguobacterium sp.)。部分菌株因为菌种形态过于相似,需进行后续分子生物学鉴定。
2.4 7龄幼虫肠道可培养细菌16S rDNA PCR扩增结果
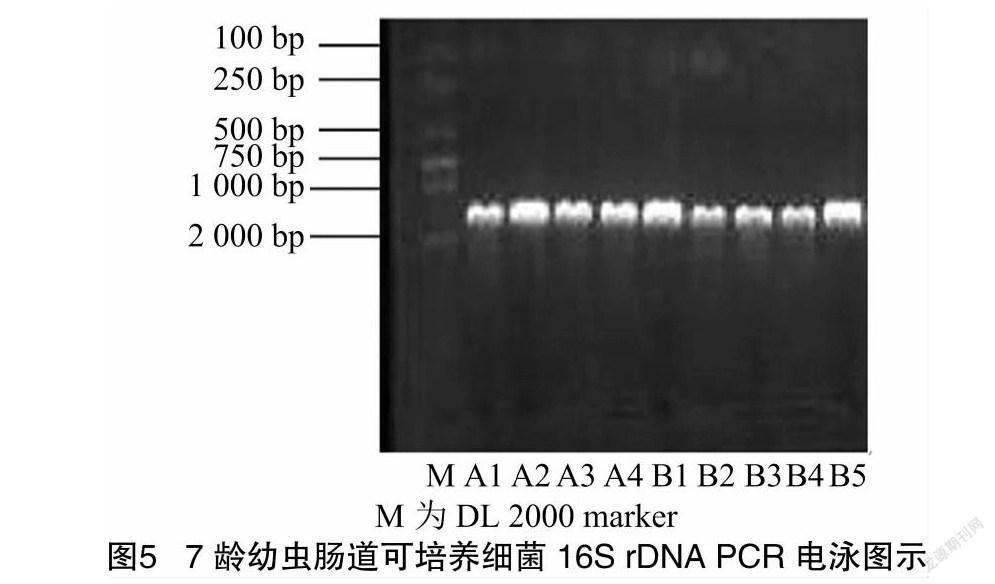
分离纯化的思茅松毛虫肠道细菌的基因组DNA检测合格后,用1.0%琼脂糖凝胶电泳检测,由图5可知,在凝胶成像系统中从左到右10个条带分别为marker、A1、A2、A3、A4、B1、B2、B3、B4、B5,PCR扩增条带清晰,均在1 500 bp左右。将PCR产物送至硕擎生物科技有限公司进行测序。
2.5 7龄幼虫肠道可培养细菌16S rDNA分析结果
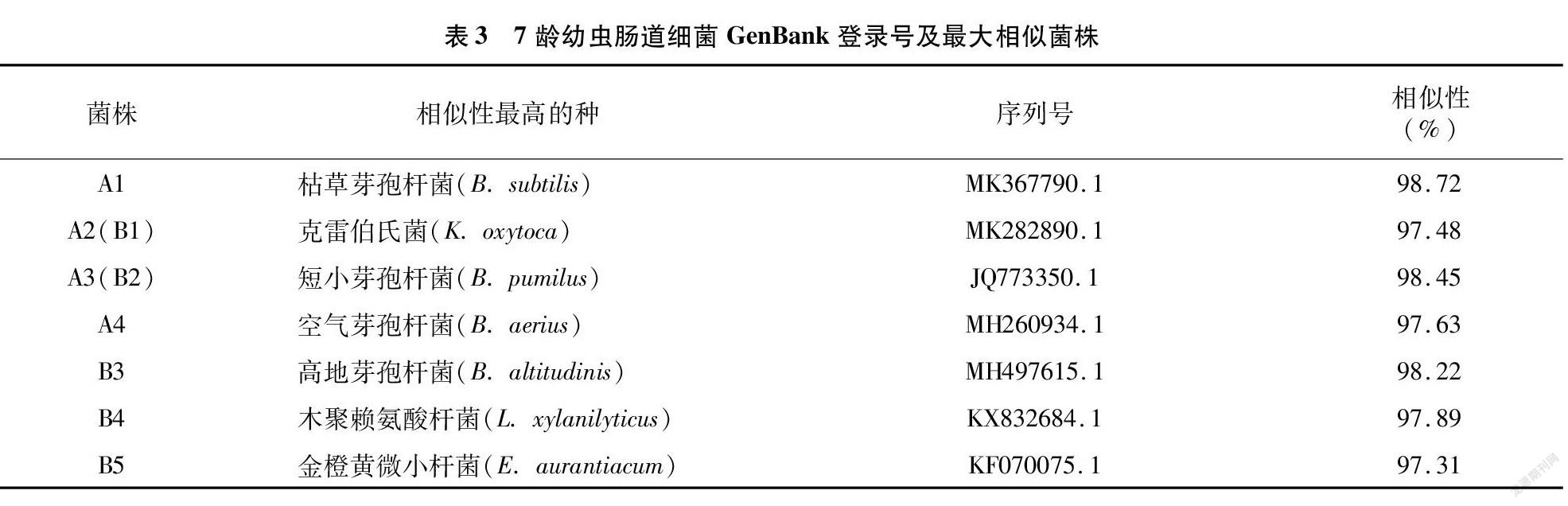
将所获9种细菌形态7龄幼虫肠道细菌16S rDNA序列在GenBank中注册,获得GenBank登录号,由表3可知,分离到7龄幼虫肠道细菌与相应菌株的16S rDNA序列相似度在97%~100%之间。隶属于4个属、7个类群,初步鉴定结果如下:A1为芽孢杆菌属的枯草芽孢杆菌( B. subtilis );A2(同B1)为克雷伯菌属的催产克雷伯氏菌( K. aoxytoca );A3(同B2)为芽孢杆菌属的短小芽孢杆菌( B. pumilus );A4为芽孢杆菌属的空气芽孢杆菌( B. aerius );B3为芽孢杆菌属的高地芽孢杆菌( B. altitudinis );B4为赖氨酸芽孢杆菌属的木聚赖氨酸杆菌( L. xylanilyticus );B5为微小杆菌属的金橙黄微小杆菌( E. aurantiacum ),相似度均>97%。这些思茅松毛虫7龄幼虫肠道细菌均不能够确定其真正的种属地位,需要做进一步研究以鉴定其分类学地位。
2.6 系统发育树
将7龄幼虫肠道细菌的16S rDNA序列进行系统发育进化分析,构建系统发育树,由图6可知,思茅松毛虫7龄幼虫肠道可培养细菌归属于2个大类,第一大类为厚壁菌门,分别为芽孢杆菌属( Bacillus sp.)、赖氨酸芽孢杆菌属( Lysinibacillus sp.)、微小杆菌属( Exiguobacterium sp.);第二大类为变形菌门,为克雷伯菌属( Klebsiella sp.)。从系统发育树状观察,这7株菌属于4个属,其中芽孢杆菌属可能是7龄思茅松毛虫肠道细菌中的优势菌株。
4 结论与讨论
采用传统培养方法对松毛虫肠道菌进行分离培养,饲喂抗生素前后共得到7株细菌,经过测序后结果属于芽孢杆菌属、克雷伯菌属、赖氨酸芽孢杆菌属和微小杆菌属。其中,6株细菌(A1、A3、A4、B3、B4、B5)归类于厚壁菌门,另外1株(A2)归类于变形菌门,这与其他鳞翅目昆虫舞毒蛾、棉铃虫、家蚕等基本一致,说明厚壁菌门和变形菌门细菌在麟翅目昆蟲中普遍存在。
课题组前期已对采自普洱市宁洱县磨黑镇健康的思茅松毛虫7龄幼虫做了关于肠道细菌的研究[24],研究表明,采自宁洱县的7龄幼虫肠道细菌共分离得到14种细菌,隶属于3个属,而采自安宁地区的7龄幼虫分离到4株肠道细菌,隶属于2个属、4个类群。从宁洱县采集的7龄幼虫的优势菌属为肠杆菌属( Enterobacteer sp.),而从安宁地区采集的7龄幼虫的优势菌属为芽孢杆菌属( Bacillus sp.),说明不同地区的思茅松毛虫具有不同的优势菌属,也有不同的菌种。
在饲喂抗生素后,7龄思茅松毛虫幼虫肠道细菌的菌种发生变化,从生态学方面分析其原因可能是抗生素影响了松毛虫肠道菌中生态位的优势菌种,使肠道菌中生态位的优势菌种发生了变化,而原来的优势菌种不再占据生态位,从而导致菌种的变化;或者是抗生素破坏了肠道中的一些竞争性菌,使肠道中产生了另外一些菌,从而使肠道菌的菌群结构发生了变化,进而导致菌种种类变多。
对7龄思茅松毛虫饲喂利福霉素、庆大霉素、氨苄青霉素、链霉素所配制成的混合抗生素溶液,其肠道群落细菌组成主要为变形菌门、厚壁菌门,而其他菌门未检出,说明7龄思茅松毛虫肠道中的其他菌门在其肠道环境中对抗生素较敏感。肠道中的部分优势菌群被抑制后,其他不受抗生素作用的菌群成为优势物种。而饲喂抗生素后芽孢杆菌属仍为优势物种,说明芽孢杆菌属在7龄思茅松毛虫幼虫肠道环境中对 500 μg/mL利福霉素、庆大霉素、氨苄青霉素、链霉素的共同作用有很强抗性。
近年来,随着分子生物学技术的发展,可不依赖纯培养通过宏基因学技术[25-26]直接对肠道细菌的总DNA进行提取,进而分析出整个肠道的细菌种类,为研究昆虫的肠道资源库提供全面的研究基础。因此,通过纯培养技术分离得到的7龄幼虫肠道细菌只是其中很少的一部分,需要结合宏基因组技术,才能得到较为全面的细菌类群。
思茅松毛虫是林业重要的害虫,对其肠道微生物的研究,不仅可以补充昆虫肠道微生物资源库,还可以据此进一步分析肠道细菌对昆虫生长发育的影响,最终得到防治思茅松毛虫的生物制剂,从而减少林业害虫的危害。
参考文献:
[1]侯陶谦. 中国松毛虫[M]. 北京:科学出版社,1987:32-34.
[2]周传良,刘雄兰,董丽云,等. 为害雪松的思茅松毛虫生物学特性及其防治的研究[J]. 华东昆虫学报,2004,13(1):111-113.
[3]马艳芳,陈升富,王金华,等. 思茅松毛虫7龄幼虫肠道好氧细菌的筛选及毒力测定[J]. 中国森林病虫,2012,31(1):1-4.
[4]张 红. 思茅松毛虫的危害与防治措施[J]. 林业调查规划,2006,31(增刊2):178-181.
[5]张荣超. 思茅松毛虫的生物学特性及防治技术[J]. 现代园艺,2015(6):63.
[6]万 鹰,刘德波,徐晓丽,等. 四种杀虫剂林间防治思茅松毛虫试验[J]. 中国森林病虫,2018,37(2):46-48
[7]陈铁刚,李 密. 思茅松毛虫湖南种群生物学特性及防治药剂筛选研究[J]. 湖南林业科技,2018,45(3):44-48.
[8]张梅秀,蒲宏春,刘 珩. 思茅松毛虫防治的试验[J]. 林业与生态,2012(1):34.
[9]冯玉元. 白僵菌防治思茅松毛虫研究[J]. 林业科技,2018,43(4):26-29.
[10]梅 承,范 硕,杨 红. 昆虫肠道微生物分离培养策略及研究进展[J]. 微生物学报,2018,58(6):985-994.
[11]王玉霞,张玉花,张志兰,等. 家蚕添食抗生素和营养素的对比试验[J]. 北方蚕业,2007,28(4):27-28.
[12]Muhammad A. 红棕象甲的肠道菌群结构及其对宿主营养代谢的影响[D]. 福州:福建农林大学,2016:113-115.
[13]林晓丽. 小菜蛾肠道细菌多样性分析及两株细菌的杀虫活性研 究[D]. 杨凌:西北农林科技大学,2014:71-73.
[14]藍波妙. 斜纹夜蛾肠道细菌多样性及其功能研究[D]. 福州:福建农林大学,2016:1-4.
[15]陆 芳. 稻水象甲体内细菌多样性及其和生殖的关系[D]. 杭州:浙江大学,2014:43-44.
[16]钟俊鸿,李丽英,戴自荣,等. 抗生素对家白蚁的毒效试验[J]. 昆虫天敌,1991,13(1):43-50.
[17]张 静,张 博. 昆虫肠道微生物研究进展[J]. 科技创新与应用,2017(5):50.
[18]黄 云,詹先进,蓝家样,等. 昆虫肠道微生物的研究进展[J]. 湖北农业科学,2009,48(11):2888-2890.
[19]王金华,李 彪,张武先,等. 五龄恩茅松毛虫幼虫的肠道好氧细菌多样性分析[J]. 应用昆虫学报,2013,50(1):230-234.
[20]黄秀梨,辛明秀. 微生物学实验指导[M]. 2版.北京:高等教育出版社,2008:48-50.
[21]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-397.
[22]朱旭芬. 现代微生物学实验技术[M]. 杭州:浙江大学出版社,2011:269-275.
[23]周德庆,徐德强,胡宝龙. 微生物学实验教程[M]. 3版.北京:高等教育出版社,2013:350-352.
[24]马艳芳,陈升富,王金华,等. 思茅松毛虫7龄幼虫肠道好氧细菌的筛选及毒力测定[J]. 中国森林病虫,2012,31(1):1-4.
[25]Wooley J C,Godzik A,Friedberg I.A primer on metagenomics[J]. PLoS Computational Biology,2010,6(2):e1000667.
[26]Long L L,Guo J J,Li P,et al. Bacterial diversity in Bercaea cruentata gut described using high-throughput sequencing[J]. Forensic Science International(Genetics Supplement Series),2015,5:e479-e481.

