葡萄VvMYBF2基因的生物信息学及表达特性分析
常 丽,刘 伟,李晓梅,3,谭 敏,3,刘政海,3,杨镕兆,3,杨兆亮,3,纪 薇,董志刚,3
(1.山西农业大学 园艺学院,山西 太谷 030801;2.山西农业大学 果树研究所,山西 太原 030031;3.山西省葡萄与葡萄酒工程技术研究中心,山西 太原 030031)
为适应生态环境,植物在生命活动中产生了一系列次生代谢物,其不仅参与植物的生长发育,且在生命活动的许多方面都起到了重要作用,可以帮助提高植物自身抗性,更好地抵御外界不良环境的侵害[1-2]。另外,由于特定的生物活性和较高的药用价值,植物次生代谢物当前被广泛应用于医药、化工、食品以及农药等工业领域[3]。
黄酮醇是植物苯丙烷代谢途径中产生的一类重要的次生代谢产物,查尔酮合酶(CHS)、查尔酮异构酶(CHI)、黄酮醇合酶(FLS)等关键酶在其生物合成积累中发挥关键作用[4]。有研究显示,MYB转录因子调控黄酮醇生物合成是在转录水平上进行的,即其可以单独或与其他转录因子形成复合体从而调节CHS、CHI、FLS等关键酶基因表达[5]。AtMYB111主要在拟南芥子叶中表达,可以激活黄酮醇生物合成过程中关键基因(CHS、F3H、FLS等)的表达,促进黄酮醇的生物合成[6]。BLANCO等[7]通过凝胶迁移和转基因研究发现,仙人掌中CcMYB12可与编码黄酮生物合成酶基因的启动子元件结合,通过激活黄酮醇生物合成基因,参与调控黄酮醇的生物合成。CAO等[8]对桃果实进行实时荧光定量发现,PpMYB15和PpMYBF1的转录水平与黄酮含量及黄酮合成酶的表达密切相关;双重荧光素酶分析表明,PpMYB15和PpMYBF1可反式激活类黄酮生物合成基因的启动子PpCHS1、PpCHI1、PpF3H、PpFLS1,调控黄酮醇生物合成及植物组织呈色。WANG等[9]通过苹果愈伤组织中的过表达和拟南芥中的异位表达确定,MdMYB22可通过直接与黄酮醇合酶启动子结合来激活黄酮醇途径。在甜橙[10]、梨[11]、苦荞[12]等物种中也进行了相关研究,因其独特的生理特性和优良的生物学功能,黄酮醇已成为当前的研究热点之一[13]。
葡萄(Vitis vinifera)是公认的最古老的水果之一,其栽培面积和产量均居世界前列,在我国栽培广泛,是重要的经济作物[14]。葡萄果实中的次生代谢物黄酮醇的含量不仅是影响其品质形成的主要因素,同时对葡萄果实中的营养成分构成也起着重要作用[15]。黄酮醇在葡萄果实中的积累以游离态和结合态2种形式进行[16],其可以调控果皮色泽及营养物质积累[17]。近年来,因MYBF基因与黄酮醇代谢相关而被重视,于2009年首次报道了葡萄中的2个MYBF序列[18]。瞬时报告基因分析表明,VvMYBF1是黄酮醇合酶1的特异性激活子,进一步证实了VvMYBF1作为黄酮醇合成的转录调控因子的功能。VvMYBF 2不同于Vv MYBF 1,它不存在黄酮醇调节因子特异性SG7基序。
鉴于VvMYBF2的特殊性以及黄酮醇对葡萄果实和葡萄酒风味和营养上的重要贡献,本研究通过对酿酒葡萄VvMYBF 2基因序列分析和表达模式分析,初步探究葡萄中VvMYBF2的表达模式及功能,以期为提高葡萄中黄酮醇含量、改善葡萄营养品质奠定基础。
1 材料和方法
1.1 试验材料
供试材料均来自山西农业大学果树研究所。所选试材为品丽珠、赤霞珠和霞多丽3个酿酒葡萄品种,采集葡萄样品包括茎(嫩茎)、叶(嫩叶)、芽(冬芽)、花(95%开放),以及成熟期的果皮与果肉。样品经液氮速冻处理后保存于-80℃冰箱备用。
1.2 试验方法
1.2.1 基因序列分析 从NCBI获取基因序列(登录号XP_002271862.1),利用Ex PASy软件对葡萄VvMYBF基因进行蛋白特性分析;通过在线分析工具Protscale对蛋白亲疏水性进行进一步分析;利用在线工具TMHMM进行跨膜结构域分析;应用SignaIP进行信号肽分析;用在线软件NetPhos 2.0 Serve预测磷酸化位点[19];利用TBtools和MEME在线软件分析基因结构和保守基序;利用54个不同葡萄组织(GSE36128)[20]中VvMYBF2基因的标准化转录物表达数据构建表达热图,以了解该基因的组织特异表达情况。
1.2.2 RNA的提取及cDNA合成 利用多糖多酚植物总RNA提取试剂盒(DP441)进行所有葡萄样品的RNA提取。使用Eppendorf BioPhotometer D30核酸蛋白测定仪检测提取的RNA的浓度及纯度。利用Go Script™Reverse Transcription System(A5000)试剂盒进行cDNA第1条链的合成。
1.2.3VvMYBF2基因的表达特性分析 根据VvMYBF2的ORF序列设计实时荧光定量PCR引物qF和q R(表1)。以品丽珠、赤霞珠和霞多丽的第1链cDNA为模板,采用q RT-PCR分析VvMYBF2的表达模式。反应体系为:c DNA模板2μL、上下游引物各0.5μL、qPCR mix 10μL、ddH2O 7μL。反应条件为:95℃预变性5 min;95℃变性20 s,60℃退火30 s,45个循环。
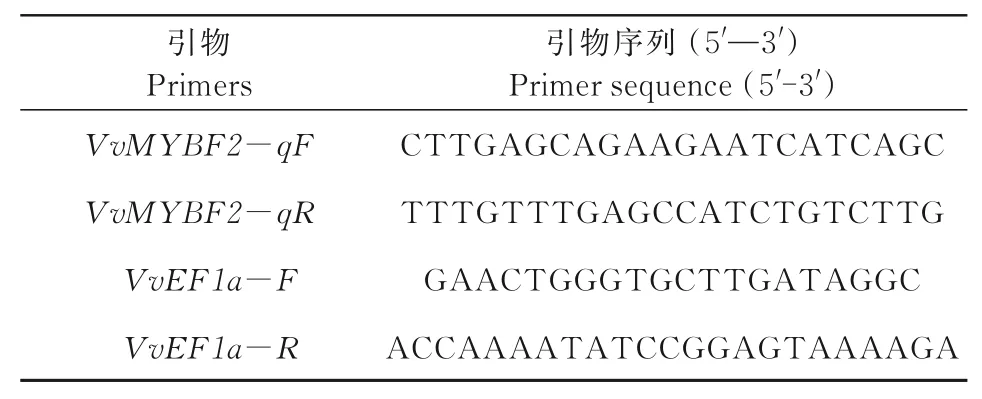
表1 VvMYBF2荧光定量所用引物序列Tab.1 Primer sequences used for VvMYBF2 fluorescence quantification
1.3 测定项目及方法
黄酮醇及其他酚类物质含量测定均采用分光光度计法,总酚和单宁含量测定采用Folin-Ciocalteu法测定[21],原花色素含量采用正丁醇-盐酸比色法测定[22],总类黄酮含量通过氯化铝比色法测定[21],参考WATERHOUSE等[23]的方法测定黄烷醇含量,黄酮醇测定参照文献[24-25]方法进行。
2 结果与分析
2.1 VvMYBF2的生物信息学分析
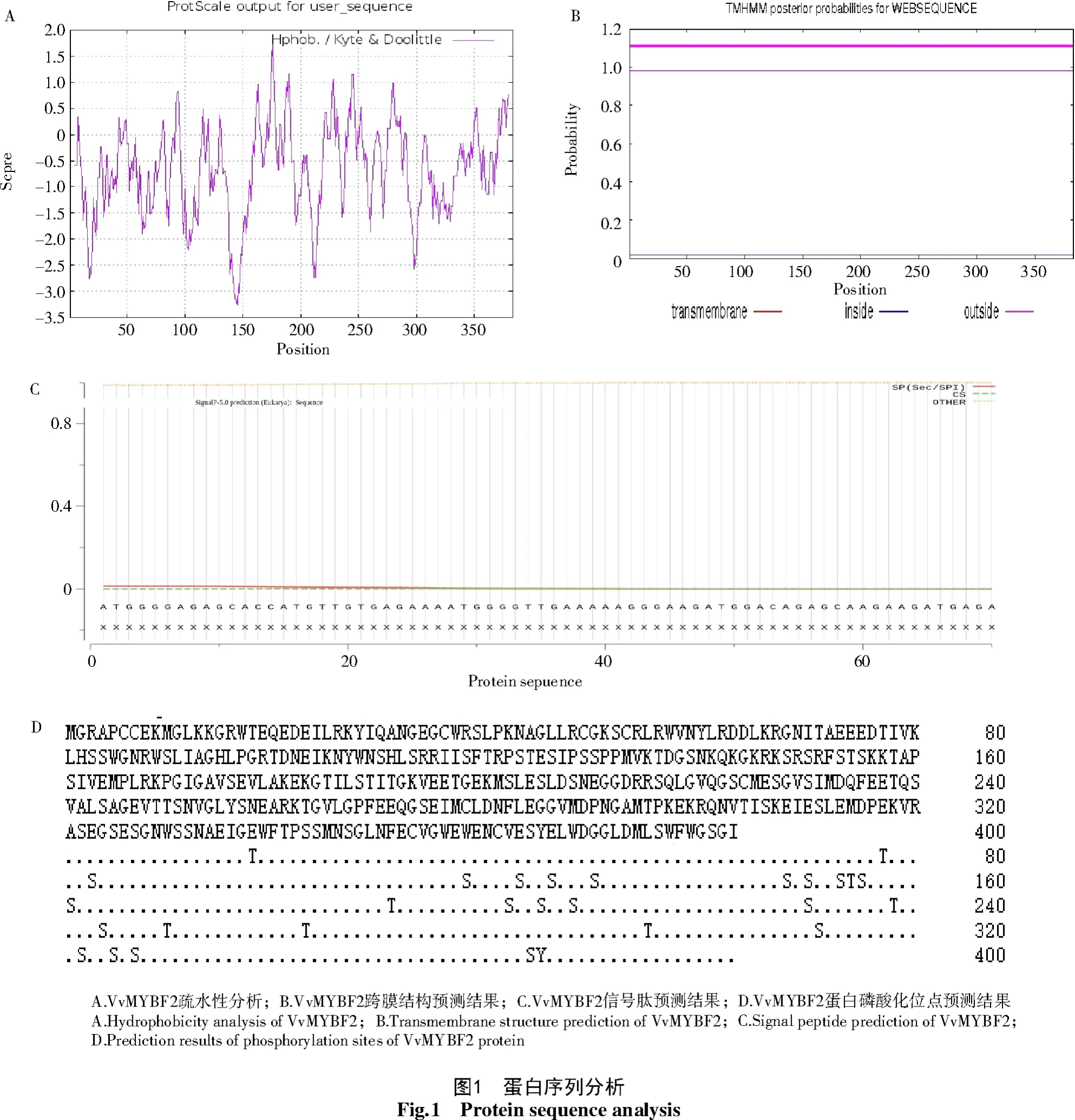
由表2可知,葡萄VvMYBF2基因编码383个氨基酸,分子质量为42.52 ku,为不稳定的酸性蛋白质。进一步分析可知(图1),亲水氨基酸(负值)稍多于疏水的(正值),该蛋白表现为亲水性;无跨膜结构域,且无信号肽存在;此外,磷酸化位点预测分析发现,该蛋白质共有29个磷酸化位点,其中,丝氨酸可能的磷酸化位点最多,为20个,苏氨酸和酪氨酸可能的磷酸化位点分别为8、1个。
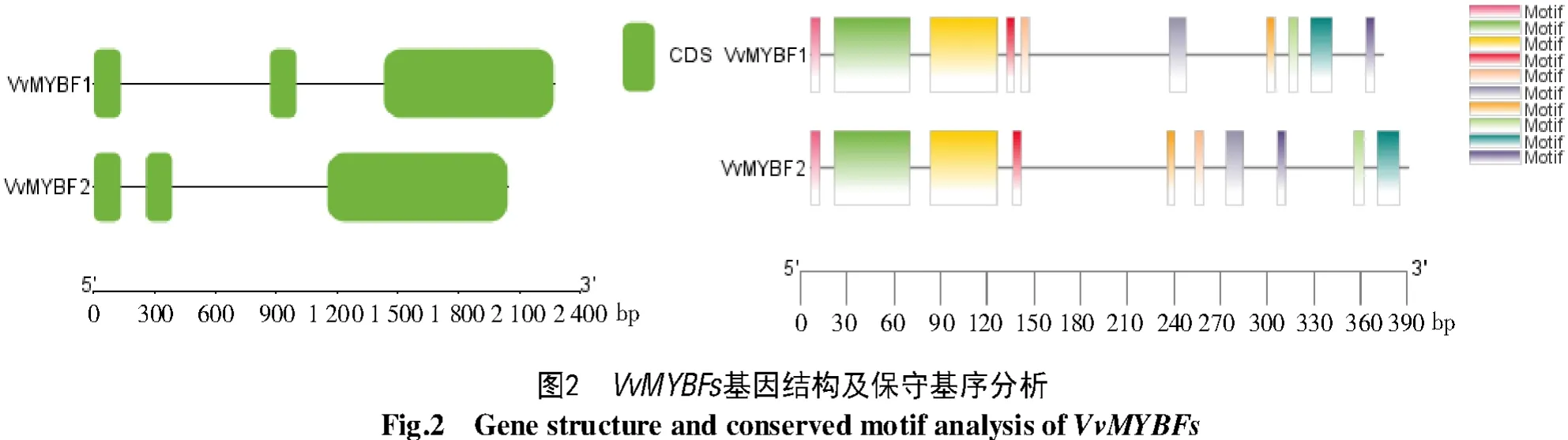
由图2可知,Vv MYBF2在染色体上的区域略小于VvMYBF1,二者都含有3个外显子,但分布存在差异,VvMYBF1的第1号和第2号外显子间隔区域较长,第2号和第3号外显子间隔区域较短;而VvMYBF2与其相反,第1号和第2号外显子间隔区域较短,第2号和第3号外显子间隔区域较长。二者均含有10个Motif,其中Motif1、Motif2、Motif3在序列上的分布一致,其余Motif分布存在差异。
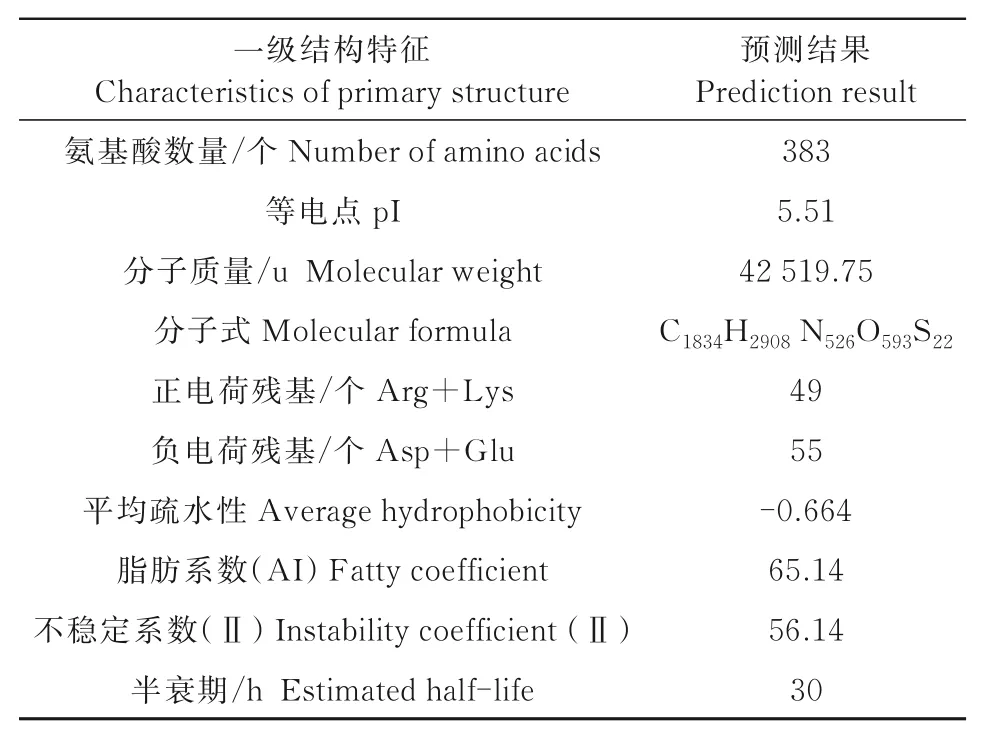
表2 Vv MYBF2蛋白质基本理化性质Tab.2 Basic physicochemical properties of VvMYBF2 proteins
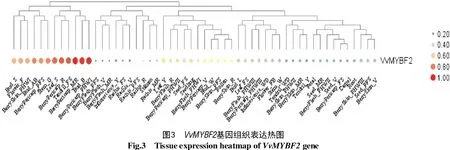
为了解VvMYBF2基因在葡萄发育过程中的作用,分析其在葡萄54个不同组织中的转录组数据,结果如图3所示。图3中从左往右依次是芽—萌芽、花—开花(50%)、外果皮—收获后枯萎Ⅰ(第1个月)、芽—芽裂、果皮—坐果后、茎—绿色茎、叶—衰老叶、果皮—成熟、卷须—成熟须(坐果)、果皮—中熟、芽—绿尖、果皮—收获后枯萎Ⅰ(第1个月)、果肉—坐果后、果肉—转色期、果肉—中熟、花序—幼花序、叶轴—坐果期、叶轴—转色期、叶轴—坐果后、叶轴—成熟、雄蕊、叶轴—中熟、叶—幼叶、果肉—成熟、果皮—收获后枯萎Ⅱ(第1个月)、种子—坐果、幼苗、果肉-收获后枯萎Ⅰ(第1个月)、果皮—转色期、芽—冬芽、外果皮—坐果后、50%以上开花的花粉、外果皮—成熟、芽—潜芽、叶—成熟叶、果肉—收获后枯萎Ⅲ(第3个月)、果皮—收获后枯萎Ⅲ(第3个月)、花序—发育良好的花序、花—开始开花(10%)、茎—木质茎、卷须—发育良好的卷须(12片叶)、外果皮-收获后枯萎Ⅱ(第2个月)、外果皮—中熟、卷须—幼卷须(7片叶)、花瓣、种子—中熟、果肉—收获后枯萎Ⅱ(第2个月)、种子—转色期、果皮—坐果期、心皮、根、外果皮—收获后枯萎Ⅲ(第3个月)、种子—坐果后、外果皮—转色期。图3结果显示,该基因在不同组织中的表达存在较大差异,其在果皮、芽、叶以及卷须中表达量相对较高,或许是参与了这些组织部位的形成发育,具体功能还需进行进一步的试验研究来验证。
2.2 VvMYBF2基因的表达分析
葡萄组织中VvMYBF2的表达量如图4所示。
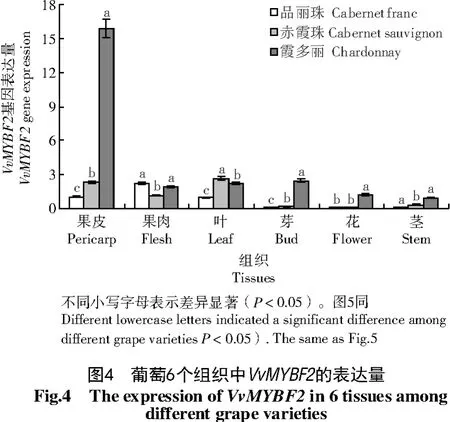
由图4可知,VvMYBF2基因在葡萄果皮的表达量最高,尤以霞多丽果皮中表达量最高,分别为赤霞珠、品丽珠表达量的6.9、15.7倍;果肉中霞多丽和品丽珠基因表达量显著高于赤霞珠(P<0.05);叶片中则相反,赤霞珠基因表达量显著高于霞多丽和品丽珠(P<0.05);其他组织中VvMYBF2基因表达量均以霞多丽显著高于赤霞珠和品丽珠(P<0.05)。
2.3 葡萄果实中次生代谢物含量分析
不同品种葡萄果实中的次生代谢物含量统计学分析如图5所示,果皮中次生代谢物含量远高于果肉;果皮中次生代谢物黄烷醇含量相对较高,原花色素含量较低,各次生代谢物含量大小在品种间均表现为赤霞珠>品丽珠>霞多丽,且差异显著(P<0.05);果肉中总酚含量较高,原花色素和黄酮醇含量极低,不同品种果肉中单宁和黄烷醇含量差异不显著,总酚、原花色素、总类黄酮和黄酮醇含量均以赤霞珠最高,其中总类黄酮和黄酮醇含量差异显著(P<0.05)。

3 结论与讨论
结构与功能之间有着密不可分的联系,结构决定生物学功能,结构相似其功能相似。本研究中,VvMYBF2基因编码了383个氨基酸,与甜橙[15]、苦荞[17]、甜荞[26]等多个物种中存在差异,可能是在进化过程中出现了丢失或增长。结构分析发现,VvMYBF2与已报道的VvMYBF1的外显子数量(3个)和Motif类型、数量(10个)相同,差别在于编码氨基酸数、外显子结构、Motif顺序;进一步组织表达特异性分析显示,VvMYBF2在果皮、果肉中表达量相对较高,与已知的VvMYBF1在浆果发育早期的芽和花中高表达、开花后表达减少有所不同,可能是由于结构细节上的差异导致了其在表达上存在组织差异。
张娟等[27]测定了果实不同部位的酚类物质,发现果皮中酚类物质含量显著高于果肉中,BAYDAR[24]等测定了果实中的黄酮醇含量,发现黄酮醇主要存在于葡萄果皮中,这些均与本试验结果一致,即这些次生代谢物主要存在于葡萄果皮中。本研究发现,不同葡萄果实中原花色素与黄酮醇变化趋势一致,且红色品种中两种物质含量显著高于白色品种,推测是红色品种中生成的二氢黄酮醇更多,因此相对合成了较多的黄酮醇与原花色素。
定量试验数据表明,VvMYBF2在红、白葡萄品种黄酮醇的合成中均有一定贡献,红色品种中VvMYBF2的表达量与其黄酮醇含量成正比,而白色品种霞多丽中VvMYBF2表达量最高但其黄酮醇含量却最低,或许由于该基因在不同品种中的表达存在差异,黄酮醇合成受多个基因调控;也可能是由于其他调控因子导致其黄酮醇含量的降低,总之对于红、白葡萄品种中的差异表达仍需进一步试验探究。CZEMMEL等[18]以西拉为试验材料,探究了果实发育过程中VvMYBF1与黄酮醇含量关系,发现该基因可促进转色前果实中黄酮醇含量的增加,进入成熟期后,该基因的表达量降低。本试验进行了不同品种成熟期VvMYBF2与黄酮醇含量分析,发现在品丽珠和赤霞珠中,该基因表达量与黄酮醇含量成正比,即该基因促进成熟期果实中黄酮醇的合成,或许VvMYBF1主要在发育早期促进黄酮醇的积累,而VvMYBF2主要在葡萄成熟期发挥作用,以提高果皮中黄酮醇含量,这还需要进一步开展果实发育动态研究来验证。另外,在品丽珠和赤霞珠中,注意到黄酮醇以外的次生代谢物含量与VvMYBF2基因的表达量一致,赤霞珠中VvMYBF2基因表达量高于品丽珠,其果实次生代谢物含量也高于品丽珠,推测该基因或许也参与其他次生代谢物的调控。
综上可知,VvMYBF2和VvMYBF1基因结构相似,但编码氨基酸数、外显子结构、Motif顺序等方面存在差异,导致二者在调控黄酮醇合成的时期及组织部位上的差异;红色品种赤霞珠和白色品种霞多丽果皮中VvMYBF2的表达量与黄酮醇等次生代谢物含量呈负相关,红色品种品丽珠和赤霞珠果皮中VvMYBF2的表达量与黄酮醇等次生代谢物含量呈正相关,说明VvMYBF2可以调控黄酮醇等次生代谢物的合成,在葡萄果皮着色上具有重要作用。

