人参立枯病拮抗菌株鉴定及其生防促生效果
张天静孙文松李 玲刘 莹刘 坤沈宝宇
(辽宁省经济作物研究所/辽宁省农业科学院药用植物研究所,辽宁 辽阳 111000)
人参(Panaxginseng)为五加科(Araliaceae)人参属(Panax)多年生草本植物[1]。根及根茎可入药,含人参皂苷Rg1(C42H72O14)、人参皂苷Re(C48H82O18)和人参皂苷Rb1(C54H92O23),具有大补元气,复脉固脱,补脾益肺,生津养血,安神益智之功效[2],被称为“百草之王”,我国人参主要分布在吉林、辽宁及黑龙江省,占全国85%以上[3]。
人参是一种在同一个地方生长缓慢的宿根植物,面临着一系列的环境胁迫,包括细菌、真菌、线虫侵染等。目前,国内外记载的人参病害已有 40 多种,我国已发现的人参病害至少有25种以上[4],严重影响了人参产业的健康发展。人参的主要侵染性病害有锈腐病(Cylindrocarponspp.)、根腐病(Root rot disease)、疫病(PhytophthoracactorumSchroet)、立枯病(RhizoctoniasolaniKuhn)和灰霉病(BotrytiscinereaPers)。由立枯丝核菌(RhizoctoniasolaniKuhn) 引起的人参立枯病又称抽死病、土掐病,易引起人参幼苗萎蔫及茎基腐烂[5],在低温多雨的条件下,该病发展蔓延极为迅速,常年发病率为8%~32%,严重者可达40%[6],是人参苗期主要病害之一。目前的防治方法主要是喷洒化学试剂,但由此易导致病原菌产生抗药性,土壤农药残留大,土壤微生物生态失衡等一系列问题,其药物残留也直接威胁人类健康[7~8],严重影响了人参产业可持续发展。通过生物防治措施可减少或抑制人参病害的发生,因其来源广泛,对人畜安全和对环境友好而备受研究者的青睐[6]。目前,国内外已筛选出多种各类中药材病害的拮抗菌株,例如人参根腐病、黑斑病等病害的拮抗菌株[9~10],但人参立枯丝核菌拮抗菌株尚未见报道。本研究于2021 年在辽宁省辽阳市用常规PDA培养基,采用平板对峙法,以31个菌株为候选拮抗菌株,以立枯丝核菌为靶标菌筛选具有拮抗作用的菌株,应用rDNA-ITS分析结合形态学鉴定确定拮抗菌株分类地位,同时设定不同培养基、碳源、氮源、温度、光照和pH值条件研究该菌株的生物学特性,并对其发酵液进行防病促生盆栽试验研究,为其生物防治和促生菌肥提供潜在的资源菌,促进人参产业健康持续发展。
1 材料与方法
1.1 材料
在辽宁省抚顺市人参种植基地采集具有典型立枯病症状的病株,采用常规组织分离法对病株进行分离、纯化,经鉴定为立枯丝核菌,作为供试标靶病原菌。供试31株拮抗菌由中国医学科学院药用植物研究所提供,是从哈巴湖荒漠和新疆及腾格里沙漠等地分离出的植物内生真菌,4 ℃斜面培养保存。
1.2 方法
1.2.1 拮抗真菌与立枯丝核菌平板对峙培养
采用四点平板对峙法测定31株生防菌对病原菌的拮抗效果,以不接拮抗菌为对照,接种后25 ℃暗培养,3次重复,用十字交叉法测量对照组和处理组病原菌菌落直径,计算抑菌率。
抑菌率=(对照组菌落直径–处理组菌落直径)/(对照组菌落直径–菌饼直径)×100%
1.2.2 拮抗菌鉴定
1.2.2.1 形态鉴定
将筛选出的拮抗效果好的纯菌株接种在PDA平板上(PDA培养基临用前加入适量链霉素以抑制细菌生长),25 ℃暗培养3~5 d进行观察,按照《真菌鉴定手册》鉴定到属[11]。
1.2.2.2 分子生物学鉴定
采用单孢分离法对菌株进行纯化,CTAB法(Saghaietal.,1984)提取基因组DNA,应用真菌通用引物ITS1和ITS4对其进行PCR扩增, PCR产物交由北京鼎国生物工程技术公司测序。得到的ITS序列在GenBank数据库中的相关序列进行比较,应用DNAStar构建系统发育树,获得最相近菌株ITS-rDNA序列作为参比菌株。
1.2.3 拮抗菌生物学特性研究
根据傅本重等方法对入选菌株进行生物学特性研究[12]。
1.2.3.1 最佳培养基
将菌龄一致的菌饼(直径5 mm),分别接种在马铃薯葡萄糖琼脂培养基(PDA)、马铃薯蔗糖琼脂培养基(PSA)、水琼脂(WA)、胡萝卜培养基(CM)、改良马丁氏(MA)、查氏培养基(CA)、麦芽浸粉培养基(MEA)、玉米粉培养基(CMM)8种供试培养基平板中央,3 d后开始采用十字交叉法测量菌落直径,连续测量7 d,3次重复。
1.2.3.2 最佳碳源
以查氏培养基为基本培养基,以不加碳源作对照,用甘露醇、蔗糖、果糖、麦芽糖、木糖、葡萄糖和乳糖中等量的碳源替换蔗糖,配制成不同碳源的固体培养基。将菌龄一致的菌饼接种到平板中央,3次重复,测量方法及培养条件同上。
1.2.3.3 最佳氮源
以查氏培养基为基础培养基,以不加氮源作对照,用尿素、硫酸铵、硝酸钾、牛肉膏和硝酸铵中等量的氮源替换查氏培养基中的硝酸钠,将菌龄一致的菌饼接种到平板中央,测量菌落直径方法及培养条件同上。
1.2.3.4 最适温度
设置5 ℃、14 ℃、20 ℃、27 ℃、34 ℃共5个处理,测量菌落直径,根据菌落直径大小分析菌株最适温度。
致死温度:设置50 ℃、55 ℃、60 ℃共3个处理,根据菌落是否扩展分析生防菌致死温度。
1.2.3.5 最适酸碱度
用1 mol/L HCl或1 mol/L NaOH将PDA培养基pH值调节至3、4、5、6、7、8、9、10、11、12共10个梯度,分析pH对菌株生长的影响。
1.2.3.6 光照
将菌饼接种到PDA平板中央,分别置于24 h全光照、12 h光暗交替和24 h全黑暗培养,培养温度25 ℃,3次重复。
1.2.4 室外盆栽防病促生试验
1.2.4.1 菌株发酵液的制备
将入选菌株接入葡萄糖马铃薯液体培养基中(PDB),170 r/min振荡5 d,菌量约为108cfu/ml。
1.2.4.2 盆栽防病促生试验
采用盆钵种植方式,供试土壤为林地土:草炭土按照2∶1混匀。供试参苗为一年生人参苗,根系消毒后进行移栽,每盆3株,3盆1组,每组3次重复。
防效作用测定:先接种立枯丝核菌菌悬液,24 h后再灌注300 ml菌株发酵液,药剂对照组施用多菌灵可湿性粉剂500倍液,空白对照为清水。
促生作用测定:在人参苗根部灌注300 ml 396拮抗菌发酵液,对照组浇灌等量清水,放置在冷棚中常规管理。
45 d后测其株高、鲜茎、叶、根质量等指标,而后于180 ℃烘干至恒重,测其茎叶干质量、根干重等指标。
人参立枯病发病程度参考罗燕娜方法分为5级[13]:
0 级,健苗;
1 级,茎基、根部局部有病斑;
2 级,1/3~1/2 的茎基、根部出现病斑;
3 级,1/2~2/3 的茎基、根部出现病斑;
4 级,枯死。病情指数和防效分别按照下列公式计算[14]
病情指数=[∑(病级株数×代表值)/(总株数×最高病级代表值)]×100;
防效=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.3 数据分析
采用Excel 2010进行数据处理,并用DPS 2005软件进行单因素方差分析,应用Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2.1 菌株室内拮抗活性
对31株菌株进行平板对峙法筛选,结果显示菌株396对人参立枯丝核菌有拮抗效果,抑菌带清晰,宽度为2.78±0.05 mm,抑制率为79.4%。
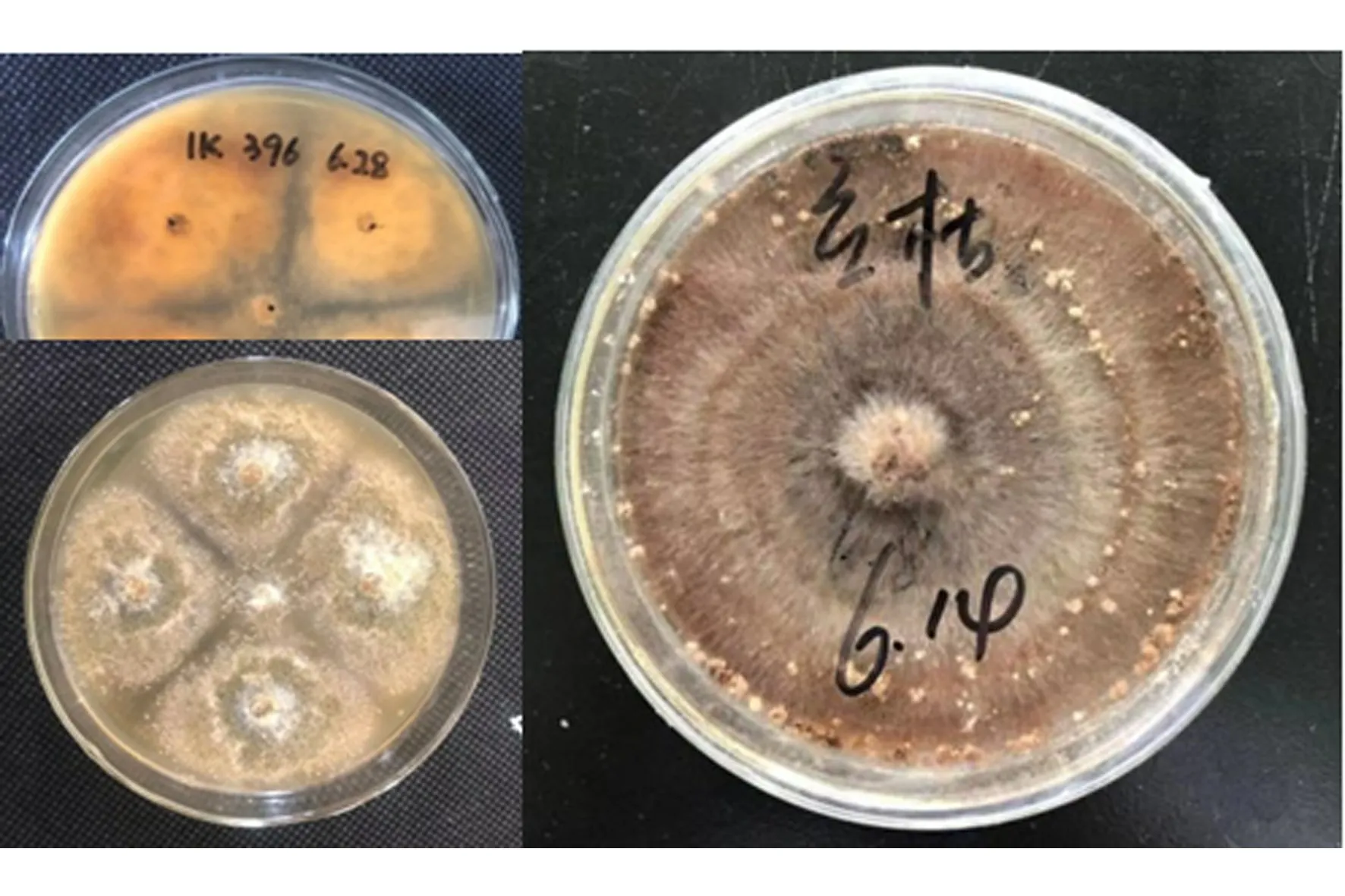
图1 菌株396与供试病原菌在PDA平板对峙培养中的菌落扩展情况Figure 1 Colony extension of strain 396 tested pathogenic fungi on dual-culture PDA plates
2.2 拮抗真菌种类鉴定
2.2.1 形态学鉴定
菌株396在PDA培养基上25 ℃培养生长速度较快,5 d可长满培养皿;菌落浅褐色,边缘常呈不整齐波裂状,菌丝有格、白色半透明,具二叉状分枝。后期平板中部上方产生大量烧瓶形或卵形黑色子囊壳,子囊壳内有大量圆形或近圆形棕色子囊,每个子囊内有8个子囊孢子,子囊孢子为单胞。依据菌落和子囊壳等特征,与《真菌鉴定手册》中相应属进行对照,初步鉴定为球毛壳(Chaetomiumglobosum)。
2.2.2 分子鉴定
采用CTAB法(Saghaietal.,1984)提取菌株396基因组DNA,应用真菌通用引物ITS1和ITS4对其rDNA-ITS基因片段进行扩增,得到1条约600 bp的片段。将测序结果提交NCBI,在GenBank上进行Blast比对,对菌株396构建该菌株的系统发育树(图2),结果表明,菌株396与Chaetomiumglobosum(MN341340、 MN592971、MN700107、MT341778、MT341778)同源性最高,聚在同一组,相似达到100%;菌株396与层生镰刀菌(Fusariumproliferatum)尖孢镰刀菌(Fusariumoxysporum)等属中种类均不在同一组中,亲缘关系较远。从分子生物学层面证明菌株396为球毛壳。
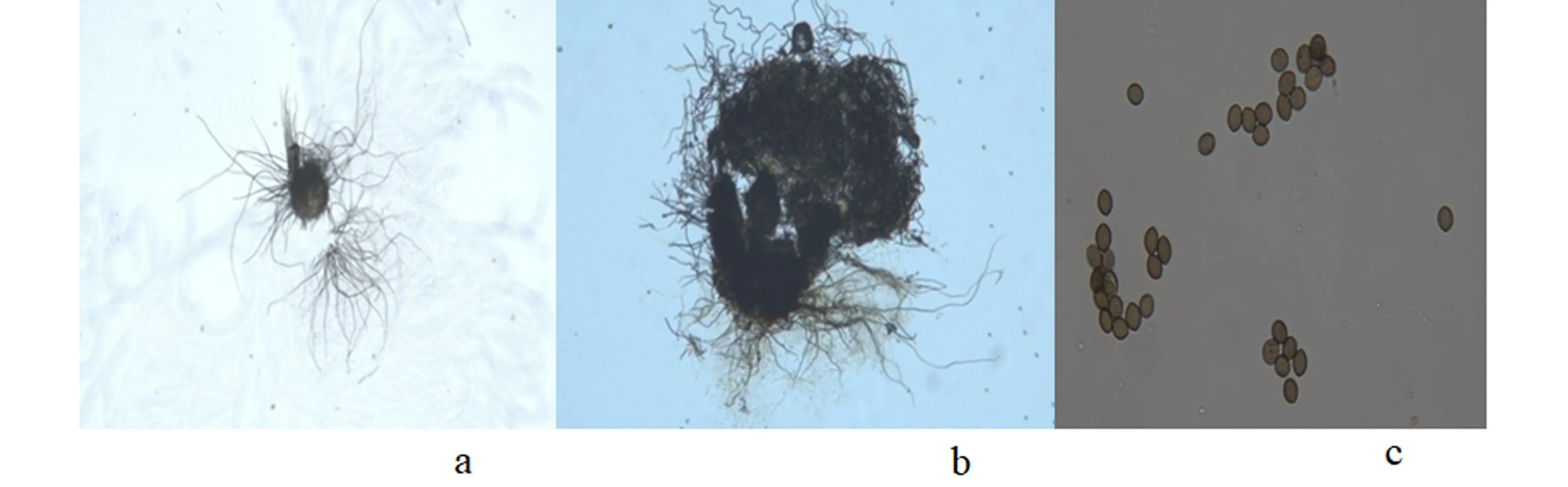
图2 球毛壳,a,b,子囊果;c,子囊孢子Figure 2 C. globosum, a, b, Perithecium; c, Ascospore
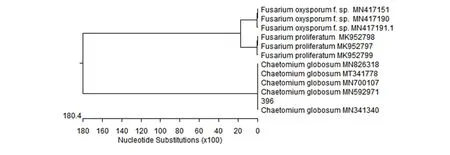
图3 基于拮抗菌396 ITS序列的系统发育树Figure 3 Phylogenetic tree of antagonistic fungi strain 396 based on ITS-rDNA sequence
2.3 人参立枯丝核菌拮抗真菌的生物学特性
2.3.1 不同培养基对菌落生长的影响
由表1可见不同培养基对菌株396菌落生长量有显著的影响,在MA、MEA和CMM培养基上生长最快,10 d均长满整个培养皿,与其他培养基相比差异显著,在MA和MEA培养基上菌丝短、致密,是培养396良好培养基,在CMM培养基上长得快,但菌丝稀疏,不适合做396的培养基。在PDA培养基上生长较好,菌落直径为55.97 mm,在PSA和CM培养基上生长明显受到抑制,生长缓慢,菌落直径仅为30.86 mm和31.26 mm。因此,该菌适宜的培养基为MA和MEA培养基。

表1 不同培养基对拮抗菌株396菌丝生长的影响Table 1 Effect of different culture media on mycelial growth of antagonistic fungus strain 396
2.3.2 不同氮源对菌丝生长的影响
如表2可见,不同氮源对菌株396的生长量有显著影响,菌株396对牛肉膏和硝酸钾利用最好,培养第9 d菌落长满培养皿,达到75 mm;在尿素和对照的查氏培养基上生长较慢,菌落直径为45.37 mm和45.68 mm,以硝酸铵为碳源的培养基上生长最慢。因此,硝酸钾和牛肉膏是菌株396良好的氮源。
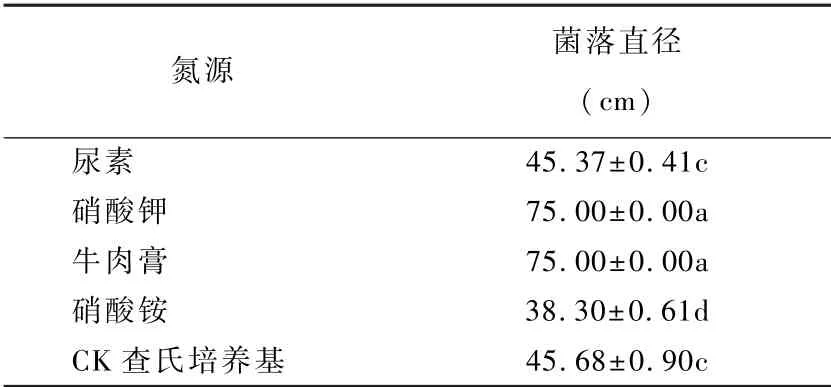
表2 不同氮源对拮抗菌株396菌落生长的影响Table 2 Effect of different nitrogen sources on mycelial growth of antagonistic fungi strain 396
2.3.3 不同碳源对菌丝生长的影响
如表3可见,不同碳源对菌株生长量有显著差异,菌株396对木糖和葡萄糖利用最好,菌落长满培养皿,达到75 mm;在果糖和乳糖上生长较快,菌落直径为57~59 mm;在甘露醇和蔗糖上生长较慢,菌落直径为43~44 mm,麦芽糖生长也很慢,仅为39.09 mm,在无糖的查氏培养基上生长最慢,10 d菌落直径仅达到31.88 mm。
表3 不同碳源对拮抗菌株396菌落生长的影响Table 3 Effect of different carbon source on mycelial growth of antagonistic fungus strain 396
2.3.4 温度对菌落生长的影响
从图4可见,不同温度对菌株的生长量有显著影响,最适宜生长温度为27 ℃,菌落直径为54.58 mm,温度为20 ℃时,菌落直径可达40.91 mm,低温5 ℃时几乎不生长,10 d培养后菌落直径仅增加1.12 mm,温度34 ℃菌落直径生长较缓慢,达到18.99 mm。
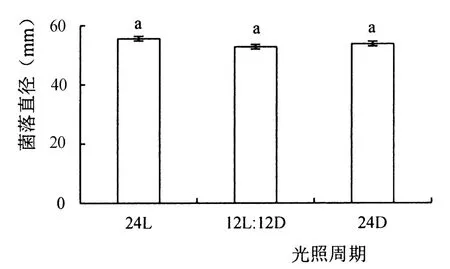
图4 温度对拮抗菌株396菌落生长的影响Figure 4 Growth of antagonistic fungus strain 396 under different temperatures
2.3.5 致死温度
菌株经过50 ℃、55 ℃、60 ℃水浴处理后菌丝生长缓慢,培养5 d后,在60 ℃水浴处理后菌丝不再生长,菌株的致死温度为60 ℃。
2.3.6 pH值对生防真菌菌丝生长的影响
由图5可见,菌株396在pH为5~11均能生长,pH为7~8时生长较好,菌落直径受pH影响较大,pH为3、4和12时菌落直径基本不增加。结果表明:该菌株最适宜pH值为7~8。
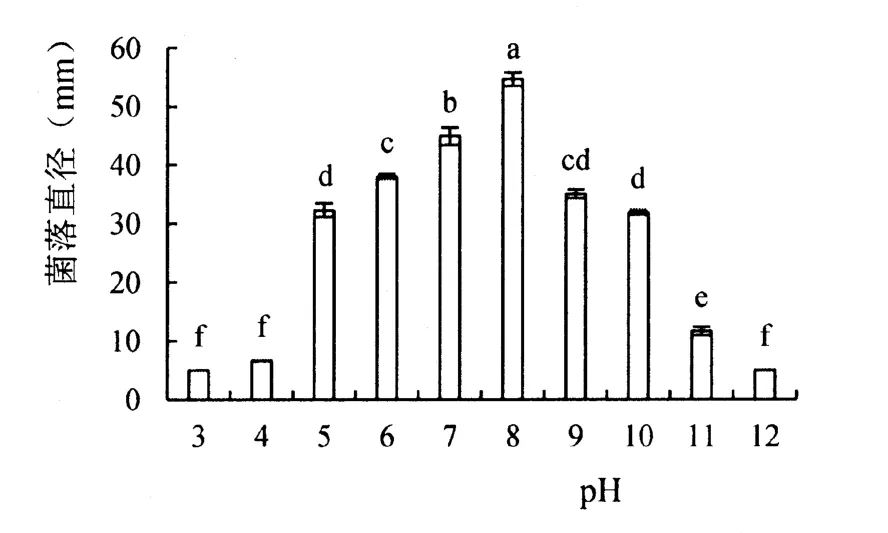
图5 不同pH条件下菌株396的生长情况Figure 5 Growth of fungus strain 396 under different pH conditions
2.3.7 光照对菌落生长的影响
由图6可见,菌株396对光周期不敏感,在12 h光暗交替、全光照、全黑暗条件培养下,菌落直径差异不显著。
图6 不同光照条件下菌株396的生长情况Figure 6 Growth of strain 396 under different light conditions
2.4 拮抗菌株396对人参立枯病盆栽防效试验结果
盆栽试验结果表明,菌株396发酵液可以使人参立枯病病情指数降低,治疗作用效果为54.74%,与农药组持平,表现出较好的防病能力。
2.5 拮抗菌株396对人参苗期生长的影响
在盆栽试验中,菌株发酵液处理后的人参,在株高、茎叶鲜质量、茎叶干质量、根鲜质量、根长和根粗与对照相比有显著差异。由表5、表6可见,株高与对照相比增加51.21%,茎叶鲜质量与对照相比增加115.02%,茎叶干质量增加47.37%,根鲜质量与对照相比增加28.74%,根长增加41.78%,根粗增加30.59%,根干质量与对照相比增加不明显。由此可见,拮抗菌株396对人参生长具有促进作用。

表4 拮抗真菌396对人参立枯病防效试验结果Table 4 Control effect of antagonistic fungus strain 396 on Rhizoctonia solani in Panax ginseng

表5 拮抗真菌396对人参地下生物量的影响Table 5 Effect of antagonistic fungus strain 396 on underground biomass of Panax ginseng

表6 拮抗真菌396对人参地上生物量的影响Table 6 Effect of antagonistic fungus strain 396 on aboveground biomass of Panax ginseng
3 讨论与结论
人参立枯病是人参苗期的主要病害之一,发生普遍且分布广泛,近年来在非林地农田栽参育苗床上发生率很高严重时可达到40%,造成参苗成片死亡,直接影响人参产量[15]。目前,防治仍以多菌灵等化学药剂防治为主,但研究表明病原菌对农药能逐渐产生抗药性,并出现用药量与病害发生程度相互递增的恶性循环[16],为降低人参农药残留问题,减少化学农药对生态环境等影响,需加大对生物农药研发。利用丰富的微生物资源进行生物防治是未来发展趋势。内生菌生存在植物体内,有稳定的生存空间,可以长期定殖于植物体内,不易受外界环境条件影响,与病原菌可以直接互作,是一类重要的生防菌资源[17]。球毛壳菌是毛壳菌中研究最早的生防菌[18],具有产生抑菌物质的能力[19],广泛应用于病害的防治。1954年Martin和Moore经过研究发现毛壳菌可使大麦、燕麦、谷物幼苗免受镰孢属病原菌侵染,广泛应用于病害的防治[20]。国内研究毛壳菌较晚,目前主要为实验室研究阶段,刘晓光等研究发现,毛壳菌可以重寄生于立枯丝核菌和小核菌菌丝内,在显微镜下可观察到病原菌菌丝被缠绕、穿透等现象[21]。印敬明等研究表明球毛壳ND35能够较好定殖于番茄、黄瓜和菜豆植株内,并能较好地促进番茄生长,对黄瓜苗期猝倒病的防治效果达80.7%[22]。孙卓等从多年生人参根际土壤中筛选出一株对人参立枯丝核菌有较强拮抗能力内生芽孢杆菌(Bacillusendophyticus) SZ-56[23]。
本研究采用平板对峙法,以立枯丝核菌为靶标菌,供试的31种菌株均为从新疆腾格里沙漠、哈巴湖荒漠野生植物中分离出的内生真菌,从中筛选出一株对人参立枯丝核菌病原菌有较强拮抗作用的菌株396,结合形态学特征和ITS序列分析将其鉴定为球毛壳,采用单因素试验对菌株进行生物学特性和盆栽防病促生试验研究。初步明确了该菌株最适宜培养基为改良马丁氏和麦芽浸粉培养基,最适宜氮源为牛肉膏和硝酸钾,最适宜碳源为木糖和葡萄糖。适宜温度均为27 ℃,致死温度为60 ℃,适宜pH为7~8,对光周期不敏感,24 h光照、24 h黑暗与12 h光暗交替培养菌落均能正常生长。菌株发酵液对人参立枯病防治效果与500倍多菌灵持平。与清水对照相比,菌株发酵液对一年生人参苗有显著的促生作用,其中株高与对照相比增加51.21%,茎叶鲜质量与对照相比增加115.02%,茎叶干质量增加47.37%,根长增加41.78%,根粗增加30.59%,这与孙卓等的研究结果一致,也展现出396在人参促生中有较好的应用前景[23]。本研究根干质量增加不显著,可能与试验时间较短,根部干物质积累较少有关,针对这一问题,可进一步进行试验验证,本研究为人参立枯病生物防治和微生物菌肥的开发提供理论依据。

