一株猪伪狂犬病病毒的分离鉴定及其对不同动物的致病性
林 鸷,赵本进,何锡忠,朱永军,彭丽英
(上海市农业科学院畜牧兽医研究所,上海 201106)
猪伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种急性传染病,又称Aujeszky氏病、传染性球麻痹或狂瘙痒症。该病的主要临床症状为发热、奇痒、急性脑脊髓炎和繁殖障碍等[1-2]。猪是PRV唯一的自然宿主和储存宿主,生长在不同时期的猪均可感染PRV。新生仔猪与保育猪感染PRV可造成中枢神经系统紊乱,表现为发热、精神沉郁、腹泻及共济失调等,死亡率高;育肥猪感染PRV呈现呼吸道症状等,表现为发热、精神沉郁、呕吐、咳嗽等;怀孕母猪感染PRV可造成妊娠母猪流产,产死胎或木乃伊胎,给养猪业造成极大的经济损失[3]。
TK和gE基因是PRV最主要的毒力决定因子,TK基因编码蛋白对PRV毒力的影响最大;gE基因与其他基因通过形成一个统一体,发挥其毒力作用;gI基因编码蛋白既可在细胞水平发挥其毒力作用,又可促进PRV在神经系统中的增殖,从而影响其神经嗜性[4-8];gD基因则是PRV吸附细胞的关键性基因[9-11]。
本研究从某疑似伪狂犬病发病猪场采集病料进行PRV变异毒株的分离及鉴定,对分离毒株的gG、gE和TK基因进行克隆测序,并对小鼠、兔子及仔猪进行致病性试验,以期为该病的防控提供理论依据。
1 材料与方法
1.1 细胞与实验动物
猪睾丸(STHN)细胞由上海市农业科学院畜牧兽医研究所保存。体重1.5—2.0 kg的成年健康家兔及20 g左右的小鼠购自上海市实验动物中心。PRV gB和gE抗体阴性仔猪来源于江苏某猪场。
1.2 主要试剂
DMEM、胰酶均购于美国GIBCO公司;新生犊牛血清购自上海赛达生物药业股份有限公司;DNA提取试剂盒、PCR试剂盒购自天根生化科技(北京)有限公司。
1.3 引物设计
参考GenBank中PRV序列(KP257591.1),设计针对PRV gE、gG和TK基因的引物。gE-F:5’-GCCTGCCACCCGGACCTGGT-3’,gE-R:5’-CACGTACAGCCCCGACTCGTCC-3’;gG-F:5’-TTTGATCCCGTCCGCCGCCCTTC-3’,gG-R:5’-CCCGGTAAGCAAGGCCGTAC-3’;TK-F:5’-GGAAGCGCGCCGGGATGCG-3’,TK-R:5’-CGGGTGGGAGGGGCGAGGGT-3’。
1.4 病料来源与预处理
可疑病料来自山西某发病猪场病猪。采用无菌方式取病猪脑部组织,将其与PBS(0.1 mol/L,pH 7.2)以体积比1∶5制成匀浆;反复冻融3次,5 000 r/min离心15 min,取上清液加双抗作用,经0.22μm滤膜过滤除菌后置于-80℃保存备用。
1.5 病毒的分离与纯化
1.5.1 病毒的分离
将处理好的猪脑病料滤液接种于长成单层的STHN细胞,接种3瓶,同时设PBS作为阴性对照,37℃吸附30 min后加细胞维持液,置于37℃、5%CO2培养箱中继续培养。每日观察细胞病变,待80%的细胞病变后,将细胞冻融3次,收集细胞培养液,-20℃冻存备用。
1.5.2 蚀斑纯化
将冻融好的病毒液进行10倍倍比稀释,取1∶1×105、1∶1×106、1∶1×107病毒稀释液分别接种于长成单层的12孔STHN细胞板,37℃吸附30 min,将高压灭菌好的低熔点琼脂糖和2×DMEM以体积比1∶1混合后加入到细胞培养板中并覆盖在细胞表面,凝固后置于37℃、5%CO2培养箱继续培养,每日观察,待出现细胞病变时用中性红染色挑取蚀斑于DMEM培养液中,冻融3次,再次接种STHN细胞板中,反复操作4次后,获得纯化的病毒。将经4次纯化后获得的第5代病毒记为T0代。
1.5.3 病毒的传代
将纯化好的病毒(T0代)接种于长成单层的STHN细胞瓶(25 cm2)中,每瓶接种1 mL,同时设DMEM作为阴性对照,37℃吸附30 min后加细胞维持液9 mL,置于37℃、5%CO2培养箱中继续培养。每日观察细胞病变,待80%的细胞病变后,将细胞冻融3次,收集细胞培养液,-20℃冻存备用。
1.6 PCR鉴定
将病毒接种于STHN细胞,当细胞病变达80%以上时收集细胞,用常规方法提取病毒DNA,用TE溶液溶解沉淀,分装备用-70℃冻存。使用宝生物工程(大连)有限公司的PCR试剂盒进行扩增。PCR反应体系(25μL):Prime STAR®HSDNA聚合酶(2.5 U/μL)0.25μL;5×Prime STAR Buffer(Mg2+plus)5μL;dNTP Mixture(各2.5 mmol/L)2μL;上游引物(10μmol/L)0.5μL;下游引物(10μmol/L)0.5μL;DNA模板1μL;双蒸水15.75μL。
不同的基因片段按照不同的反应程序进行,扩增gG基因的反应条件:98℃,8 min;98℃,20 s,64℃,20 s,72℃,2 min,30个循环;72℃,7 min。扩增gE基因的反应条件:98℃,5 min;98℃,30 s,57℃,20 s,72℃,2 min,30个循环;72℃,10 min。扩增TK基因的反应条件:98℃,8 min;98℃,20 s,60℃,20 s,72℃,1 min,30个循环;72℃,7 min。取PCR产物在10 g/L琼脂糖凝胶上电泳鉴定,PCR产物送生工生物工程(上海)股份有限公司进行测序,并与国内外毒株进行序列比对。
1.7 病毒的电镜鉴定
将毒株反复冻融3次,3 000 r/min离心30 min,加入PRV阳性血清,置于37℃作用30 min,10 000 r/min离心60 min,弃上清液,将沉淀用三蒸水稀释到原来的浓度。反复3次离心,最后一次的沉淀用1滴蒸馏水稀释,制备铜网,用pH 6.2的2%磷钨酸负染,于电镜下观察。
1.8 毒价的测定
将STHN细胞培养于96孔细胞板上,待细胞生长成单层。第5代病毒作10倍系列稀释(10-1—10-10),每个稀释度接种8孔,每孔0.1 mL,对照细胞添加0.1 mL维持液。记录各个梯度的病变数,连续观察7 d,计算半数细胞感染量(TCID50)。
1.9 对不同动物的致病性
1.9.1 对家兔的致病性
用105.0TCID50/mL病毒液于腹部皮下注射成年健康家兔5只,剂量1 mL/只;以腹部皮下注射DMEM维持液的家兔2只作为对照,剂量1 mL/只,每天观察动物的临床反应。
1.9.2 对小鼠的致病性
用105.0TCID50/mL病毒液于皮下多点位注射小鼠10只,剂量1 mL/只,以皮下多点接种PBS的10只小鼠作为对照,每天观察动物的临床反应。
1.9.3 对仔猪的致病性
用104.0TCID50/mL病毒液滴鼻5头仔猪,剂量1 mL/头,以滴鼻1 mL PBS的5头仔猪作为对照,每天观察动物的临床反应。
2 结果与分析
2.1 病毒细胞培养结果
病料滤液接种STHN细胞后,细胞于20—24 h逐渐收缩变圆,折光性增强,细胞内形成空泡、脱落,有的细胞发生融合,形成巨细胞(图1)。

图1 感染PRV的ST细胞病理变化Fig.1 Pathological changes of ST cells infected PRV
2.2 PCR扩增及测序结果
用设计的特异性引物进行PCR扩增,产物在琼脂糖凝胶电泳上分别可见约1 700 bp(A)、1 750 bp(B)以及1 000 bp(C)的条带,与预期的PRV gG基因、gE基因、TK基因片段大小相符(图2)。
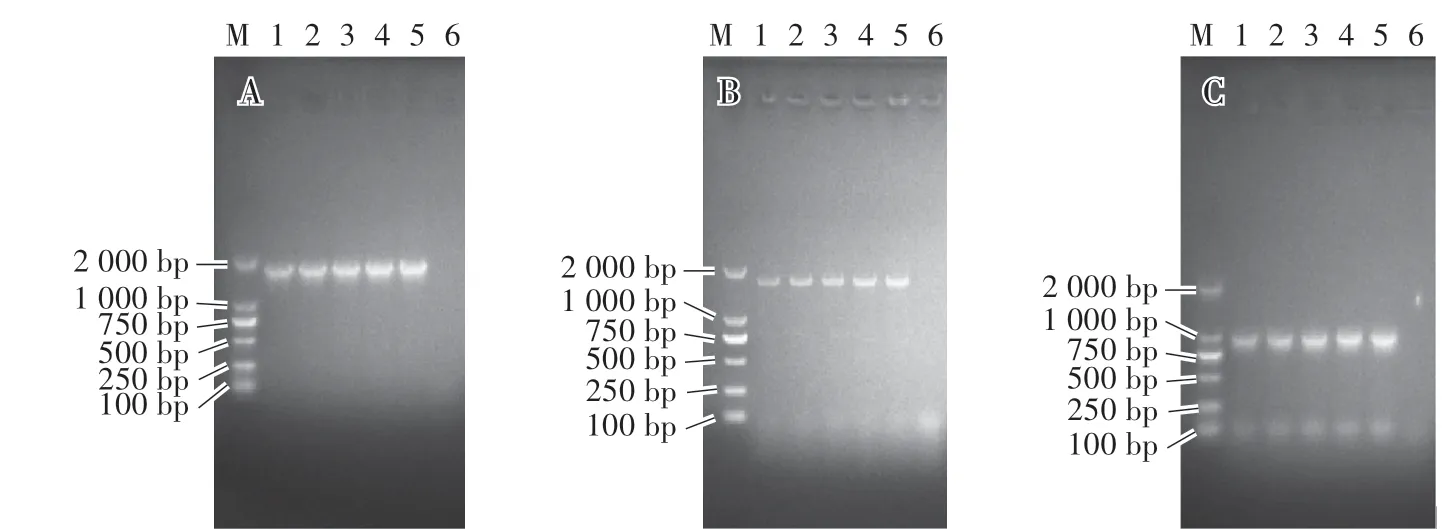
图2 PRV gG、gE、TK基因的PCR扩增鉴定结果Fig.2 PCR amplification and identification results of PRV gG,gE and TK
PCR产物经测序比对后显示,gE基因全长1 740 bp,与国内流行的变异毒株HeN1株、JS2012株、TJ株、GD株的同源性为99.7%—99.9%,与国内经典毒株Ea株的同源性为99.3%,与国外毒株Kaplan株、Becker株以及Kolchis株的同源性为97.2%—97.4%。gG基因包含1 500 bp的编码区,与国内流行的变异毒株的同源性为99.9%—100%,与经典毒株Ea株的同源性为99.9%,与国外毒株的同源性为99%—99.9%。TK基因序列包含963 bp的编码区,与国内流行强毒株的同源性为100%,与国内外其他经典毒株的同源性为99.4%—99.7%。同源性比对结果表明,分离得到的毒株为国内流行的变异毒株。
2.3 电镜鉴定
病毒培养物在电镜中可见到在胞浆内有直径为155 nm左右的圆形带囊膜的较大病毒;而在细胞核内无囊膜的病毒粒子直径约为120 nm左右(图3)。

图3 病毒粒子的电镜观察Fig.3 Electron microscopic observation of virus
2.4 毒价测定
将病毒倍比稀释后接种至96孔细胞板中,观察细胞病变效应(CPE)。经统计细胞病变数量,按照Reed-Muench法计算病毒半数细胞感染量(TCID50)为108.0TCID50/mL。
2.5 对不同动物的致病性试验
2.5.1 家兔致病性试验结果
用105.0TCID50/mL病毒液接种家兔5只,接种兔子于24 h后体温升高,最高可达43℃,并开始腹泻,注射后36 h开始表现不安,接种部位出现典型的奇痒症状,频频用嘴啃咬或用后爪抓注射部位,接种部位被毛脱落,皮肤撕破并出血,呈现血性炎症症状,随后角弓反张,于52 h左右死亡。对照组兔子无任何症状,观察7 d后仍健活。死亡兔剖检可见肺淤血,气管环充血、出血,肝淤血肿大,胃黏膜脱落,有的胃底穿孔,脑膜充血、出血,肾脏点状出血。
2.5.2 小鼠致病性试验结果
用105.0TCID50/mL病毒液接种10只小鼠,接种后24 h小鼠接种部位开始出现典型的奇痒症状,用嘴啃咬或者用后爪抓注射部位,接种部位被毛脱落,皮肤出血,随后四肢麻痹,于72 h左右全部死亡。对照组小鼠无任何症状,观察10 d后仍健活。
2.5.3 仔猪致病性试验结果
用104.0TCID50/mL病毒液接种5头仔猪后,接种后5头仔猪体温均升高至41℃以上,食欲减退、消瘦,其中2头出现拉稀及打颤或转圈等不良神经症状,最后死亡;其他3头出现拉稀等临床症状,观察至14 d无死亡。对照仔猪观察14 d体温正常,无食欲减退、消瘦及不良神经症状。
3 讨论
赵胜杰等[12]研究表明:2017—2019年河南省PRV gE抗体个体阳性率为27.89%,场群阳性率为53.51%;其中2018年感染率较高;冬季和春季感染率较高。宁慧波等[13]研究表明:2014—2019年华北地区猪场gE抗体阳性率呈先上升后下降趋势,其中2016年gE抗体阳性率高达85.48%;2019年gE抗体阳性率最低,为62.96%。张晓阳[14]对2018年山东省各地区不同猪群PRV的gE抗体进行监测,结果显示gE抗体阳性率为45%,并从疑似病例中分离到变异强毒株。可见,目前我国各地PRV野毒感染比较普遍,猪伪狂犬病流行形式依然严峻。
本研究取临床疑似猪伪狂犬病发病仔猪的脑组织,用猪睾丸细胞进行分离培养、蚀斑纯化后获得纯病毒,并对其进行鉴定,PCR结果显示:可扩增出PRV gG基因、gE基因、TK基因片段,大小与预期结果相符。分离毒的毒价高,在制备疫苗时可以提高疫苗的免疫效果。病毒可被PRV阳性血清中和,而不被其他血清中和,说明分离毒具有较高的特异性。本研究分离的病毒致病性强,接种后家兔于52 h左右全部死亡,72 h左右小鼠全部死亡,28日龄仔猪发病或死亡。
PRV在长期流行过程中毒株通过缺失、突变及重组等多种机制发生变异,基因组序列发生改变形成新的毒株。变异后的毒株其免疫原性及致病性等均可能发生变化,有的可能毒力增强,有的可能毒力减弱,通过对致病性的研究可为PRV的防控提供依据。

