不同培养基对土壤细菌可培养性的影响
王 泽, 贾晟楠, 华智超, 牛邦彦, 徐绮思, 任东军, 高 淼
(1. 沈阳师范大学 生命科学学院, 沈阳 110034;2. 中国农业科学院农业资源与农业区划研究所 农业农村部农业微生物资源收集与保藏重点实验室, 北京 100081)
0 引 言
细菌是土壤微生物中数量最多的一个类群,占土壤微生物总量的70%~90%,它们在土壤有机物质的转化中起着重要作用[1]。土壤是微生物的主要物质基础,1 g土壤中有高达10余万种、数以亿万计的微生物。土壤微生物是驱动物质循环过程的引擎,也是地球上进行物质循环与能量流动的重要枢纽,对人体健康、农业生产、土壤环境修复等均起着重要作用[2-3]。
纯培养技术一直是微生物学研究的基石,但是单一的营养结构和生境与自然环境中微生物多样性、协同代谢等明显矛盾,从而成为部分微生物难以复苏的主要障碍。细菌共同协作的自然生存方式的崩溃、生境的极度营养变化和生态位巨变等是微生物可培养性低的主要生态学原因[4]。对此问题,国内外开展了较多在改进微生物培养方法、开发新型培养技术方面的研究工作,分离获得了一批新的微生物菌株。如通过改变培养基的配方、降低培养基营养成分、添加某些微生物生长因子可显著提高平板培养的土壤微生物种类和数量[5];采用多种培养基组合亦可提高土壤微生物的可培养性。孙创等[6]通过利用改良的2216E等5种培养基进行微生物培养,获得了大量可培养细菌,具有较高的多样性。武凤霞等[7]以常规微生物分离培养基营养浓度为基础,对贫营养、富营养培养基在低温条件下(8℃)获得的培养物进行比较分析,了解培养基营养浓度对低温土壤微生物分离培养的影响,结果表明,在低温培养条件下,稀释培养基营养成分可以提高耐低温可培养性微生物种类,但会降低耐低温可培养微生物的数量。
本文选择LB,Flour Medium,YEM Medium和TWYE Medium这4种不同营养成分的培养基,对大田土壤和温室大棚土壤中可培养细菌的数量和多样性进行比较分析,深入了解不同培养基对不同微生物的培养能力,为分离土壤细菌培养基的设计及选用提供参考。
1 材料和方法
1.1 材 料
1.1.1 土壤样品
2020年12月于北京中国农业科学院温室(39°N,116°E)中取番茄若干,将番茄根部土壤轻轻抖落得到温室土样,于沈阳市于洪区后辛台村(41°N,123°E)中获取番茄大田番茄土样。
1.1.2 分离培养基
LB培养基: 10 g Tryptone,5 g Yest extract,10 g NaCl,18 g Agar,蒸馏水定容至1 L。
Flour Medium培养基、YEM Medium培养基、TWYE Medium培养基详见文献[8]。
1.1.3 主要试剂
Plain flour, Mannitol, NaCl, Agar(Solarbio公司); TRYPTONE, Yeast extract(OXOID公司); K2HPO4(西陇科技股份有限公司); MgSO4·7H2O(北京化学试剂公司); CaCO3(国药集团化学试剂有限公司); 蔗糖(光复科技发展有限公司)。
1.2 培养方法
1.2.1 土壤悬液制备
取备用土样1 g于预先装好无菌玻璃珠和10 mL无菌水的摇菌管中,静置10 min,室温下在150 rpm·min-1的摇床震荡10 min,制成土壤母液菌悬液,然后取1 mL土壤菌悬液用无菌水进行梯度稀释,获得10-1~10-7稀释浓度的土壤菌悬液。
1.2.2 平板培养
每个样品涂布5个稀释度,每个稀释度3个重复。番茄土壤悬液稀释涂布浓度:LB培养基10-7~10-3,其余培养基10-6~10-2。吸取100 μL菌悬液于平板中,加入无菌玻璃珠,4个方向平行摇动从而均匀涂布,将涂布完成的平板于28 ℃的培养箱中恒温培养。3 d后开始进行计数。计数后进行分纯,纯化3次使菌株完全纯化。
1.3 测序方法
1.3.1 菌株DNA提取
将1.5 mL无菌离心管中加入100 μL无菌水,选择平板上肉眼可见的单菌落置于1.5 mL无菌离心管中,使其充分溶于水,100 ℃金属浴中裂解15 min后于-20 ℃冰箱放置30 min,室温放置解冻,12 000 rpm·min-1离心1 min,获得的上清液即为提取到的DNA。
1.3.2 PCR扩增
使用细菌通用引物27F/1492R进行16S rDNA基因扩增。以提取出的DNA为模板,利用16S rDNA基因的引物对27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)来进行扩增。PCR采用25 μL反应体系,PCR反应参数为:94 ℃预变性5 min;94 ℃变性1 min;55 ℃退火30 s;72 ℃延伸90 s;30个循环;72 ℃延伸5 min。
1.3.3 琼脂糖凝胶电泳检测
取1 μL PCR扩增产物与DNA Marker,用2%琼脂糖进行凝胶电泳检测,条件为恒定电压120 V,电流330 mA,电泳30 min。随后观察电泳荧光条带以辨别DNA是否提取成功,验证后,将提取成功的DNA样品送往北京擎科生物科技有限公司进行DNA测序。
1.3.4 种属鉴定
将测得的DNA序列在Ezbiocloud(www.ezbiocloud.net/eztaxon)进行比对,以序列相似度大于或等于98.7%确定其中的分类学依据[9]。
1.3.5 数据分析
本研究采用SPSS 19.0 版本软件(Chicago,IL,USA)进行统计学分析,统计检验为卡方检验(X2),以α=0.05作为检验水准;采用Venn diagram分析来表示菌种之间的重叠情况。
2 结果与分析
2.1 不同培养基分离土壤微生物的数量分析
番茄大田和温室大棚土壤菌悬液在4种培养基平板计数的结果见表1。从表中可以看出,2种土壤样品分别在LB,Flour Medium,YEM Medium和TWYE Medium,每种培养基上生长的细菌数量相近,均未达到显著性差异(P<0.05)。但是,4种培养基间细菌数量差异较大,LB培养基上生长的细菌数量最多,与其他培养基具有显著性差异(P<0.05);其次是YEM Medium培养基和TWYE Medium培养基,互相比较没有显著性差异(P>0.05);Flour Medium培养基上生长的细菌数量最少,与YEM Medium和LB培养基具有显著性差异(P<0.05)。2种土样在LB培养基上生长的细菌平均数量为2.18×106cfu(colony forming unit)·g-1土, 是YEM Medium、TWYE Medium和Flour Medium培养基细菌平均数量的2.04倍、1.88倍和3.5倍。

表1 平板培养基分离土壤微生物计数(×104cfu/g土)Table 1 Microbial count of soil separated by plate medium
2.2 不同培养基上微生物的分离鉴定

图1 4种培养基分离细菌土壤细菌数量Fig.1 Bacteria isolated from soil by four kinds of culture media
2种土壤样品经梯度稀释后分别在不同培养基平板上28 ℃培养72 h,经分离纯化共获得细菌 71株,其中分离自Flour Medium培养基18株,LB培养基18株,TWYE Medium培养基21株,YEM Medium培养基14株(图1)。经16S rDNA基因测序,结果在Ezbiocloud比对(表2)。结果显示,分离的71株细菌分别属于18个属36个种,其中Streptomyces属28株,Bacillus属12株,Microbacterium属6株,Leifsonia和Brucella属各4株,Flavobacterium属3株,Paenibacillus和Rhodanobacter属各2株,Pectobacterium,Cytobacillus,Promicromonospora,Arthrobacter,Nocardia,Mycolicibacterium,Pradoshia,Cellulosimicrobium,Massilia,Neobacillus属各1株。
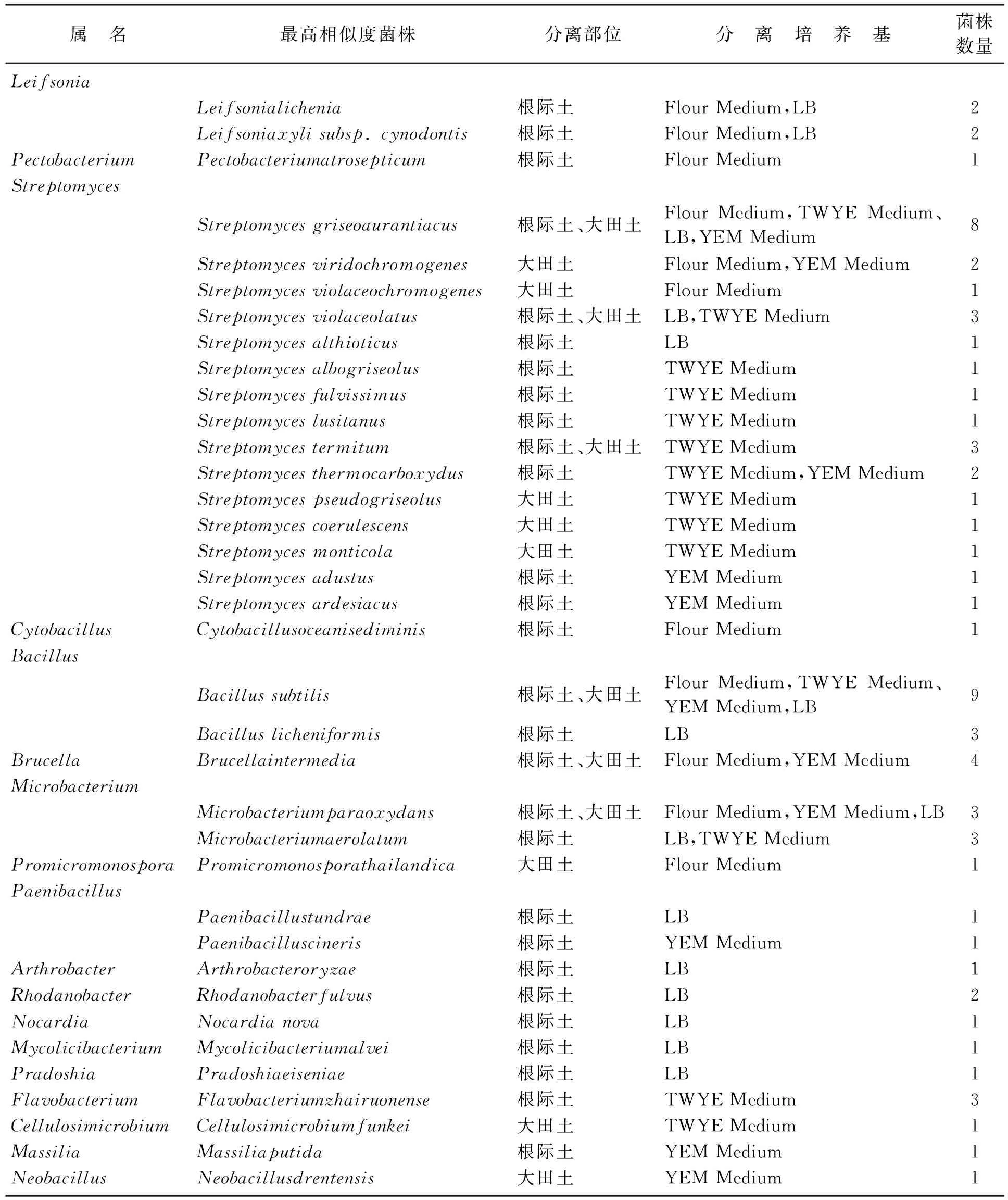
表2 分离到的71株细菌的分类信息表Table 2 Taxonomic information of 71 strains of bacteria
温室土较大田土分离的菌种种类多。4种培养基中,LB分离到的菌种种类最多。在所有属中,分离的Streptomyces最多,且主要在TWYE Medium培养基上分离到,另外,Pectobacterium,Promicromonospora和Cytobacillus仅从Flour Medium培养基中分离。
2.3 不同培养基分离土壤微生物分布情况

图2 4种培养基分离细菌分布情况Fig.2 Distribution of bacteria isolated from four media
利用Venn diagram来分析菌种之间的重叠情况。从图2可以看出,TWYE Medium培养基和LB培养基不重叠部分即仅由各自培养基分离的菌株种类大于Flour Medium培养基和YEM Medium培养基,Flour Medium培养基与YEM Medium培养基分离的相同菌株种类较多,TWYE Medium培养基与LB培养基分离的相同菌株种类较多,YEM Medium培养基与Flour Medium培养基分离的相同菌株种类较多,LB培养基与Flour Medium培养基和TWYE Medium培养基分离的相同菌株种类较多,且有2种菌株种类在4种培养基上均能分离到(表3)。其中Pectobacterium属、Cytobacillus属和Promicromonospora属主要由Flour Medium培养基分离得到;Flavobacterium属和Cellulosimicrobium属主要由TWYE Medium培养基分离得到;Massilia属和Neobacillus属主要由YEM Medium培养基得到;Arthrobacter属、Rhodanobacter属、Nocardia属、Mycolicibacterium属、Pradoshia属主要由LB培养基培养得到。

表3 番茄 71株细菌的分布情况表Table 3 Distribution of 71 strains of bacteria
2.4 潜在新种
根据16S rDNA基因结果显示,本文所得的71株细菌中2株菌与其最高相似菌株16S rRNA基因相似度低于98.7%,为潜在新种,占总分菌2.82%,分别为黄杆菌属(Flavobacterium)1株[10],普拉多什菌属(Pradoshia)1株[11]。
从土壤样品来看,此2株潜在新菌均是来自温室土;从培养基分离来看,2株潜在新种中,1株与Pradoshia属最高同源性分离自LB培养基,1株与Flavobacterium属最高同源性分离自TWYE Medium培养基。其余培养基没有筛到潜在新种。
3 讨 论
目前对于不同培养基分离土壤微生物的报道较多,不同培养基由于组成成分不同,对细菌分离的选择性具有一定差异,可根据不同的研究材料进行培养基的改良及条件的改进[12-14]。本研究通过4种培养基对2种土壤样品,2种培养基进行细菌的分离纯化和培养,获得了较丰富的微生物菌种资源。培养基分别为LB培养基[15]、Flour Medium培养基、YEM Medium培养基和TWYE Medium培养基。利用不同的培养基培养细菌微生物,可提高土壤细菌的可培养性。
本研究得到了4种培养基分离土壤细菌,类群的多样性分析的初步结果经过16S rDNA基因序列相似性比对,共分离得71株细菌,分别属于18个属36个种。不同的培养基分离获得的细菌群落组成差异较大。Flour Medium培养基上分离得到Leifsonia属、Pectobacterium属、Streptomyces属等;YEM Medium培养基上分离得到Streptomyces属、Bacillus属、Microbacterium属等;YEM Medium培养基分离得到Streptomyces属、Bacillus属、Brucella属等;LB培养基分离得到Leifsonia属、Streptomyces属、Bacillus属等。且其中分离到2株潜在新种,一株分离自LB培养基,与Pradoshiaeiseniae的16S rDNA基因序列相似性为98.47%;一株分离自TWYE Medium培养基,与Flavobacteriumzhairuonense的16S rDNA基因序列相似性为97.72%。潜在新种还有待进一步研究。

