鄱阳湖不同湿地植物群落光合碳储量及分配
纪昌品, 张晓平
(东华理工大学, 南昌 330000)
土壤碳库对于整个全球生态系统碳平衡具有重要的影响,其轻微的变化将会影响整个碳平衡发生变化,尤其是在碳固持方面。地上植被受土壤质量的制约,同时又会对土壤产生反馈影响[1-3],连续输入的碳影响着土壤碳的动态平衡;此外,微生物呼吸也对土壤碳平衡也具有重要的影响,调节着土壤碳平衡。对于植被而言,在光合作用下[4-5],空气中的二氧化碳被大量吸收利用,从而形成光合碳,经过植株器官传输,最终通过根系进入土壤,微生物作用下被分解,最终形成CO2或CH4等,一部分被固化至土壤,一部分被释放至大气,从而形成尤为明显的植物碳循环,这在土壤碳平衡过程中发挥着不可或缺的角色[6-7]。国外对于碳平衡的研究相对较多,对其定量分析常采用同位素示踪技术,尤其是对其地下植株部分的分析研究更侧重于量化分析,该量化分析常运用于小麦及牧草碳循环研究中[8-14]。
对于植物—土壤系统而言,其碳循环具有突出的复杂性,且影响因素多样,尤其是在光合作用的参与下,一方面其碳分配作用机理并不完全明晰[15-16],另一方面,其转化效率受到多方面因素制约,难以进行充分的量化研究,因为对于传统的有机碳测定而言,并不能对其开展有效的量化分析。基于此,为了深入开展植被碳平衡作用机理及量化分析[17-18],目前倾向于采取稳定同位素示踪技术13C分析法,不仅从植株碳输入的角度分析碳转移及分配,而且对根际土壤碳平衡作用机理进行量化分析。对于13C而言,其具有突出的稳定性特点,借助于多种脉冲标记,能够对植株不同生长期的碳输入进行量化分析,因此在碳平衡研究过程中运用广泛。为了探究湿地植被光合碳的作用机理,本研究借助于13CO2脉冲标记法,一方面探究新碳的流动作用机理,另一方面分析不同植株器官的碳差异,最终分析植被—土壤碳平衡作用机理,为合理利用碳循环提供有益参考和借鉴。
1 材料和方法
1.1 采样点分布
本试验所选区域为江西省永修县吴城镇,属于鄱阳湖的典型洲滩(29°14′ N, 116°01′ E,海拔334 m),其西南方向是赣江流域,该地受到明显的河水冲刷,地势具有一定的坡度,海拔相对较高,东北方向紧挨鄱阳湖的主湖面,湖边地势相对低缓。因其所处地理位置及湖泊的影响,该地区属于典型的亚热带季风气候,夏季多雨高温,平均年气温在17.6℃,高温集中在7月(近30℃),而降雨多发在每年的4,5,63个月,年降雨量达到1 450~1 550 mm;而冬季天气干燥严寒,较冷月出现在1月(月均气温5.1℃)。该地区湿地面积2 698 km2,占湖水正常水位下的全湖面积的82%,湿地以粉砂土为主,植物群落从湖心到滩地呈现典型的带状分布,植物优势种主要有藨草(Phalarisarundinace)、蓠蒿(Cynodondactylon)、苔草(Carexcinerascen)、芦苇(Phragmitescommunis)、稗草(Echinochloacrusgalli)、狗牙根(Artemisiaselengens)等(表1)。
1.2 脉冲标记
为深入分析植被—土壤碳平衡作用机理,尽可能将试验误差降到最低,本研究采取3次重复试验的方法,首先对植被进行分组,分为3组,同时采取设置间隔行的方法最大程度地降低污染。在进行脉冲标记之前,首先进行柱状标室的设置,其内高、内径分别达到0.4,1 m,考虑到雾化情况,本研究采取将雾化剂涂至内壁的方式,之后将其买入土壤中,要求深度达到5 cm;考虑到根系对试验的干扰,本研究采取尼龙网眼孔覆盖的方式进行处理,从而更大程度上降低根系影响,同时保障了植被正常的水分交换,以及养分交换。本研究从2015年8月1日开始进行标记试验,开始时间为当天上午11点,第一步是将高纯度13C的CO2置入高压瓶,借助于连接管将其与标计室联通,进而将13CO2置入,要求容量为10 L,在此处理下,对于标记室而言,其气体量出现明显的上升,最终达到了3.18%,之后需要进行顶膜密封处理,同时进行标记处理,持续40 min后停止,接下来进行长达五小时的密封处理。在内置风扇的作用下,能够保障正常的空气流通,当二氧化碳浓度处于很低的状态下,将标记室移走。

表1 典型洲滩湿地植被的优势种及伴生种
1.3 样品采集与制备
在样品采集过程中,首先进行15株植物随机取样,并将其根系进行逐一编号,保存于实验室内,接下来进行清理处理,待其干净后进行烘干处理,要求时间持续48 h,温度保持在70℃,称重后进行记录。之后对样品进行粉碎处理,过2 mm筛,对δ13C、全C进行测量后记录。为尽可能将试验误差降到最低,本研究采取三次重复试验的方法,同时对土壤容重加以测量,要求土层深度达到10 cm。
1.4 样品测定与分析方法
接下来进行新鲜土样采集,要求重量达到20克,并将其放置在白色平板,将其细根进行挑拣处理后,置于去离子溶液中,要求溶液达到100 ml,之后进行长达半小时的振荡处理,待其达到充分溶解状态即可。静置处理后将其上清液取出;为了排出水溶性有机碳,本研究采取HCl冲洗的方法。首先将上清液置入烧杯,将HCl溶液加入其中;为了有效将可溶性碳酸盐进行去除,采取调整pH低于3的方法;接下来将50 mlHCl溶液加入沉淀物中,从而有效去除碳酸盐,净化沉淀物。经过长达2 d的反应处理后,采取蒸馏水进行净化处理,待其达到中性即可,清夜倒出后进行烘干处理,研磨后过筛0.15 mm。
本研究过程中采取EA-IRMS分析仪,该测定仪器既能够开展元素分析,又能进行同位素比率质谱分析。首先将样品进行高温燃烧处理,在这一过程中借助于元素分析仪,之后借助于质谱仪开展比率监测,尤其是对二氧化碳中的13C,12C分别进行对比,对比物为国际标准物,本研究采用的是PDB,接下来进行δ13C比率计算,这就是其作用原理。研究中要求δ13C的误差在0.1‰。
光合固定13C会进入不同的植株器官部位,尤其是根、茎、叶部位,在不考虑呼吸损失的情况下,对其各组分固定13C量进行计算[19-20],即13Ci=(F1-F2)/100。其中不同组分的碳含量用13Ci表示,F1,F2分别代表标记组、非标记组的13C丰度。13Ci分配比例=13Ci/13C×100。
此外,2016—2018年重复上述试验,所有值为4 a的平均值。
2 结果与分析
2.1 不同湿地土壤有机碳含量及储量
表2显示了不同湿地植物群落土壤有机碳含量和有机碳储量,由表可知,土壤有机碳含量和有机碳储量均呈一致的变化规律,其中以表层土壤最高,随土层深度的增加逐渐降低,其中20—40 cm以下土壤有机碳含量变化范围相对较小;60—80 cm土壤有机碳含量最低。随剖面深度的增加,土壤有机碳储量逐渐降低,以表层土壤(0—20 cm)有机碳储量最高,芦苇群落、苔草群落、水蓼群落、藜蒿群落土壤有机碳储量分别占土壤剖面总有机碳储量的比例为31.23%,33.45%,31.25%,32.78%;60—80 cm土壤有机碳储量最低。由表还可知,土壤13C含量随土层深度的增加逐渐增加趋势,其中不同土层大致表现为藜蒿群落>水蓼群落>苔草群落>芦苇群落。
2.2 不同湿地植物群落土壤养分含量
由图1可知,不同湿地植物群落土壤养分含量呈一致的变化趋势,其中全氮、碱解氮和速效磷含量均表现为藜蒿群落<水蓼群落<苔草群落<芦苇群落,不同植物群落差异均显著(p<0.05);而全磷含量大致表现为藜蒿群落<水蓼群落<芦苇群落<苔草群落,不同植物群落差异均不显著(p>0.05)。
表2 不同湿地土壤有机碳含量及储量垂直分布
2.3 不同湿地植被地上和地下生物量
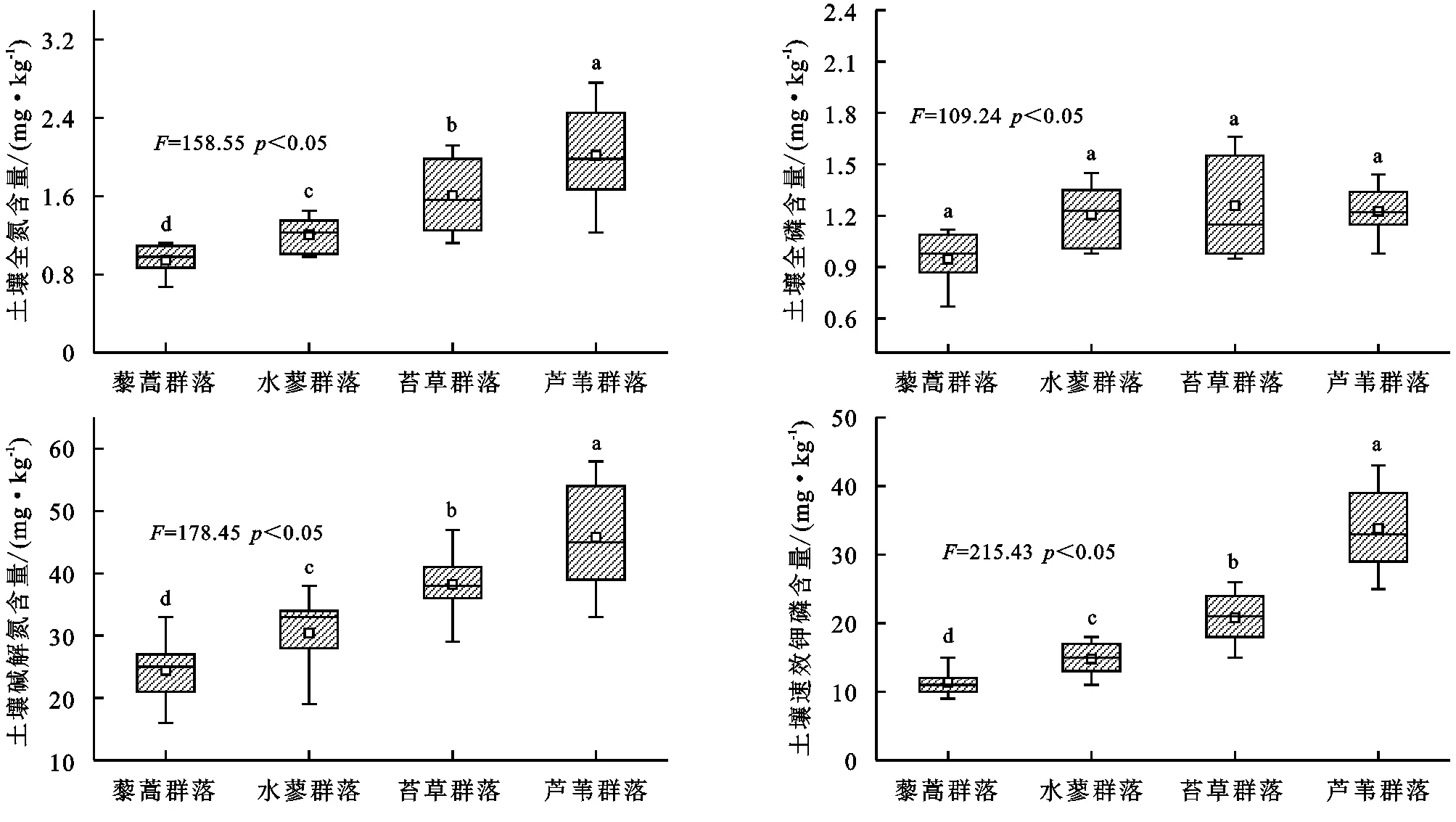
由图2可知,不同湿地植物群落地上和地下生物量呈一致的变化趋势,其中大致表现为藜蒿群落<水蓼群落<苔草群落<芦苇群落,不同植物群落地上和地下生物量差异均显著(p<0.05)。
2.4 不同湿地植物群落叶13C丰度
由图3可知,藜蒿群落、水蓼群落、苔草群落、芦苇群落叶片碳含量有明显的差异,其中叶片碳含量具体表现为藜蒿群落<水蓼群落<苔草群落<芦苇群落,其中不同湿地植物群落叶片碳含量差异均显著(p<0.05)。不同湿地植物群落叶片13C含量有明显的差异,其中叶片13C含量具体表现为藜蒿群落<水蓼群落<苔草群落<芦苇群落,其中苔草群落和芦苇群落差异不显著(p>0.05)。
注:不同小写字母表示差异显著(p<0.05),下同。
图2 不同湿地地上和地下生物量
2.5 不同湿地植物群落茎13C丰度
由图4可知,藜蒿群落、水蓼群落、苔草群落、芦苇群落茎碳含量有明显的差异,其中茎碳含量具体表现为藜蒿群落<水蓼群落<苔草群落<芦苇群落,其中不同湿地植物群落茎碳含量差异均显著(p<0.05)。不同湿地植物群落茎13C含量有明显的差异,其中茎13C含量具体表现为藜蒿群落<水蓼群落<苔草群落<芦苇群落,其中苔草群落和芦苇群落差异不显著(p>0.05)。
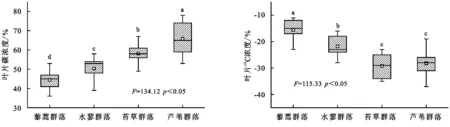
图3 不同湿地植物群落叶13C丰度
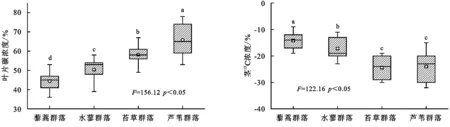
图4 不同湿地植物群落茎13C丰度
2.6 不同湿地植物群落根13C丰度
由图5可知,藜蒿群落、水蓼群落、苔草群落、芦苇群落根碳含量有明显的差异,其中根碳含量具体表现为藜蒿群落<水蓼群落<苔草群落<芦苇群落,其中不同湿地植物群落根碳含量差异均显著(p<0.05)。不同湿地植物群落根13C含量有明显的差异,其中根13C含量具体表现为藜蒿群落<水蓼群落<苔草群落<芦苇群落,其中不同湿地植物群落根13C含量差异均显著(p<0.05)。
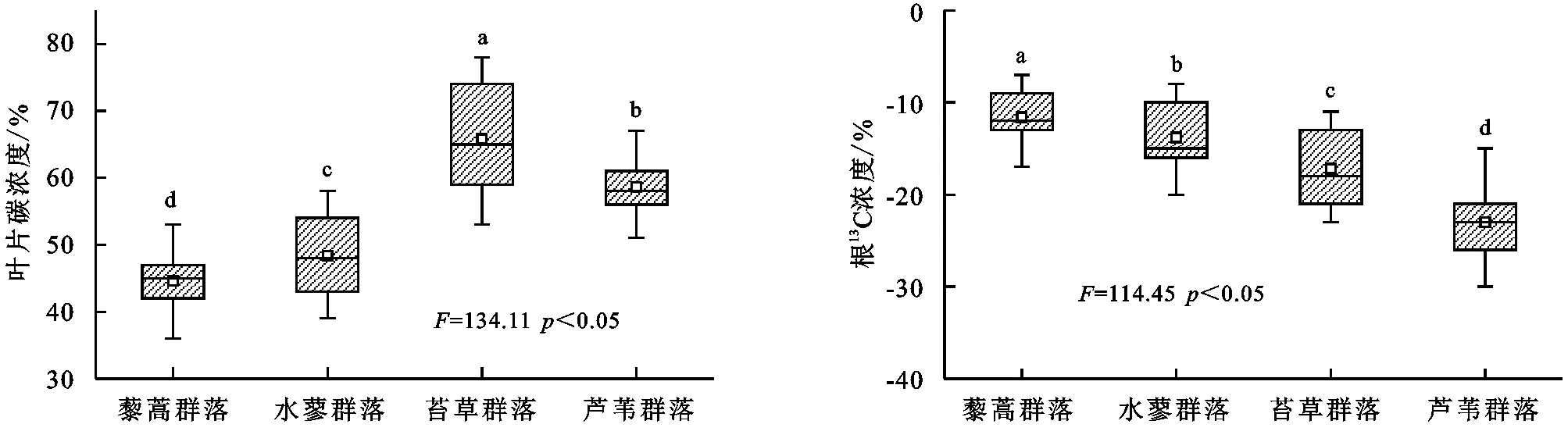
图5 不同湿地植物群落根13C丰度
2.7 不同湿地植物群落地下各组分的碳分配
对于植被—土壤系统而言,其碳平衡作用机理较为复杂,且存在明显的动态变化性,尤其是新固定13C方面,具体见表3,本研究在对13C固定量对比分析过程中以单位面积为计算标准,对于其分配比例的计算亦是如此。在开展标记初期,经过测定分析得知,不同植被具有较大差异的叶片13C含量,其中最高的是藜蒿,其次是水蓼,而芦苇最低。对于不同植被茎而言,其13C含量低值为31.34,高值为44.15,其中藜蒿最高,其次是水蓼;对于植被根系而言,其13C含量低值为17.78,高值为30.21,其中藜蒿最高,其次是水蓼;对于植被土壤而言,其13C含量低值为5.66,高值为10.65,其中藜蒿最高,其次是水蓼。进行长达21 d的标记之后发现,虽然植被不同,且根、茎等器官存在较大差异,其13C含量变化依然与最初标记阶段表现一致。通过对表4的分析不难得知,对于标记当天而言,其同化13C更多地分配于茎叶,而土壤最低;进行长达21 d的标记之后发现,13C更多地分配于根系部位,其次是茎叶,而土壤最低。
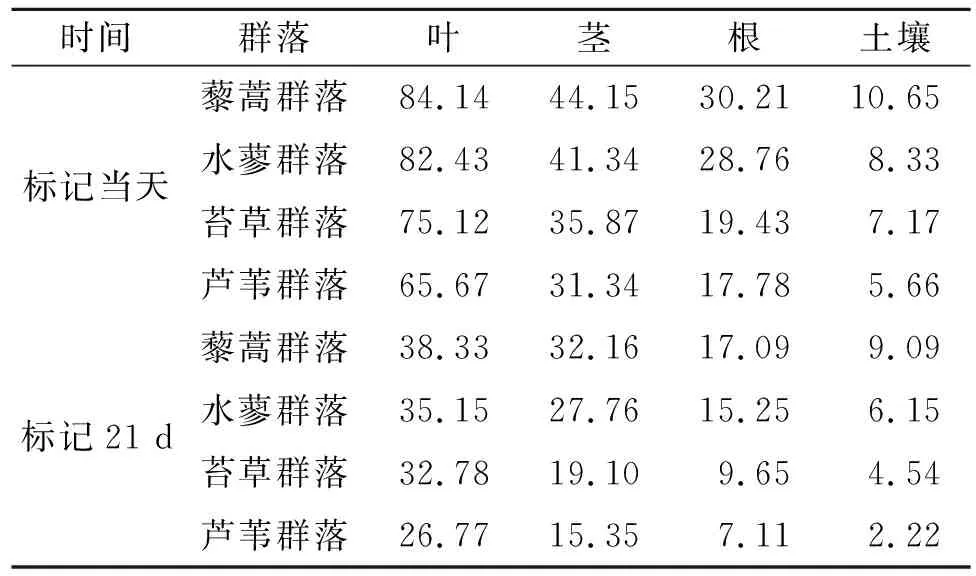
表3 不同湿地植物群落地下各组分分配 mg/m2
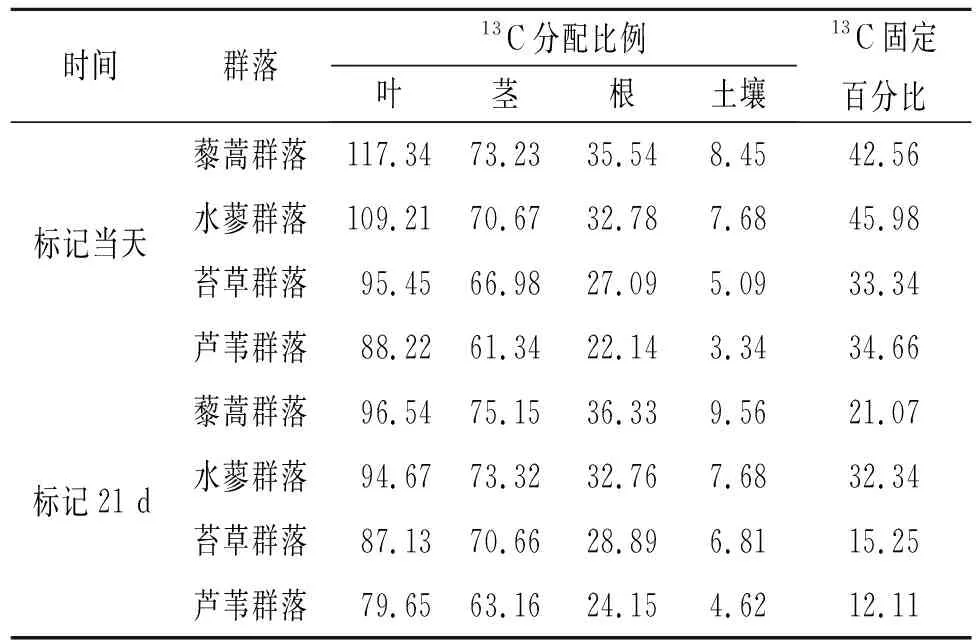
表4 标记后不同湿地-土壤系统各组分13C的分配 %
2.8 光合碳的影响因素
通过对表5分析得知,经过相关分析发现,光合同化碳在地上、土壤的分布虽然有所不同,但不仅受到地上、地下养分的制约,同时受到土壤养分的制约。对于茎叶、根13C含量而言,其不仅与地上、地下生物量呈现突出的正相关,而且与有机碳、全氮的正向关系突出,对于碱解氮和速效磷来说亦是如此。对于土壤13C含量而言,其碱解氮和速效磷之间的相关性显著,而与其他因素的正相关达到极显著水平。

表5 光合碳的影响因素
3 讨 论
通过连续性试验对比分析得知,对于植株地上部分而言,其在光合作用下具有良好的固碳效应,尤其是在13C方面,主要原因在于根系的碳活力尤为突出,有利于碳素的转运,便于输入到植株其他器官[12-14]。而对于地下部分而言,其光合碳的分配呈现尤为突出的差异,无论是玉米、大麦,还是水稻,随着生长发育期的推进,碳素更多地集中于植株地上部分,而牧草则不明显[21-23]。无论是芦苇还是苔草,其均有叶面积指数较大的群落特点,具有较强的光合作用效果,得益于这一特性,因此呈现较强的光合碳固定能力,进而造成了植被在自养呼吸方面较弱,这有利于植被碳的积累[24-25]。对于藜蒿和水蓼叶片而言,其氮浓度水平并不高,且光合作用效果较弱,只有在长时间光合作用下方可达到有效的碳平衡。
对于传统的有机碳测定而言,并不能对其开展有效的量化分析。基于此,目前倾向于采取稳定同位素示踪技术13C分析法,不仅从植株碳输入的角度分析碳转移及分配,而且对根际土壤碳平衡作用机理进行量化分析[19]。对于13C而言,其具有突出的稳定性特点,借助于多种脉冲标记,能够对植株不同生长期的碳输入进行量化分析,因此在碳平衡研究过程中运用广泛。为了探究湿地植被光合碳的作用机理,本研究借助于13CO2脉冲标记法,通过连续对比分析得知,虽然植被有所不同,但是对于其叶、茎、根及土壤而言,其13C固化能力较强,这也印证了该方法的有效性。受不同植被特性的影响,其13C丰度方面呈现较大差异,而对于同一植被而言,其不同器官的13C丰度也存在尤为突出的差异,其中含量最高的是茎部,而最低的是根系[20],这与光合碳的传输密切相关。
通过对脉冲标记的对比分析得知,在光合作用下,植被能够对13C进行有效的存储,进而通过植株部分进行地上、地下植株部位的传输。通过长达21 d的13C标记得知,其值出现了较为明显的下降,更多的光合碳转移至地下部分,尤其是土壤。进行长达21 d的标记之后发现,虽然植被不同,且根、茎等器官存在较大差异,其13C含量变化依然与最初标记阶段表现一致。对于标记当天而言,其同化13C更多地分配于茎叶,而土壤最低;进行长达21 d的标记之后发现,13C更多地分配于根系部位,其次是茎叶,而土壤最低。对于根系生长而言,必要的碳元素发挥着无可替代的作用,在此过程中更倾向于以沉积物的形式加以利用,此外,根系呼吸也会将一部分13C进行释放[22]。通过相关分析得知,地上生物量与茎叶13C之间的正相关关系尤为突出,而对于地下生物量而言,其与根、土壤13C的正相关通过了0.05检验;说明生物量在光合碳分配方面具有突出的制约效应。

