持续腰大池引流配合超早期显微手术在颅内动脉瘤破裂治疗中的临床应用
袁新春,董伟,刘学永
江苏省沛县人民医院神经外科,江苏沛县 221600
颅内动脉瘤是临床危重症之一,是引起脑血管意外死亡的主要原因,据统计,我国颅内动脉瘤患病率高达10%左右,尤其以高血压、高血脂、糖尿病患者为颅内动脉瘤高发人群,对生活、健康甚至生命安全均造成危害。临床研究发现,颅内动脉瘤破裂是造成患者死亡的直接原因,占比>70%,且患者预后具有极高的致残率,>35%的颅内动脉瘤破裂患者遗留后遗症[1]。目前临床治疗颅内动脉瘤多采取手术方式,但手术时机的选择存在争议,一些医师认为动脉瘤破裂出血早期患者存在脑血管痉挛、脑水肿等情况,手术难度及风险较高,一些医师认为颅内动脉瘤破裂48 h内进行超早期手术能够降低脑血管痉挛出现,同时患者预后效果佳[2]。而持续腰大池引流则能够降低脑脊液中内皮素浓度,预防脑血管痉挛,两者联合治疗对提高治疗效果,促进患者预后恢复具有意义影响。简单随机选取2017年1月—2021年6月沛县人民医院收治的颅内动脉瘤破裂患者50例,简述超早期显微手术配合持续腰大池引流的临床应用价值,现报道如下。
1 资料与方法
1.1 一般资料
简单随机选取该院收治的颅内动脉瘤破裂患者50例,以双盲法进行随机分组,对照组25例,男18例,女7例;年龄44~78岁,平均(60.33±1.34)岁;根据患者蛛网膜下腔出血分级法[3]显示,8例为Ⅰ级,11例为Ⅱ级,5例为Ⅲ级,1例为Ⅳ级。观察组25例,男17例,女8例;年龄44~79岁,平均(60.35±1.33)岁;患者蛛网膜下腔出血分级结果显示,7例为Ⅰ级,12例为Ⅱ级,4例为Ⅲ级,2例为Ⅳ级。两组患者一般资料对比,差异无统计学意义(P>0.05),具有可比性。纳入标准[4]:①所有患者经影像检查均确诊为颅内动脉瘤破裂情况;②患者均为首次发病;③患者均于病发后24 h内入院;④患者均同意参与且积极配合该次研究。排除标准:①蛛网膜下腔出血Ⅴ级患者;②出现脑室扩张情况的患者;③抵触配合研究患者。研究通过医院伦理委员会批准。
1.2 方法
两组患者均由同一主刀医生实施超早期显微手术,在开颅下对破裂的动脉瘤上下游给予夹闭治疗。首先打开颅底的脑池,低速释放脑脊液,待脑组织回缩后打开脑外侧裂。经由侧裂,逐层切开脑组织,根据术前影像资料寻找脑血管瘤的具体位置,充分暴露病灶后对其瘤体上下游的颈部予以充分剥离,夹闭后钝性分离破裂的瘤体病灶。待动脉瘤病灶完全剥离后,使用罂粟碱溶液对手术区域给予反复冲洗,确认无活动性出血点后将脑组织恢复原位,关闭骨窗和表皮组织。
1.2.1 对照组 对照组患者在超早期显微手术的基础上联合常规腰穿引流,每日进行常规腰穿,操作时取侧卧位,选择在腰椎L4~L5或L3~L4间进行穿刺,先给予表皮消毒和局部浸润式麻醉处理,待麻醉生效后选择规格为7号或9号的腰穿针穿刺,在连接导管后缓慢将脑脊液引流出体外。要求每次引流时的具体剂量控制在30~60 mL,直至脑脊液细胞计数维持在500×106/L在肉眼观察下,引流液清亮后即可结束引流干预。
1.2.2 观察组 观察组患者在超早期显微手术的基础上联合持续腰大池引流,需在手术结束的24 h内持续引流。操作时同样选择侧卧位,穿刺点选择在腰大池的L3~L5间隙,穿刺成功后在蛛网膜下腔的10~15 cm处置入硅胶软导管,规格为直径1 mm,在软管的末端连接引流袋,中间安装控制阀,将引流时的速度控制在2~5滴/min,术后24 h内的引流总量控制在200~350 mL间,直至脑脊液细胞计数维持在500×106/L,引流液肉眼观察下清亮后即可结束引流干预。
1.3 观察指标
监测两组患者术后3、6、9、12 d脑脊液压力及脑脊液红细胞数量变化情况。利用NIHSS评分对两组患者治疗前后神经功能进行评估,分数设定0~45分,分数越高,患者神经功能缺损程度越严重,反之越轻。利用Barthel指数对两组患者治疗前后生活能力进行评估,总分为100分,分数与患者生活能力呈正相关。对比两组患者术后并发症情况。
1.4 统计方法
采用SPSS 25.0统计学软件分析数据。计量资料经检验符合正态分布,以(±s)来表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后不同时间脑脊液压力对比
观察组患者术后3、6、9、12 d脑脊液压力值均明显低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者不同时间脑脊液压力对比[(±s),mmH2O]Table 1 Comparison of cerebrospinal fluid pressure at different times after surgery between the two groups[(±s),mmH2O]
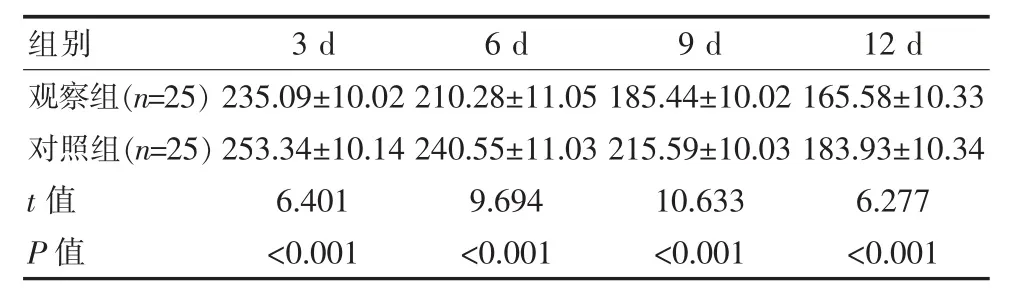
表1 两组患者不同时间脑脊液压力对比[(±s),mmH2O]Table 1 Comparison of cerebrospinal fluid pressure at different times after surgery between the two groups[(±s),mmH2O]
?
2.2 两组患者不同时间脑脊液红细胞数量对比
观察组患者术后3、6、9、12 d脑脊液红细胞数量均明显低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者不同时间脑脊液红细胞数量对比[(±s),×106/L]Table 2 Comparison of the number of red blood cells in the cerebrospinal fluid of patients after surgery between the two groups[(±s),×106/L]

表2 两组患者不同时间脑脊液红细胞数量对比[(±s),×106/L]Table 2 Comparison of the number of red blood cells in the cerebrospinal fluid of patients after surgery between the two groups[(±s),×106/L]
?
2.3 两组患者治疗前后神经功能及Barthel指数对比
治疗前评估两组患者神经功能、生活能力差异无统计学意义(P>0.05);治疗后观察组患者神经功能评分低于对照组,Barthel指数高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者治疗前后神经功能及Barthel指数对比[(±s),分]Table 3 Comparison of neurological function and Barthel index of patients before and after treatment between the two groups[(±s),points]

表3 两组患者治疗前后神经功能及Barthel指数对比[(±s),分]Table 3 Comparison of neurological function and Barthel index of patients before and after treatment between the two groups[(±s),points]
?
2.4 两组患者并发症对比
观察组患者术后并发症总发生率明显低于对照组,差异有统计学意义(P<0.05)。见表4。
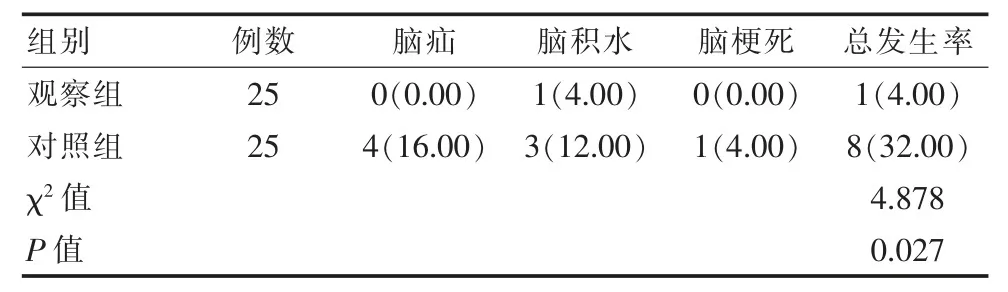
表4 两组患者并发症对比[n(%)]Table 4 Comparison of complications between the two groups[n(%)]
3 讨论
颅脑内动脉瘤属于脑组织常见病症之一,其正常情况下对人体的危害相对较小,但如发生破裂即会给患者带来极大的危害,通常当其处于较大情绪波动、高体力运动、用力排便、骤然发力等情况下更容易导致动脉瘤破裂。一旦病灶破裂就会引发急性脑出血症状,出血灶在短时间内会压迫脑实质、脑神经组织等,因此致残率、致死率均相对较高。目前针对该病变的首推治疗方式为显微外科手术,借由显微镜下观察病灶的状态,并给予夹闭和切除,有效清除颅内出血灶的同时,还可将动脉瘤血液供给完全中断,也是目前最有效的治疗方式[5-6]。
显微外科手术应用在动脉瘤破裂患者时,不同研究者所持观点也具有一定差异,部分群体主张在动脉瘤破裂的10 d后再行手术,其主要是由于出血灶形成的早期不仅伴有脑水肿症状,且脑组织内血管还可能具有痉挛的情况,加之患者本身各种全身性症状,因此不利于实施开颅手术,另有部分学者则认为可在破裂后的3 d内即可进行手术[7-8]。超早期手术概念则指的是在动脉瘤破裂的48 h内进行手术,其目的在于更早地对出血病灶和动脉瘤病灶予以清除,此时出血灶内的红细胞还未完全溶解,因而氧和血红蛋白的浓度相对较低。而如果延后手术时间,则会导致红细胞或凝血块溶解率大幅提升,此时出血灶内的氧和血红蛋白浓度便会大幅提升,脑血管痉挛的概率也会随之提升,加之凝血块和周围脑组织的粘附性进一步提升,也增加了手术操作的难度。但需要注意的是,超早期阶段脑组织的水肿症状较为活跃,在手术操作时不利于充分暴露动脉瘤病灶,也更容易在分离和切割时损伤周围脑组织,因此超早期动脉瘤切除手术需配合显微技术,以提升操作的精确性[9-11]。
显微下超早期手术实际操作时还需注意几点内容:①手术前需为患者提供适量的脱水剂,并利用短暂通气法等手段干预,有效降低颅内压强,从而在操作时保护脑组织;②选择合理的入路方向,可由侧裂沿脑组织自然肌理探入,最大程度减少对脑组织的机械损伤;③需尽可能针对脑池、蛛网膜下腔进行解剖,并以锐性分离的方式处理蛛网膜小梁结构,释放部分脑脊液后减少对周围脑实质的牵拉影响[12-14];④先对远离动脉瘤病灶的血肿灶给予切除,再夹闭动脉瘤病灶上下游的血管,并给予钝性分离;⑤需要在颅内压下降到稳定程度后才能给予颅内解剖和病灶分离,如颅内压相对较高则在分离病灶时容易造成二次破裂和颅内出血;⑥在分离动脉瘤前需充分解剖周围的血管,以便提升夹闭的准确性,并给予各分支血管保护,避免对穿支动脉造成损伤;⑦针对存在脑实质内积水的患者群体,需先开颅穿刺入脑室引流,待颅内压稳定后方可开展手术[15-16];⑧如手术时发现患者脑实质肿胀或术中较为严重,则需先对颞叶前部,甚至前中部给予切除,如仍无法充分暴露动脉瘤病灶,则需将颞角打开后引流脑脊液;⑨在切除动脉瘤时需根据病灶的相对位置、实际体积、形状等选择对应规格的动脉夹,确保血管夹闭后不会出现出血的情况。
与此同时,在近几年的研究中发现可利用腰大池引流技术配合超早期手术,该引流治疗的目的在于控制术后脑脊液当中溶解的血红蛋白、内皮素等的含量,也可有效降低颅内压降,从而降低术后患者的昏迷深度,有效降低苏醒后的头痛、血管痉挛等程度,控制脑梗死的发生概率。且引流后降低血红蛋白浓度,可降低对神经组织和细胞产生的不良刺激,控制蛛网膜下腔粘连程度,抑制术后脑积水的发生概率[17-18]。但传统引流操作下有较高概率引发脑疝,进而造成患者需二次手术,导致临床病死率大幅提升。持续性腰大池引流则可以更好地控制引流速度和单位时间内引流量,使得颅内压下降速度更加均匀,避免对脑组织、脑神经等的过度影响,降低传统一次性快速引流导致的颅内压梯度性下降的危害[19-20]。另外持续性引流还可避免反复腰穿操作带来的痛苦,也能降低感染的发生概率。
该次研究结果显示,观察组术后并发症率仅为4.00%,明显低于对照组32.00%(P<0.05)。该研究结果与刘国华等[20]发表文章结果观察组患者术后并发症总发生率16.67%低于对照组40.00%(P<0.05)相一致。
综上所述,利用持续性腰大池引流可以更好地降低颅内压力,快速稀释脑脊液中红细胞含量,从而有效预防术后脑疝的并发率,值得在临床实践应用中推广。

