卵白蛋白和大豆分离蛋白相互作用对凝胶结构及性质的影响
唐婷婷, 杨玲玲, 蒋 艳, 涂勇刚, 徐明生
(江西农业大学 江西省农产品加工与质量控制工程实验室,江西 南昌 330045)
大豆分离蛋白 (Soybean protein isolate,SPI)由于具有良好的乳化性、 填充性以及凝胶性等性质,在食品中应用广泛[1]。 有研究发现在肉糜类产品中添加改性大豆分离蛋白可以改善肉的凝胶性,显著提高猪肉肌原纤维蛋白凝胶的弹性和硬度,显著提高制品的含水率和蒸煮产量[2-4]。 加热条件下,大豆分离蛋白的多肽链展开暴露更多的作用位点,然后发生聚集形成凝胶网络结构。 大豆分离蛋白的主要成分7S 球蛋白和11S 球蛋白 (占总蛋白质质量的65%~80%)是通过氢键和二硫键形成的致密的球状结构,所以天然的大豆分离蛋白分子柔性较低[5],且采用碱提酸沉和喷雾干燥等手段进行商业化生产,使部分蛋白质发生变性,凝胶性降低[6]。 因此,改善大豆分离蛋白的凝胶性,对其在食品加工中的应用至关重要。
两种蛋白质复合是一种简单方便、经济有效的方法,可以提高蛋白质的功能特性[7-9]。 当两种蛋白质复合后,如果其中一种蛋白质的浓度在自身可形成凝胶的临界浓度下,该蛋白质可能在复合凝胶中作为非凝胶组分,形成填充凝胶。 当复合蛋白质之间产生了物理结合,作为非凝胶组分的蛋白质可能会通过非特异性的相互作用随机吸附在连续相蛋白质凝胶网络上,或是发生共聚合形成杂合的凝胶网络,又或是不同的蛋白质之间完全兼容形成相互穿插的聚合网络[7-8]。 不同种类蛋白质复合可以得到性能更好的凝胶。
卵白蛋白(Ovalbumin,OVA)是蛋清中含量最丰富的蛋白质,约占总蛋白质质量的54%,属于球状蛋白质的一种,其三级结构包括排列在外部的亲水氨基酸和主要排列在三级结构内部的疏水氨基酸,含量(质量分数)达到50%以上,相对分子质量约为45000, 每个蛋白质分子含有4 个游离巯基和1 个二硫键[10]。卵白蛋白因其较好的保水性和凝胶性、良好的经济性在食品工业中应用广泛。 有研究表明使用卵白蛋白粉,在不增加成本前提下,能够改善肉糜制品的凝胶强度,使产品的风味更好,提高出品率[11];在鱼糜制品中添加质量分数2%的卵白蛋白粉可以提高鱼糜的凝胶强度[12]。 Su 等研究了不同配比和蛋白质浓度下大豆分离蛋白和蛋清复合凝胶的性质和二级结构,发现在大豆分离蛋白与蛋清质量比为1∶1 时,形成的凝胶结构均匀、颗粒较小,弹性和保水性有较高的提高[8]。 基于此,作者选择蛋清中的主要蛋白质卵白蛋白为添加物,通过在大豆分离蛋白中添加卵白蛋白,测定游离巯基、表面疏水性和分子间作用力,研究卵白蛋白和大豆分离蛋白相互作用对凝胶结构和性质的影响,为大豆分离蛋白在食品加工中的应用提供理论基础。
1 材料与方法
1.1 实验材料
卵白蛋白、甘氨酸、DTNB:美国Sigma 试剂公司产品;大豆分离蛋白:山东山松生物公司产品;戊二醛、尿素:国药集团化学试剂有限公司产品;β-巯基乙醇:北京鼎国昌盛生物技术公司产品。
1.2 卵白蛋白和大豆分离蛋白溶液的配制
分别制备质量分数为10%的卵白蛋白(OVA)溶液和质量分数为10%大豆分离蛋白(SPI)溶液,pH 调至中性,4 ℃过夜保存。参考文献[8]的方法,将卵白蛋白溶液和大豆分离蛋白溶液按质量比1∶1 混合,总固形物质量分数为10%,溶液混合均匀后放入4 ℃冰箱过夜备用。
1.3 复合凝胶的制备
将配制好的复合蛋白质溶液(OVA-SPI 溶液),置于恒温水浴槽中于85 ℃加热30 min, 待凝胶形成后迅速冷却, 制好的凝胶样品于4 ℃下放置过夜,待用。
1.4 蛋白质游离巯基质量摩尔浓度的测定
根据Jia 等的方法确定游离巯基(SH)质量摩尔浓度[13]。 在0.5 mL 卵白蛋白溶液、大豆分离蛋白溶液和复合蛋白质溶液中加入8 mol/L 尿素、10 mmol/L EDTA、0.1 mol/L KH2PO4(pH 为6.0) 和100 μL Ellman 试剂,将混合物置于室温下25 min,用紫外可见分光光度计在412 nm 处测量吸光度, 游离巯基基团的摩尔消光系数为13600 mol/(L·cm)。游离巯基质量摩尔浓度的计算:
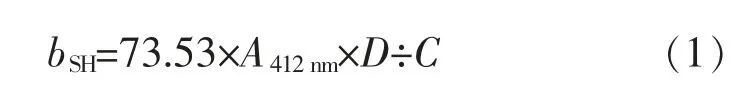
式中:bSH为游离巯基质量摩尔浓度,μmol/g;73.53经单位换算得到1×106/1.36×104mol/(L·cm);A412nm为所测定的紫外可见分光光度吸收度;D 为稀释因子;C 为样品上清液的蛋白质质量浓度,mg/mL。
1.5 表面疏水性的测定
根据参考文献[14]的方法,稍有修改。以1-苯胺萘-8-磺酸(ANS)为疏水荧光探针。 将凝胶溶液(1 mg/mL)稀释成一系列不同蛋白质质量浓度的溶液, 质量浓度范围为0.1~0.5 mg/mL。 将25 μL(8 mmol/L)ANS (0.1 mol/L 磷酸盐缓冲液,pH 6.0)溶液加入5 mL 样品,混合均匀,在25 ℃下避光20 min,使用荧光分光光度计在激发波长374 nm 和发射波长485 nm 下测量混合物的荧光强度。 荧光强度随蛋白质质量浓度变化曲线的初始斜率称为S0-ANS。
1.6 分子间作用力的测定
将蛋白质凝胶分别溶解在4 种溶剂中,其中S1溶液为0.6 mol/L NaCl,S2 溶液为0.6 mol/L NaCl 和1.5 mol/L 尿素,S3 溶液为0.6 mol/L NaCl 和8 mol/L尿素,S4 溶液为0.6 mol/L NaCl、8 mol/L 尿素和0.5 mol/L β-巯基乙醇。 取0.3 g 的样品溶解于2.7 mL S1 溶液中,12000 r/min 均质1 min, 静置30 min,10000 r/min 离心20 min。 S1 溶液的沉淀物溶解于2.7 mL 的S2 溶液中,重复上述过程。 对S3 溶液和S4 溶液以相同的方法进行操作。 收集各上清液,用双缩脲法测定上清液中的蛋白质质量。 上清液中的蛋白质质量即为蛋白质凝胶的溶解度。
1.7 微观结构的测定
使用扫描电子显微镜(SEM)观察复合凝胶的微观结构, 将制成的凝胶样品切成厚度约为5 mm 的薄片, 置于体积分数为2.5%的戊二醛固定液(0.1 mol/L pH 7.2 的磷酸盐缓冲液)固定2 h,冲洗多次除去残余的有机试剂, 再用体积分数60%~10%梯度的乙醇溶液洗脱,每次10 min,再冷冻干燥、喷金处理,进行观察。
1.8 二级结构的测定
采用溴化钾(KBr)压片法进行样品的红外光谱分析。 将干燥后的凝胶样品与溴化钾粉末进行混合,研磨后压成透明薄片,在400~4000 cm-1波长内进行扫描,以4 cm-1的分辨率进行32 次扫描。 使用OMNIC 6.0 数据收集软件分析光谱数据[15]。
1.9 凝胶保水性的测定
称取约8 g 的样品放入离心管后称取总质量,于4 ℃、5000 r/min 离心15 min, 沥净水分后称质量。 保水性(WHC)计算公式如下:

式中:BWHC为保水性,%;m0为离心管质量,g;m1为离心前凝胶和离心管总质量,g;m2为离心后凝胶和离心管总质量,g。
1.10 凝胶的质构测定
对样品进行TPA 分析,主要参数为:探头类型为P/36R,测前速度为3.0 mm/s,测中速度和测后速度为5 mm/s,压缩比为40%,触发力为5 g。 每个样品重复6 次,取平均值。
1.11 数据分析
结果使用SPSS 进行统计分析, 所有数据均以平均数±标准差表示。 采用单因素方差分析(ANOVA) 确定统计学差异。 平均数比较采用Duncan 检验,差异有统计学意义(P<0.05)。
2 结果与分析
2.1 凝胶的理化性质
2.1.1 蛋白质溶液的游离巯基质量摩尔浓度 游离巯基是蛋白质中最活跃的基团,位于蛋白质分子表面,氧化后可以形成新的二硫键,在维持复合蛋白质结构稳定性方面起着重要作用[16]。 OVA 溶液、SPI 溶液与OVA-SPI 溶液中的游离巯基质量摩尔浓度如图1 所示。 由图1 可知,OVA-SPI 溶液中游离巯基的质量摩尔浓度显著低于OVA 溶液 (P<0.05),显著高于SPI 溶液(P<0.05)。 一个卵白蛋白分子含有4 个游离巯基,大豆分离蛋白中游离巯基较少,两者复合后,溶液中的游离巯基质量摩尔浓度则低于卵白蛋白溶液,高于大豆分离蛋白溶液。
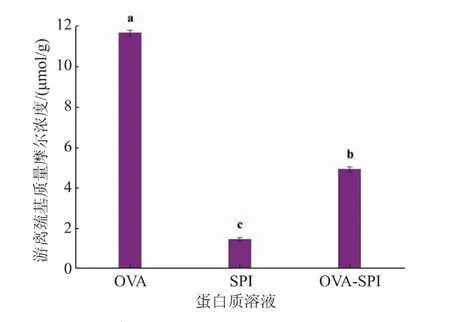
图1 蛋白质溶液的游离巯基质量摩尔浓度Fig. 1 Free sulfhydryl content in protein solution
2.1.2 凝胶的表面疏水性 表面疏水性是表征蛋白质分子表面与极性水环境接触的疏水基团数目的指标,与蛋白质分子的功能性质密切相关[17]。OVA凝胶、SPI 凝胶和OVA-SPI 凝胶的表面疏水性如图2 所示。大豆分离蛋白与卵白蛋白结合后,凝胶的表面疏水性显著降低,是由于大豆分离蛋白与卵白蛋白结合过程中三级结构展开,并发生一系列的结构折叠变化,从而将大量疏水基埋藏在蛋白质内部[18],表明大豆分离蛋白与卵白蛋白之间通过疏水作用结合。
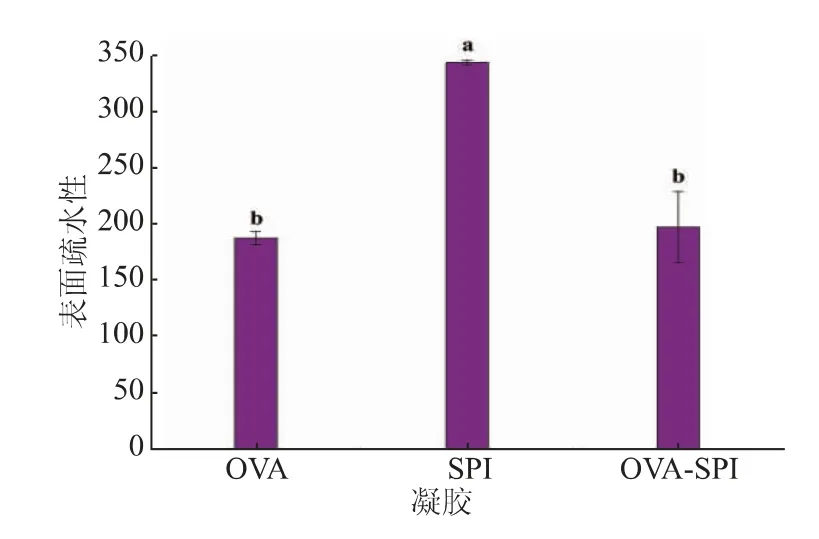
图2 凝胶的表面疏水性Fig. 2 Surface hydrophobicity of the gel
2.1.3 凝胶的分子间作用力 蛋白质聚集通常是通过对球状蛋白质进行热处理来实现的,在变性温度以上加热会导致蛋白质部分展开,从而暴露先前埋藏在其结构内的基团,促使蛋白质之间通过疏水相互作用、氢键和二硫键形成不同分子间的聚集[19]。蛋白质分子间的作用力不同,形成凝胶的微观结构也会存在差异。 如图3 可知,离子键和二硫键是卵白蛋白形成凝胶的主要分子间化学力,疏水相互作用和离子键是大豆分离蛋白形成凝胶的主要作用力,而在复合凝胶中起作用的则主要是疏水相互作用和二硫键,说明不同种类蛋白质复合会改变分子间的相互作用。
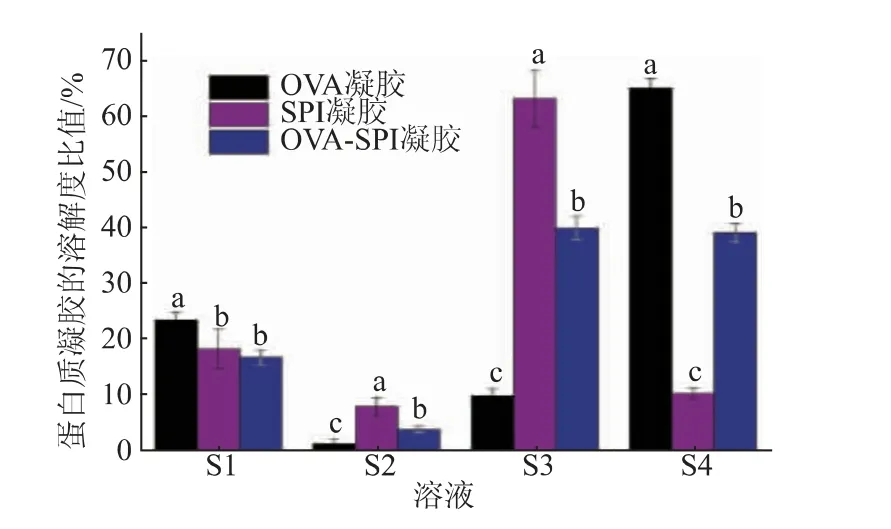
图3 分子间作用力的变化Fig. 3 Changes in intermolecular forces
在S1 溶液中,与OVA 凝胶和SPI 凝胶相比,复合凝胶的溶解度下降,是由于蛋白质间的静电吸引增强。 在实验pH 条件下(pH 7.0),整个体系带负电荷,离子键的减小,说明蛋白质间的电荷减少,两种蛋白质分子间出现了静电引力,导致蛋白质分子间的排斥力下降[15]。在S2 溶液中复合凝胶的溶解度显著高于OVA 凝胶, 表明卵白蛋白和大豆分离蛋白之间通过氢键相互结合,或者卵白蛋白的添加可能促进了大豆分离蛋白分子间的氢键相互作用。 疏水相互作用是评价蛋白质结构变化的常用指标,是支撑凝胶结构的一部分,与最终凝胶的性质密切相关[17]。在S3 溶液中,复合凝胶的溶解度显著高于OVA 凝胶,说明疏水相互作用是复合蛋白质形成凝胶的主要作用力。 二硫键的含量对凝胶的形成很重要。 在S4 溶液中,复合凝胶的溶解度显著低于OVA 凝胶,这与游离巯基质量摩尔浓度的实验结果一致。 原因是卵白蛋白中游离巯基含量最多,在加热形成凝胶的过程中, 游离巯基基团发生SH-SS 交换反应,凝胶网络形成,二硫键增加。 但是卵白蛋白中二硫键交联过于明显,会产生不可逆的凝胶,导致凝胶硬度较大。 综上,与OVA 凝胶相比,将卵白蛋白和大豆分离蛋白复合后,降低了蛋白质分子间的离子键和二硫键,提高了疏水相互作用和氢键。
2.2 凝胶的二级结构
凝胶网络结构与蛋白质二级结构具有密切的关联性(见图4),其中图4(b)为1600~1700 cm-1的二阶导数图谱。 位于酰胺Ⅰ带C=O 和N—H 之间氢键性质的不同而引起的不同的振动频率可以反映蛋白质或多肽的α-螺旋、β-折叠和无规则卷曲等结构[20]。 其中酰胺Ⅰ带中的各个峰对应于以下的二级结构:1650~1659 cm-1对应α-螺旋,1640~1610 cm-1对应β-折叠,1660~1700 cm-1对应β-转角,1650~1640 cm-1与无规则卷曲有关[21]。由图4 可知,OVA 凝胶、SPI 凝胶和复合凝胶在3300 cm-1附近都有一比较明显的吸收峰, 该峰是由蛋白质—OH、N—H 伸缩振动产生的。 在4000~400 cm-1波长范围内可以看到,OVA 凝胶、SPI 凝胶以及复合凝胶的红外光谱吸收峰没有明显的差异,在二阶导图中发现蛋白质二级结构有显著变化。 3种凝胶的二级结构主要是分子内β-折叠和分子间β-折叠,复合凝胶分子间β-折叠吸光度下降,并伴随着分子内β-折叠强度增强,说明两种蛋白质分子间发生了相互作用,形成了更稳定的结构。 有研究表明α-螺旋与β-折叠结构的比例越低, 凝胶中自由水含量越低,结合水含量越高,凝胶保水性和强度更理想[22],在3 种凝胶中,复合凝胶的α-螺旋与β-折叠结构的比例最低,其次是OVA 凝胶,最后是SPI 凝胶,这与保水性和质构的实验结果一致。 说明合适比例的卵白蛋白和大豆分离蛋白复合能促进蛋白质分子间的相互作用、 二级结构间的转化,形成结构均匀、保水性强的凝胶。
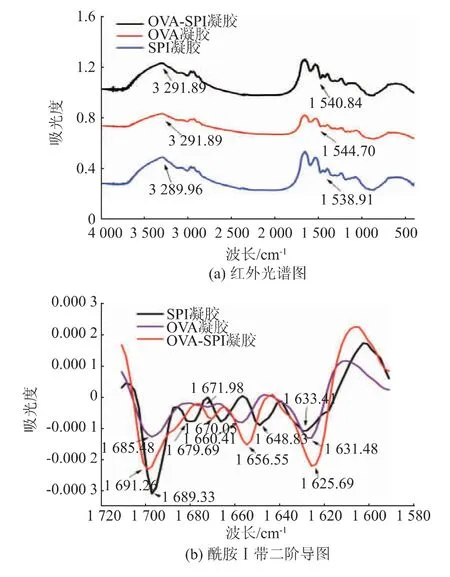
图4 凝胶的二级结构Fig. 4 Secondary structure of the gel
2.3 凝胶的微观结构
通过对OVA 凝胶、SPI 凝胶以及复合凝胶的微观结构进行观察,分析蛋白质相互作用对凝胶结构的影响。 由图5 可知,OVA 凝胶、SPI 凝胶和复合凝胶内部形态有明显的不同。 影响蛋白质凝胶性质的主要因素有环境条件(如pH、离子强度和矿物质含量)、蛋白质组成、变性程度和浓度、加工条件(如加热和冷却速度)[23]。 电镜图像显示:OVA 凝胶在结构上有许多小孔, 表面较为光滑;SPI 凝胶结构粗糙,颗粒较大;复合凝胶结构致密,均匀性增加,填充颗粒呈线性结构,该结构的凝胶具有高弹性。SPI 凝胶结构粗糙是因为大豆分离蛋白主要由7S 和11S 球蛋白组成,两种蛋白质的变性温度存在差异,在实验设定温度下(85 ℃),7S 球蛋白发生变性,而11S球蛋白由于含有大量的二硫键(每个分子18~20 个二硫键),导致分子紧密折叠,在85 ℃下未完全变性,没有完全溶解和展开的11S 球蛋白可能会掺杂在凝胶网络结构中,形成结构粗糙的凝胶[8]。 由于卵白蛋白(相对分子质量45000)与大豆分离蛋白(7S球蛋白相对分子质量为140000~190000,11S 球蛋白相对分子质量为300000~400000) 在分子大小和相互作用上的差异,卵白蛋白可以填补大豆分离蛋白的大分子缺口,使复合凝胶结构致密、均匀性好,这和Luo 等的实验结果一致[24]。 同时,复合凝胶中的不溶性固体作为非凝胶组分,散布在三维网络中,形成结构致密的凝胶。 有研究表明,乳清分离蛋白和大豆分离蛋白按照质量比1∶1 复配形成的复合凝胶网络结构的均匀性和有序性显著高于大豆分离蛋白凝胶[25]。 说明不同蛋白质复合可以改善大豆分离蛋白凝胶的微观结构,形成均匀有序的凝胶。

图5 凝胶的微观结构Fig. 5 Microstructure of the gel
2.4 凝胶的保水性
蛋白质类食品的吸水能力和防止其在外力作用时渗出水分的能力(所谓的保水性)对食品的质地和口感至关重要[26]。如图6 所示,复合凝胶的保水性高于OVA 凝胶和SPI 凝胶。 这与Comfort 等的研究结果[27]相似,均是在特定比例下出现了蛋白质间的协同增强效应。 有研究表明蛋白质凝胶的保水性通常取决于凝胶的硬度和微观结构,具有细小结构的凝胶比粗糙的凝胶具有更高的保水能力[28],所以复合凝胶的保水性显著高于单一蛋白质凝胶。 由于凝胶硬度和微观结构的相互作用,相似微观结构的蛋白质网络在保水性上存在差异[29]。此外,蛋白质的保水性、凝胶性还与溶液中蛋白质和水相互作用直接相关,复合凝胶可以通过提高溶液中蛋白质和水的相互作用改善自身保水性。

图6 凝胶的保水性Fig. 6 Water holding capacity of the gel
2.5 凝胶的硬度和弹性
硬度和弹性是分析食品组织特性时常用的参数[30]。OVA 凝胶、SPI 凝胶以及复合凝胶的质构如图7 所示。 由图7 可知, 复合凝胶的硬度高于SPI 凝胶,是由于二硫键的增强使卵白蛋白和大豆分离蛋白之间交联增加,以及蛋白质分子之间氢键的形成[30]。 这一结果表明,在中性条件下,可以通过添加卵白蛋白提高大豆制品的硬度。
弹性是指凝胶在解压后恢复到原来形状的程度[31]。 如图7 所示,复合凝胶的弹性高于OVA 凝胶和SPI 凝胶,与保水性的结果相一致。卵白蛋白的变性温度较低,受热后蛋白质分子优先聚集,而过快的聚集速度会导致分子链还未完全展开就发生随机交联形成结构较为粗糙的凝胶,导致弹性较低[32-33]。有研究报道大豆蛋白中的7S 球蛋白主要影响蛋白质凝胶的黏弹性,11S 球蛋白主要影响凝胶硬度,在本研究的加热温度下(85 ℃),11S 球蛋白未完全变性,导致产生的凝胶硬度较低[8,34]。 卵白蛋白和大豆分离蛋白复合后凝胶的弹性更好,原因是大豆分离蛋白由比卵白蛋白大得多的亚基组成,卵白蛋白可以被大豆分离蛋白包围,包裹体具有更好的蛋白质相互作用机会,能适当促进蛋白质的聚集,提高凝胶的弹性和保水性。

图7 凝胶的硬度和弹性Fig. 7 Hardness and elasticity of the gel
3 结语
在大豆分离蛋白中添加一定比例的卵白蛋白显著提高了SPI 溶液的游离巯基, 两种蛋白质主要通过疏水相互作用和二硫键形成聚集物,将疏水基团包埋在其内部,降低了SPI 凝胶的表面疏水性,形成结构致密、均匀好的凝胶,提高了凝胶的硬度、弹性和保水性。 两种蛋白质复合是提高蛋白质凝胶性以及在食品工业中应用的一种有效的方法。

