血清DNA甲基转移酶1、DNA甲基转移酶3a在宫颈癌及癌前病变中的表达及与人乳头瘤病毒感染的相关性
杨海荣,丰树菊,杜鹏琳
人乳头瘤病毒(human papilloma virus,HPV)感染是宫颈癌的主要致病因素,也是宫颈疾病发生发展的重要危险因素之一,HPV 与宿主DNA 相结合对基因的转录产生调节作用,从而导致宿主细胞发生恶性增殖,由宫颈炎开始,经过不典型增生,发展成为宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN),最终演变为宫颈癌[1]。宫颈癌是严重危害妇女健康的第二位恶性肿瘤,病人比例达到8%[2],但HPV 感染引起的宫颈上皮癌变的分子机制尚未明确,近年来DNA 甲基化的研究备受关注。CIN 作为宫颈癌前病变的主要疾病状态,是一组可进展成为宫颈癌的癌前病变统称,在宫颈包括子宫颈上皮非典型增生至原位癌一系列癌前病变的连续过程[3]。为降低宫颈癌的发生率及死亡率,改善预后效果,早期发现、早期诊断及早治疗尤为关键。DNA 甲基转移酶(DNA methyltransferases,DNMTs)催化DNA序列中胞嘧啶的5’碳原子发生甲基化修饰并成为5’-甲基胞嘧啶,从而进一步影响DNA 转录过程[4]。DNA甲基转移酶1(DNMT1)是机体内细胞中最丰富的的甲基转移酶,能够维持甲基化作用[5]。DNA 甲基转移酶3a(DNMT3a)是DNMTs 中的另一重要成员,在新形成甲基化时发挥关键作用[6]。高晓斌等[7]研究表明,DNMT1、DNMT3a 具有协同作用,均可作为结直肠癌早期诊断的潜在生物学指标。但目前DNMT1、DNMT3a 并未在宫颈癌诊断中应用,且有关宫颈癌及癌前病变中DNMT1、DNMT3a 表达的研究较少,本实验探究了宫颈癌及癌前病变病人血清DNMT1、DNMT3a 表达情况及与HPV 感染的关系。
1 资料与方法
1.1 一般资料选取2017 年9 月至2019 年9 月于焦煤集团中央医院收治住院的宫颈癌及癌前病变病人128 例作为观察组,年龄(40.33±7.96)岁,其中宫颈癌58 例为宫颈癌组,宫颈癌前病变70 例为癌前病变组。选取同期入院体检的正常女性志愿者50 例作为对照组,年龄(39.89±8.32)岁。将宫颈癌组病人按FIGO 分期:Ⅰ期组24 例,Ⅱ期组21 例,Ⅲ期组13 例。将宫颈癌前病变病人根据组织病理学检测明确临床分级,分为CIN Ⅰ级组26 例,Ⅱ级组23 例,Ⅲ级组21 例。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
纳入标准:(1)宫颈癌病人均经宫颈活检病理或术后病理检查确诊;(2)CIN 诊断标准参照中国抗癌协会制定的相关标准,即行阴道镜下多点活检且病理学检查结果诊断为CIN;(3)所有受试者年龄均≥20 岁,临床病理资料完整;(4)所有受试者及近亲属均知情同意并签署知情同意书。排除标准:(1)存在其他部位原发性恶性肿瘤,且向宫颈内转移者;(2)合并严重糖尿病、高血脂及自身免疫性疾病者;(3)合并严重精神系统疾病者;(4)合并严重心肝肾功能不全者。
1.2 主要试剂与仪器 DNMT1、DNMT3a ELISA 试剂盒(上海一研生物科技有限公司,货号EY-elisa4035、EY-elisa4034)、酶标仪(Wellscan MK3)、高速冷冻离心机(日立公司,TG-16WS)。
1.3 研究方法
1.3.1 样本的采集与保存所有受试者均于清晨空腹抽取静脉血5 mL,置于干燥管内,37 ℃水浴30 min,以3 000 r/min 离心3 min,分离上层血清,置于-80 ℃冰箱储存备用。
1.3.2 酶联免疫吸附法检测血清DNMT1、DNMT3a水平采用酶联免疫吸附(ELISA)法对血清DNMT1、DNMT3a 水平进行检测。试剂盒由上海一研生物科技有限公司提供,操作步骤严格按照试剂盒
说明书进行。
1.3.3 HPV 感染检测采用第二代杂交捕获法(hybrid capture Ⅱ,HC-Ⅱ)检测HPV-DNA,在收集的受试者宫颈分泌物及组织样本中加入裂解液使DNA双链分解为单链,加入RNA 探针与DNA 单链结合为RNA-DNA 杂交体,采用特异性抗体将RNA-DNA杂交体固定于微孔壁上,将该杂交体与有碱性磷酸酶的多个第二抗体结合,是信号放大,最后碱性磷酸酶使酶底物发光,利用光的强弱对含量进行判断,从而判断HPV 感染情况。若可见DNA 负荷量≥1.0 ng/L[相对发光度单位(RLU)/阳性定标阈值(CO)≥1.0]即为阳性,反之为阴性。高危HPV 包括HPV16、18、31、33、35、39、45、51、52、56、58、59、68。
1.3.4 病理切片观察取宫颈癌病人手术切除癌组织样本及癌前病变病人活检组织样本制成液基细胞学标本,进行HE 染色。分别观察宫颈癌及癌前病变病人病理切片形态。
1.4 统计学方法利用SPSS 21.0 软件进行统计学分析,计量资料采用±s进行描述,两组间比较采用t检验,多组比较采用单因素方差分析的方法,多组之间多重比较采用LSD-t检验。计数资料以例(%)表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 宫颈癌组与癌前病变组病理切片形态比较宫颈癌前病变病人组织边界较清晰,镜下示肿瘤细胞密度低,细胞有轻度异型性。宫颈癌组织细胞镜下示细胞核异型性较明显,肿瘤细胞密度高。
2.2 各组血清DNMT1、DNMT3a 表达水平比较与对照组相比,宫颈癌前病变组与宫颈癌组病人血清DNMT1、DNMT3a水平均显著升高(P<0.05),与宫颈癌前病变组相比,宫颈癌组病人血清DNMT1、DNMT3a水平显著升高(P<0.05),见表1。
表1 各组受试者血清DNMT1、DNMT3a表达水平/(µg/L,±s)
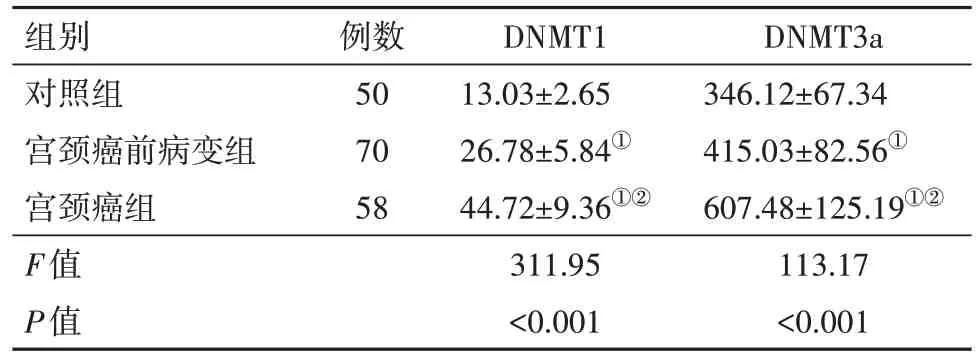
表1 各组受试者血清DNMT1、DNMT3a表达水平/(µg/L,±s)
注:DNMT1 为DNA 甲基转移酶1,DNMT3a 为DNA 甲基转移酶3a。①与对照组比较,P<0.05。②与宫颈癌前病变组比较,P<0.05。
组别对照组宫颈癌前病变组宫颈癌组F值P值例数50 70 58 DNMT1 13.03±2.65 26.78±5.84①44.72±9.36①②311.95<0.001 DNMT3a 346.12±67.34 415.03±82.56①607.48±125.19①②113.17<0.001
2.3 血清DNMT1、DNMT3a 水平与临床病理的相关性血清DNMT1、DNMT3a水平与宫颈癌病人FIGO 分期、CIN 分级、HPV 危险程度均相关,差异有统计学意义(P<0.05),见表2。
表2 DNA甲基转移酶1(DNMT1)、DNA甲基转移酶3a(DNMT3a)表达水平与临床病理相关性/(µg/L,±s)
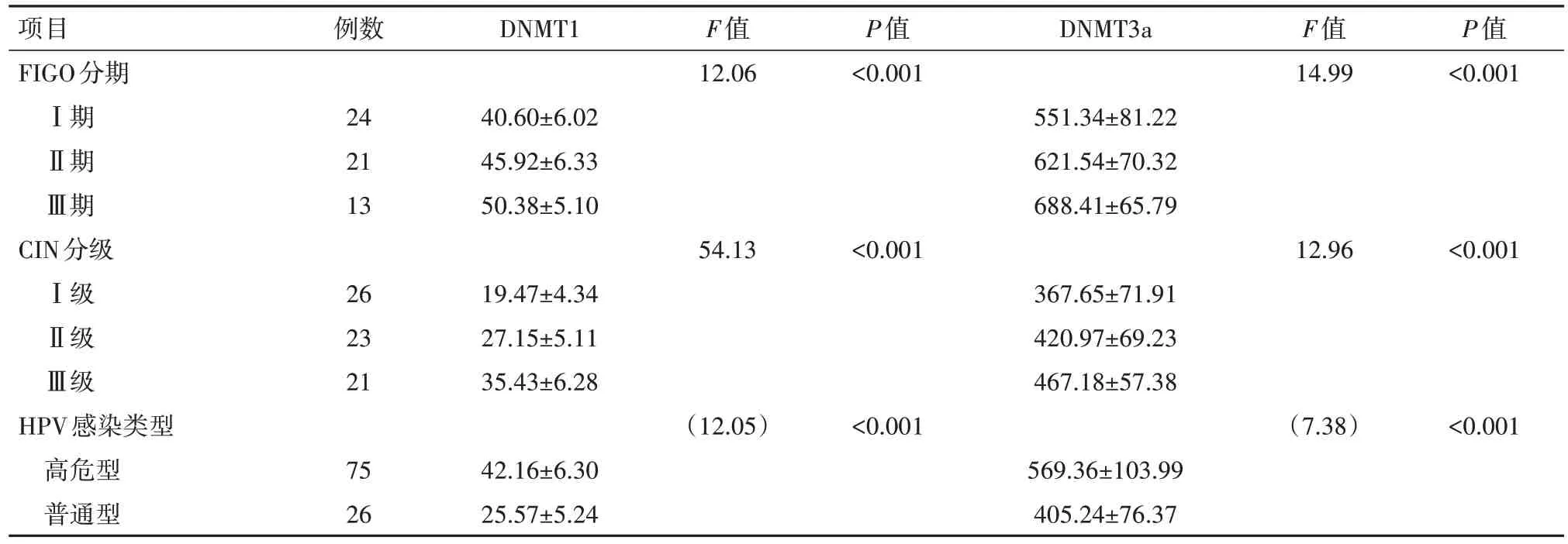
表2 DNA甲基转移酶1(DNMT1)、DNA甲基转移酶3a(DNMT3a)表达水平与临床病理相关性/(µg/L,±s)
项目FIGO分期Ⅰ期Ⅱ期Ⅲ期CIN分级Ⅰ级Ⅱ级Ⅲ级HPV感染类型高危型普通型例数24 21 13 26 23 21 75 26 DNMT1 40.60±6.02 45.92±6.33 50.38±5.10 19.47±4.34 27.15±5.11 35.43±6.28 42.16±6.30 25.57±5.24 F值12.06 54.13(12.05)P值<0.001<0.001<0.001 DNMT3a 551.34±81.22 621.54±70.32 688.41±65.79 367.65±71.91 420.97±69.23 467.18±57.38 569.36±103.99 405.24±76.37 F值14.99 12.96(7.38)P值<0.001<0.001<0.001
2.4 血清DNMT1、DNMT3a 水平对宫颈癌的诊断价值以血清DNMT1、DNMT3a 单个指标检验值及二者联合预测概率值为检验变量绘制ROC 曲线,结果显示,血清DNMT1、DNMT3a 诊断宫颈癌的AUC分别为0.918(95%CI:0.866~0.969)、0.875(95%CI:0.815~0.934),截断值分别为36.049 µg/L、563.431µg/L,特异性分别为92.9%、94.3%,敏感度分别为82.8%、70.7%;二者联合诊断宫颈癌的AUC 为0.960(95%CI:0.919~0.999),特异性为94.3%,敏感度为91.4%。见图1。
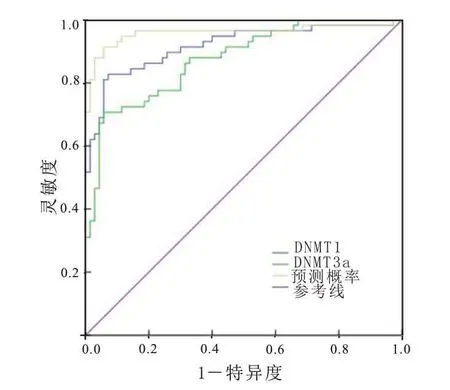
图1 血清DNA甲基转移酶1(DNMT1)、DNA甲基转移酶3a(DN MT3a)水平诊断宫颈癌的ROC曲线
2.5 各组HPV 感染情况比较宫颈癌组HPV 阳性率最高为100.00%,宫颈癌前病变组HPV 阳性率为61.43%,对照组HPV 阳性率为6.00%,三组HPV 感染情况比较,差异有统计学意义(χ2=98.11,P<0.05),见表3。

表3 各组HPV感染情况比较
2.6 HPV 感染与未感染病人血清DNMT1、DNMT3a 表达水平比较 HPV 感染组血清DNMT1、DNMT3a 水平高于HPV 未感染组;HPV 感染组健康女性血清DNMT1、DNMT3a 水平高于HPV 未感染组,均差异有统计学意义(P<0.05),见表4,5。
表4 HPV感染组与未感染组DNMT1、DNMT3a表达水平比较/(µg/L,±s)
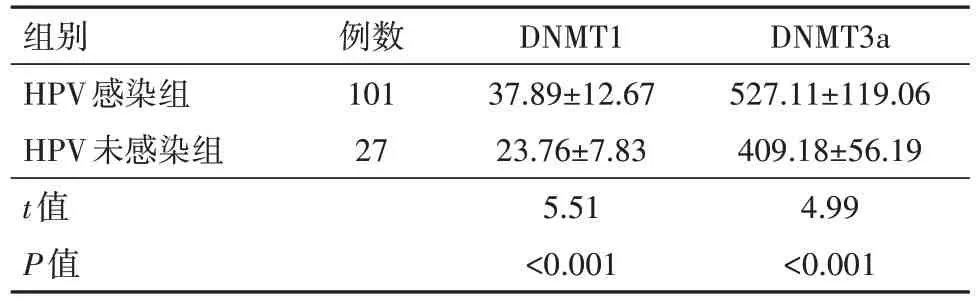
表4 HPV感染组与未感染组DNMT1、DNMT3a表达水平比较/(µg/L,±s)
注:DNMT1为DNA甲基转移酶1,DNMT3a为DNA甲基转移酶3a。
组别HPV感染组HPV未感染组t值P值例数101 27 DNMT1 37.89±12.67 23.76±7.83 5.51<0.001 DNMT3a 527.11±119.06 409.18±56.19 4.99<0.001
表5 HPV感染组与未感染组健康女性血清DNMT1、DNMT3a表达水平比较/(µg/L,±s)

表5 HPV感染组与未感染组健康女性血清DNMT1、DNMT3a表达水平比较/(µg/L,±s)
注:DNMT1为DNA甲基转移酶1,DNMT3a为DNA甲基转移酶3a。
组别HPV感染组HPV未感染组t值P值例数3 47 DNMT1 16.84±4.21 9.42±1.87 6.16<0.001 DNMT3a 364.28±70.22 291.14±52.61 2.30<0.001
3 讨论
宫颈癌是妇科生殖系统最常见的恶性肿瘤之一,是一种在多因素共同作用下发生的多步骤、漫长的病变过程,在全球范围每年新发病例50 万以上,随检出率及治疗手段的不断进步,死亡率有所改善,但仍无法令人满意[8]。临床中发现宫颈癌的发展是一个渐变过程,病程较长,CIN 病变是宫颈癌前期病症,在癌前病变向宫颈癌转化的过程中,多种基因改变导致的细胞增殖及分化异常,是细胞凋亡和增殖间的平衡状态被打破,从而导致细胞非正常生理状态增殖,形成宫颈恶性瘤变,给病人的生命健康带来严重威胁[9]。HPV 被认为是宫颈癌及癌前病变的重要致病因素,有研究表明,85%~95%的宫颈癌病人癌组织中能够检出HPV[10]。HPV 是一种DNA 病毒,其通过黏膜入侵靶细胞,将DNA 整合到宿主染色体,破坏宿主细胞的正常细胞周期,进而形成癌组织[11]。近年来,大量研究表明,表观遗传学的异常与宫颈癌的发生、发展有关,特别是DNA 甲基化在宫颈癌中起重要作用[12]。在DNA 甲基化过程中,DNMT 的表达水平与功能的改变是导致异常DNA 甲基化模式的因素之一[13]。目前对HPV 感染与甲基转移酶是否存在相关性研究较少,本实验探讨了宫颈癌及癌前病变病人血清DNMT1、DNMT3a表达水平及与HPV感染的关系。
DNMT1 是最早发现的DNA 甲基转移酶,定位于19p13.3-p13.2,其cDNA 全长5 434 bp,由1 495 个氨基酸组成[14]。DNMT1 是作用于半甲基化DNA 的维持甲基化转移酶,其对新合成的DNA 单链进行甲基化修饰,并将甲基化阴性传递给子代细胞[15]。DNMT1 的主要功能是保证新合成的DNA 具有高度保真性,并且维持甲基化转移酶的功能,DNA 甲基化通过DNMT 催化作用,以S-腺苷甲硫氨酸作为甲基供体,将胞嘧啶核苷酸的嘧啶环第5 位碳原子甲基化,形成CpG 岛,正常细胞DNMT1 过表达可能导致CpG 岛超甲基化,从而促进细胞转化[16]。有研究发现,在胃癌组织中,DNMT1 高表达可能通过调控CDC25B 来发挥致癌作用[17]。DNMT3a 是一种催化DNA 甲基化的关键酶,通过调控多种基因表达参与了肿瘤细胞的凋亡过程,其在原始胚胎形成中具有重要作用,主要功能是催化DNA 甲基化的新生位点[18]。有研究发现,DNMT3a在胃癌、外阴鳞状细胞癌及胰腺癌等多种肿瘤细胞中呈高表达[19]。在卵巢癌中,下调DNMT3a 增强了miR-182 表达诱导细胞凋亡,miR-101 通过靶向调控DNMT3a,抑制人卵巢癌细胞生长与侵袭[20]。罗舒等[21]研究结果显示,DNMT1在宫颈癌组织中高表达,且对不良预后有重要预测作用。Sun等[22]研究中发现,miR-182可通过抑制DNMT3a的表达诱导宫颈癌细胞凋亡。虽已有研究表明DNMT1、DNMT3a 与宫颈癌及其预后有密切联系,但二者与宫颈癌及癌前病变病人HPV 感染的相关性研究较少。本实验结果显示,宫颈癌及癌前病变组病人血清DNMT1、DNMT3a 表达水平显著高于对照组,宫颈癌病人血清DNMT1、DNMT3a 表达水平显著高于癌前病变组,提示血清DNMT1、DNMT3a 参与了宫颈癌的发生发展过程,宫颈癌的的发生与抑癌基因异常的甲基化状态有关。血清DNMT1、DNMT3a 表达水平与宫颈癌病人FIGO 分级、癌前病变病人CIN 分期、HPV 感染危险程度相关,提示高表达的DNMT1、DNMT3a 介导的DNA 甲基化过程能够抑制促凋亡分子的表达,与宫颈癌及癌前病变的严重程度密切相关,高危HPV与DNA整合后使DNA 发生更复杂的基因表达异常,通过基因表达的改变来影响细胞的生物学特征。此外,本研究中血清DNMT1、DNMT3a 对宫颈癌均有一定的诊断价值,特异性分别为92.9%、94.3%,敏感度分别为82.8%、70.7%,且二者联合后诊断敏感度为91.4%,有明显提升。HPV 感染情况结果显示,宫颈癌病人HPV 阳性率为100.00%,宫颈癌前病变组HPV 阳性率为61.43%,对照组HPV 阳性率为6.00%,三组HPV 感染情况比较结果差异有统计学意义。提示HPV 感染与宫颈癌的发生密切相关。不同HPV 感染情况病人血清DNMT1、DNMT3a 表达水平比较显示,HPV 感染组病人及健康女性血清DNMT1、DNMT3a 水平显著高于未感染组,提示DNMT1、DNMT3a 与HPV 感染密切相关,HPV 感染与DNA 异常甲基化存在联系,HPV 病毒有可能通过与DNMT 结合,促使DNMT 与DNA 和腺苷氨酸结合,进而使某些抑癌基因表达沉默,导致宫颈癌的发生。有研究报道,大多数HPV 感染可通过自身免疫清除,仅少数病人感染持续,并最终发展为宫颈癌前病变甚至宫颈癌。
综上所述,宫颈癌及癌前病变病人血清中DNMT1、DNMT3a 表达水平显著升高,CIN 病人HPV 感染率显著低于宫颈癌病人,HPV 感染病人血清中DNMT1、DNMT3a 呈高表达,血清DNMT1、DNMT3a水平与宫颈癌、CIN 病人的严重程度、HPV 感染类型有关,宫颈癌及CIN 病人HPV 感染与甲基转移酶催化的甲基化反应有关。

