新辅助化疗联合D2根治术治疗胃癌预后模型的构建
刘波,张登云,郑自文,刘皓,宋彦呈,张坚
(青岛大学附属医院平度院区胃肠外科,山东 青岛 266700)
如今,辅助化疗联合胃癌D2根治术已广泛应用于治疗进展期胃癌[1-3]。其中新辅助化疗联合手术与单独手术相比,可延长生存期,降低肿瘤分期,提高R0切除率,并可根据新辅助化疗后反应程度选择手术时机和方式,尽可能做到D2根治术[4-5]。然而,由于个体化差异、选用具体治疗方案不同等原因,新辅助化疗联合D2根治术治疗胃癌病人的预后不尽相同,并影响术后治疗决策[6-8]。因此,接受新辅助化疗联合胃癌D2根治术的病人存在更准确、更灵敏预测预后的需求。既往许多研究使用临床、生理或病理学等因素作为预后因子,但大多数预后因子仍存在局限和争议[9-14]。美国癌症联合委员会胃癌新辅助化疗后TNM分期(AJCC ypTNM分期)是接受新辅助化疗胃癌病人的唯一指南性预后预测系统[2,15]。然而,该系统是根据淋巴结清扫范围小于D2的病人建立的,且未纳入病理完全缓解的ypT0N0c病人,因此可能不适用于胃癌D2根治术和新辅助化疗后病理完全缓解的病人;此外,其他临床病理预后因子也未被考虑[16-17]。因此,需要更泛化性的模型来预测这部分病人的预后。现今,列线图可以纳入多种预后相关因素,并根据各因素对预后的影响进行量化、可视化,已被广泛用于胃癌的预后研究[10,18-21]。本研究旨在通过回顾性分析290例接受新辅助化疗联合胃癌D2根治术病人的临床资料,构建一个相对完善的预后预测模型。现将结果报告如下。
1 资料与方法
1.1 病例选取
2010年1月—2020年2月,选取在青岛大学附属医院胃肠外科接受新辅助化疗和D2根治术的胃癌病人290例。纳入标准:①术前病理确诊为胃或者胃食管腺癌(胃食管肿瘤定义为发生在贲门或胃食管结合部的肿瘤,不涉及食管下段2 cm以上,即SiewertⅡ型和Ⅲ型);②术前CT、胃镜和B超均证实为进展期胃癌,无肝、肺、脑和骨等器官的远处转移;③病人经多学科讨论后评估为可接受新辅助化疗,采用三药联合(EOX/EOS/DOS/DOX方案)或两药联合(SOX/XELOX方案)化疗,且病例资料完整;④根据病人要求及术前情况进行评估,以D2根治术作为标准治疗模式,且做到R0切除。排除标准:①有其他恶性肿瘤病史者,存在严重并发症以致无法耐受新辅助化疗及手术者;②在进行新辅助化疗前接受过化疗、放疗或免疫治疗的病人。纳入的290例病人行2~3周期新辅助化疗后,通过多学科会诊进行术前影像学和病理学评估判断疗效,确定手术方案。该研究获青岛大学附属医院伦理审查委员会批准(编号QYFYWZLL25828)。
1.2 数据收集
由两名独立的研究人员完成病人资料的收集、甄别、录入。收集的资料包括新辅助化疗前的临床病理信息和根治术后的临床病理信息。其中前者包括性别、年龄、年龄校正CHARLSON并发症指数(aCCI)、体质量指数(BMI)、Borrmann分型、肿瘤标志物(癌胚抗原(CEA)、糖类抗原199(CA199))、炎性指标(中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR))等;而后者包括病理类型、淋巴结阳性率、神经脉管侵犯、AJCC ypTNM分期、美国国家综合癌症网(NCCN)2012版病理学肿瘤退缩分级(TRG)。本研究所有病人随访时间截至2020年2月或者死亡,术后2年每3个月随访1次,术后3~5年每6个月随访1次。计算病人的总生存期(OS),OS定义为疾病确诊至病人死亡或最后一次随访的时间间隔。
1.3 列线图的构建和性能评价
使用SPSS 24.0软件(Chicago,IL,USA)和R软件(www.r-project.org,版本3.63)进行统计分析。①病人分组:使用R软件包“rms”“foreign”“caret”按照7∶3将全部病人随机分为训练组和验证组。②基线数据处理:使用公认临床意义界限对连续变量进行分组,对于无明显分组标准的连续变量,则先使用SPSS软件以OS作为总体终点绘制受试者工作特征(ROC)曲线,再以该ROC曲线的截断值作为临界值将其转化为分类变量。使用SPSS软件计算每个分类变量的频数和百分比,并应用卡方检验比较训练组和验证组之间的差异。③列线图的构建:基于训练组数据,使用SPSS软件和R软件包“rms”“foreign”“survival”进行单因素和多因素Cox回归分析,计算相应预后因素的危险比(HR)和95%置信区间(CI),筛选独立的预后因素,构建列线图。基于训练组数据,绘制各预后因素的Kaplan-Meier生存曲线并行变量间差异性检验。④列线图性能的评价:基于训练组和验证组数据,使用R软件包“rms”“foreign”“survival”“survivalROC”“stdca”,绘制ROC曲线、决策曲线分析法(DCA)曲线和校准曲线,计算ROC曲线下面积(AUC)和一致性指数(C-index)。C-index和AUC用于评价模型性能,DCA曲线用于评估模型的临床效用和净收益,校准曲线用于评价实际与预测结果之间的一致性。P<0.05认为差异有统计学意义。
2 结 果
2.1 病人基线资料
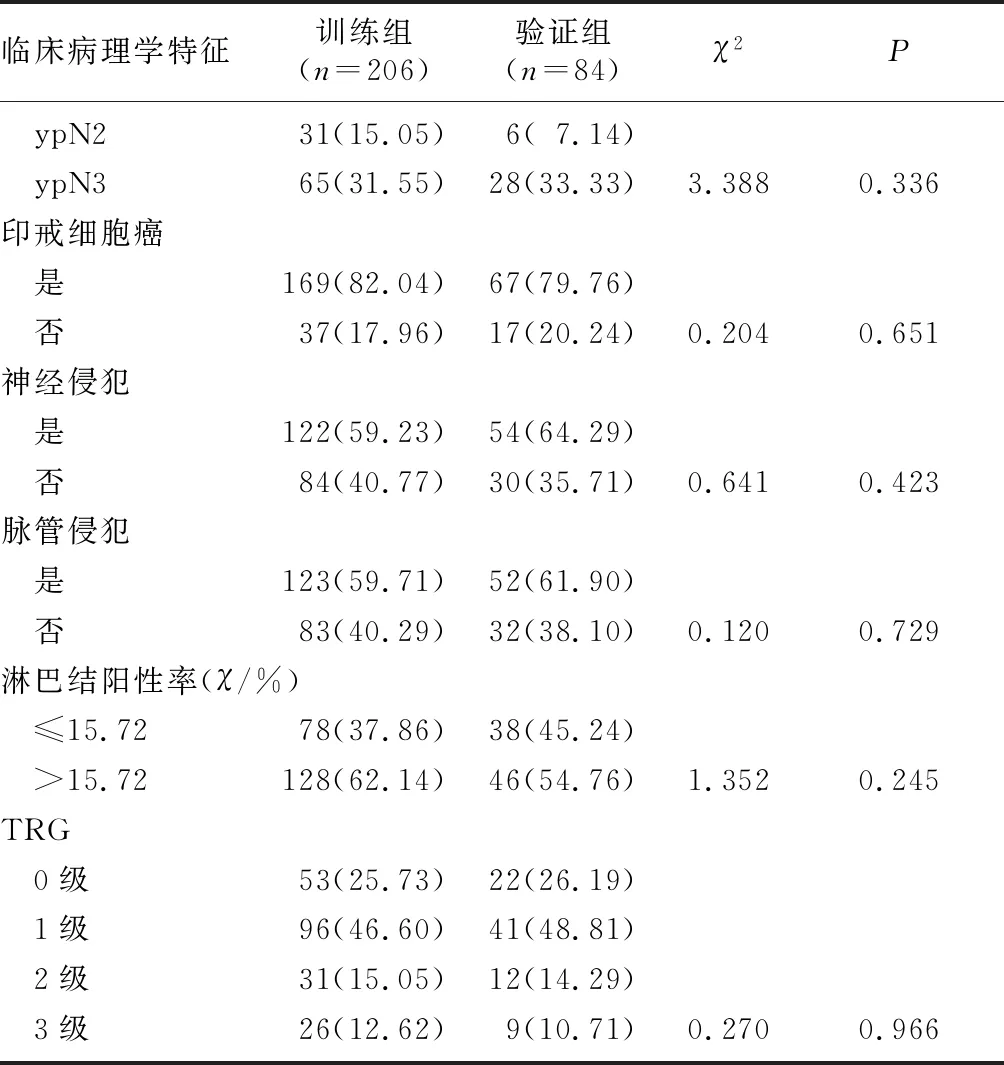
本研究病人的随访时间为0~81个月,中位随访时间为31个月。训练组和验证组病人的临床病理学特征见表1。由表1可知,除Borrmann分型外两组其他临床病理学特征比较,差异均无统计学意义(P>0.05)。

表1 两组病人临床病理学特征比较(例(χ/%))
续表1
2.2 单因素与多因素Cox回归分析
对训练组206例病人进行单因素Cox回归分析,结果显示,aCCI、Borrmann分型、CEA、CA199、NLR、PLR、ypT分期、ypN分期、神经侵犯、脉管侵犯、淋巴结阳性率、TRG等均与病人的生存预后有关。见表2。在SPSS中采用输入法进行多因素Cox回归分析,结果显示,NLR、PLR、ypT和ypN分期、神经侵犯、TRG等为与预后密切相关的影响因素。病人NLR、PLR值越高,预后越差;ypT和ypN分期早、神经侵犯阴性和TRG低,则提示预后好。见表3。Kaplan-Meier法绘制预后相关因素生存曲线,结果显示,NLR和PLR值较高、ypT和ypN分期较晚、神经侵犯阳性及TRG较高病人的总体生存率明显低于NLR和PLR值较低、ypT和ypN分期较早、神经侵犯阴性及TRG较低病人,差异均有统计学意义(P<0.05)。见图1。

表2 新辅助化疗联合D2根治术治疗胃癌预后影响因素的单因素Cox回归分析

续表2

表3 新辅助化疗联合D2根治术治疗胃癌预后影响因素的多因素Cox回归分析
2.3 预测预后列线图的构建
根据多因素Cox回归分析筛选出的独立预后因素构建列线图,利用该列线图可计算每例病人每个预测因素单项评分,相加得到总分,总分所对应的概率即为接受新辅助化疗联合D2根治术治疗胃癌病人3、5年总生存率。见图2。
2.4 列线图的评价与验证
基于训练组和验证组数据对列线图的区分度和校准度进行验证,结果显示,训练组和验证组中列线图的C-index分别为0.811(95%CI=0.731~0.891)和0.740(95%CI=0.577~0.903);训练组中列线图预测病人3、5年总生存率的AUC分别为0.824(95%CI=0.695~0.953)和0.811(95%CI=0.703~0.919);验证组中列线图预测病人3、5年总生存率的AUC分别为0.794(95%CI=0.708~0.880)和0.723(95%CI=0.658~0.788),表明该模型具有良好的预测价值。见图3。训练组和验证组中列线图预测病人3、5年总生存率的校正曲线见图4。由图4可知,校准曲线与45°理想斜线吻合较好,表明预测结果与实际结果一致性较高。本研究还应用DCA曲线来评价列线图的临床应用价值,结果显示,列线图在两组病人的广泛死亡风险范围内均显示了很大的正向净收益,表明该模型具有良好的临床实用性。见图5。
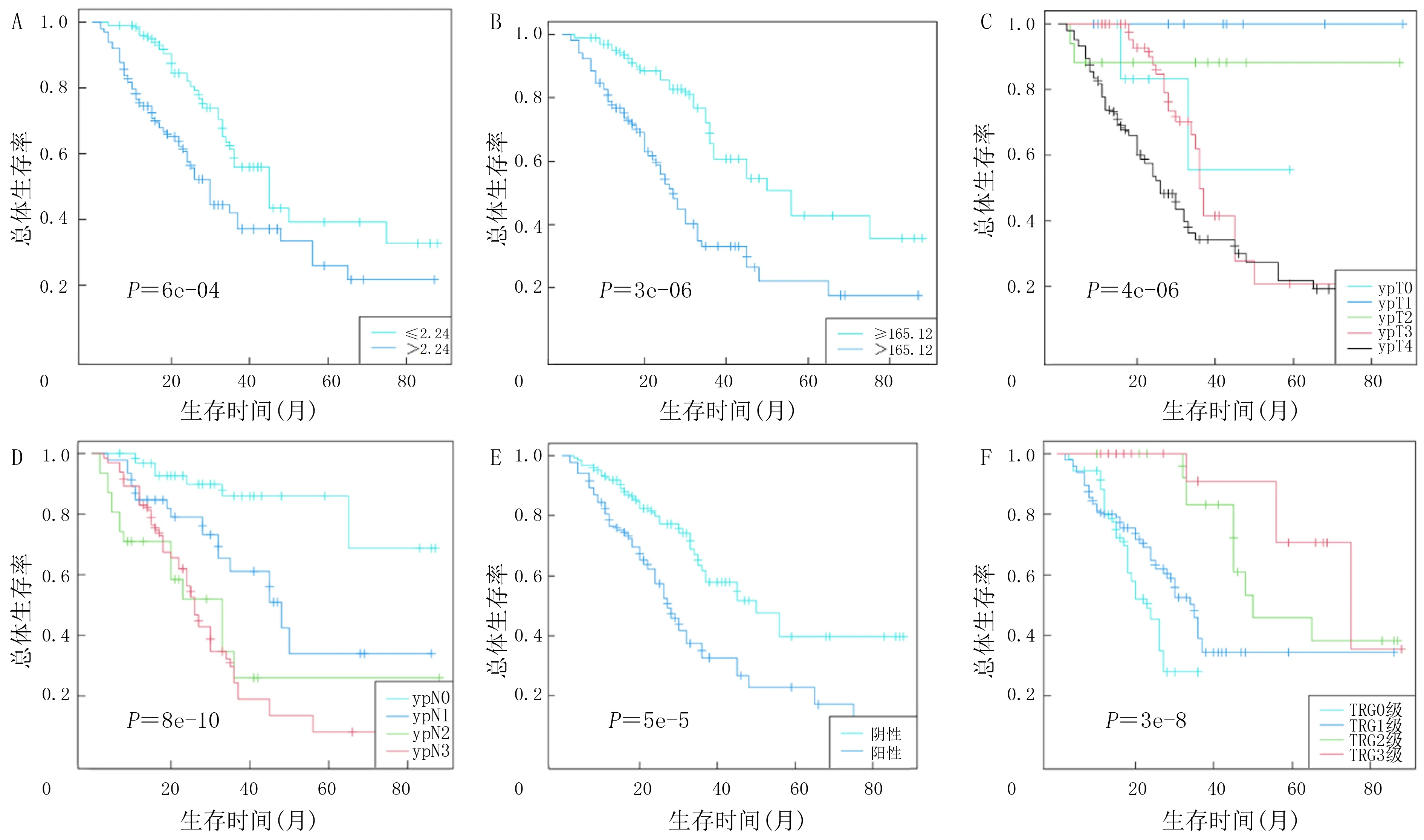
A:NLR;B:PLR;C:ypT分期;D:ypN分期;E:神经侵犯;F:TRG。
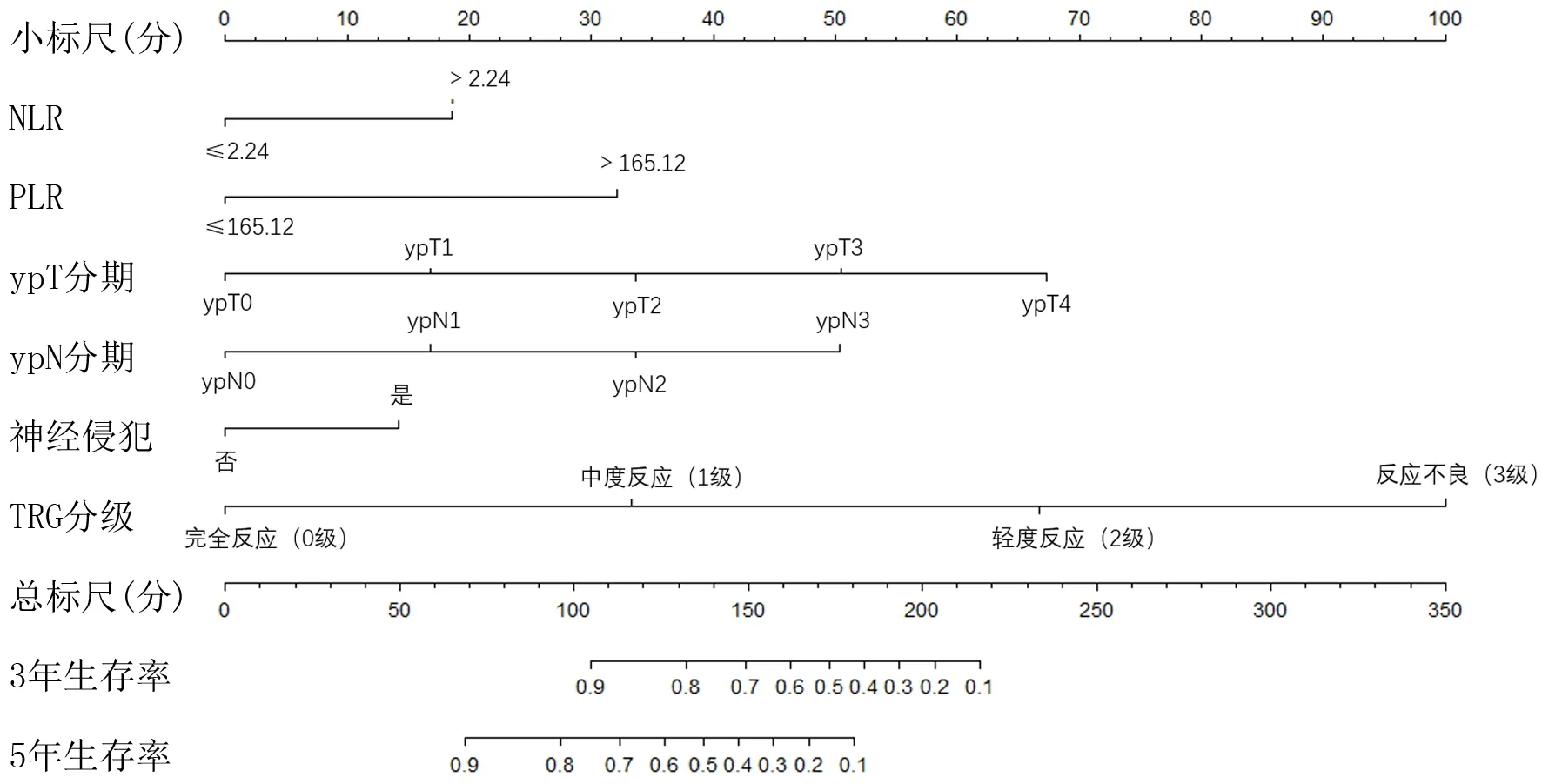
图2 病人3、5年总生存率的列线图预测模型
3 讨 论
当前,进展期胃癌的治疗手段以D2根治术及围手术期综合治疗为主。大量循证医学研究证据证实,新辅助化疗能够显著改善进展期胃癌病人的预后,然而,新辅助化疗对病人预后的影响存在个体差异[6-7,22-23]。因此,有必要寻找相关预后因素,以辅助选择治疗方案。列线图具有个体化、精准化预测的特点,既往研究已经证明它对临床决策具有重要意义[10,18-21,24]。本研究构建的列线图模型纳入的预后因素包括NLR、PLR、ypT分期、ypN分期、神经侵犯和TRG,经验证该模型具有良好的预测能力。
从1863年VICHOW[25]提出“肿瘤-炎症”学说以来,越来越多的研究结果证实,NLR、PLR等炎性指标与肿瘤发生、发展以及预后相关。机体的中性粒细胞增多是一种炎症反应,它通过抑制免疫细胞的细胞溶解活动来抑制免疫系统,既往多项研究结果已经表明,NLR是胃癌病人预后的独立预测因素[21,26-27]。对于PLR而言,不管是机体淋巴细胞减少还是血小板增多均与肿瘤不良预后相关[28]。有研究表明,胃癌病人治疗前PLR的升高与病理类型存在显著相关性,并影响胃癌的预后[9-10]。有文献报道,胃癌病人血清中各种肿瘤标志物(例如CEA、CA199等)水平可能会升高,并可用于反映肿瘤负荷。然而,这些肿瘤标志物的预后价值仍然存在争议[13,29]。本文研究结果显示,新辅助化疗前高水平的NLR、PLR是独立不良预后因素,而且通过分析数据显示,ypT3、4分期或病理缓解程度低的病人多伴有高NLR和PLR。查阅相关文献显示,高水平的NLR和PLR同样为影响肿瘤新辅助化疗缓解率的独立危险因素,并且NLR和PLR的升高与肿瘤负荷、生长速度有关[9-10,13,21]。由于NLR和PLR仍未出现标准分界,故本研究选取相应变量ROC曲线的截断值作为分组标准,该截断值与既往研究结果相近[9-10,13,21]。因此,未来需要大样本研究深挖NLR和PLR等炎性指标的临床应用价值。
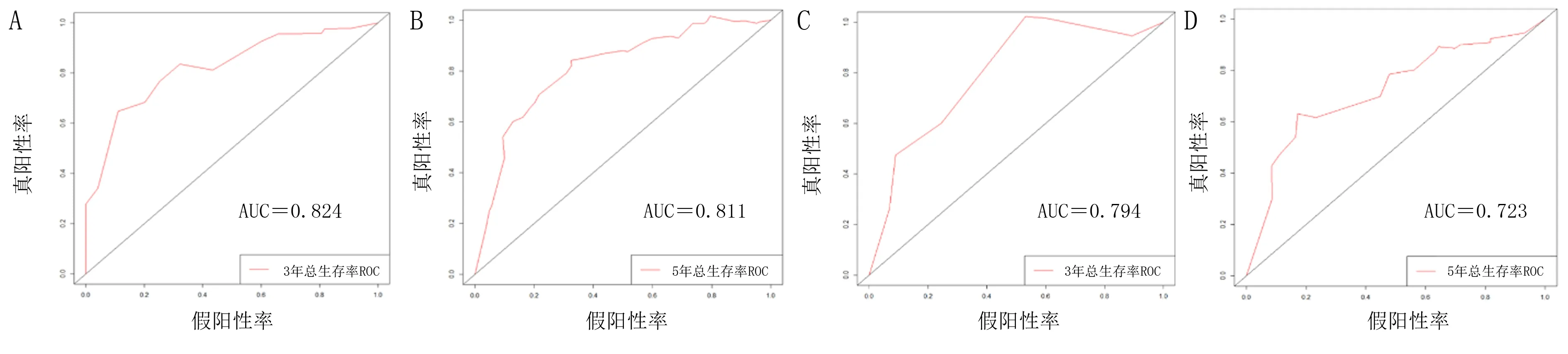
A、B:列线图预测训练组病人3、5年总生存率的ROC曲线;C、D:列线图预测验证组病人3、5年总生存率的ROC曲线。

A、B:列线图预测训练组病人3、5年总生存率的校正曲线;C、D:列线图预测验证组病人3、5年总生存率的校正曲线。
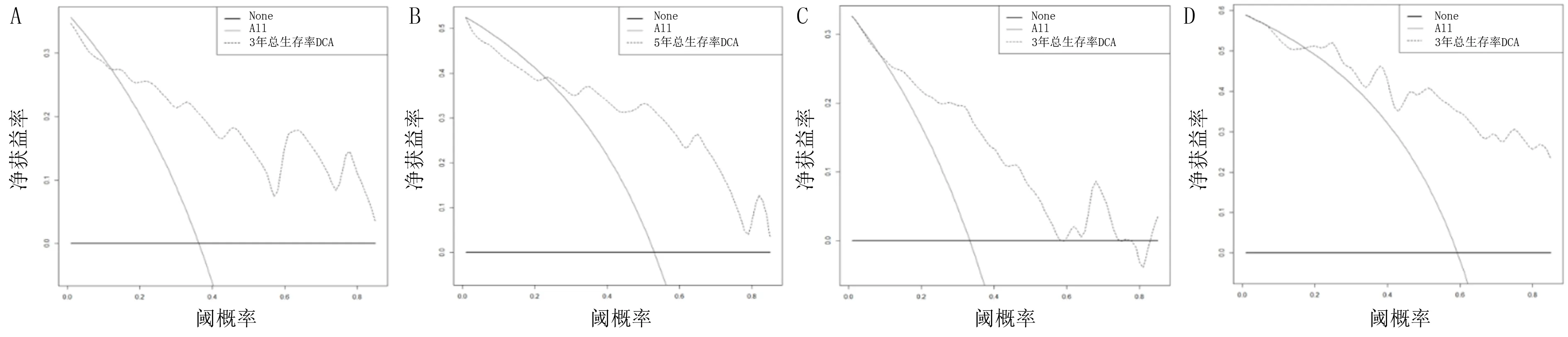
A、B:列线图预测训练组病人3、5年总生存率的DCA曲线;C、D:列线图预测验证组病人3、5年总生存率的DCA曲线。
近年来,由于人类预期寿命的延长,胃癌病人的老龄化逐渐严重,老年胃癌病人合并疾病较多,患病后病死率高且生活质量下降严重。CHARLSON并发症指数(CCI)在1987年由CHARLSON等[30]提出,已被广泛用于评估并发症对癌症和非癌症疾病的影响。既往多项研究表明,aCCI校正了病人年龄,较CCI更为准确,被筛选为相关疾病的预后影响因素[12,14,31]。近年来,aCCI也逐渐被应用于胃癌研究[14]。本研究单因素Cox分析显示,高aCCI为预后危险因素,但多因素Cox分析显示它并非独立预后因素。因aCCI在胃癌新辅助化疗领域中的研究相对较少,所以本研究结果仍提醒医务人员要关注病人基本情况,重视利用临床相关指数辅助选择治疗方案并开展相关研究。
尽管既往新辅助化疗治疗胃癌的预后研究较多[9-10,13,18],但AJCC ypTNM分期系统依然是现今唯一的指南性预测系统。该系统的建立是基于淋巴结清扫术(小于D2)的病人,且未纳入病理完全缓解的病人,故其预测能力并不能满足临床需求[16]。本研究结果显示,ypT和ypN分期是新辅助化疗联合D2根治术治疗胃癌独立预后因素。ypT和ypN分期对预后影响已被广泛讨论,并达成较晚分期与较差预后相关的共识[16,20]。故本研究弥补了ypTNM分期系统的部分缺陷。近年来研究发现,淋巴结阳性率也可作为胃癌预后的独立风险因素[11,32]。但在本研究多因素Cox分析中,淋巴结阳性率未被纳入最终模型。分析原因可能为:淋巴结清扫、取样的彻底性决定病理淋巴结阳性数的精确性[33],并且获得的淋巴结阳性数目可能受淋巴结碎裂或汇合的影响[34]。对于进展期胃癌,既往多个研究已证实新辅助化疗后的TRG与生存预后显著相关[35-36]。在本研究中,TRG也被纳入到列线图中,多因素Cox分析可见,TRG组间HR变化明显高于其他预后因素,提示新辅助化疗后病理反应较差病人的预后更差,从侧面反映出TRG对生存率的影响大于其他预后因素。
基于上述预后因素,本研究构建了预测新辅助化疗联合D2根治术治疗胃癌病人总生存率的列线图。在验证组中列线图预测病人3、5年生存率的AUC分别为0.794和0.723,并取得了良好的校正曲线,表明该列线图具有良好的预测价值,满意的DCA曲线则表明该列线图具有较高的临床价值。此外,该列线图的预测能力优于第8版AJCC TNM分期系统(C-index=0.681)。在不增加经济负担的情况下,本研究构建的列线图提供了更精准的个体化可视工具,可灵活结合临床病理因素使用,符合现今精准医学理念,可为评估胃癌病人预后和选择决策提供参考。
本研究也存在一定的局限性。作为回顾性的单中心研究,由于总样本量有限,本研究可能存在偏倚,并且没有行外部验证,无法保证模型的泛化性。此外,近年来关于胃癌标志基因(例如人表皮生长因子受体2(HER-2))的研究快速发展[37-38],使胃癌预后研究多样化,本研究虽然纳入了部分新颖因素,但研究变量仍多为临床常规因素。因此,本研究构建的模型的预测价值仍有待观察,需要进一步开展多中心研究进行验证。胃癌相关标志基因是本团队下一步研究的重点。
总之,本研究创新性地构建了预测新辅助化疗联合胃癌D2根治术治疗进展期胃癌病人总生存率的列线图模型,经内部验证表明该模型具有良好的预测性能和临床应用价值。

