基于网络药理学探讨黄芪治疗子宫内膜癌的机制
姜丕雨,李康康,周静祎,王雪莲,程明阳,陈雪红
(青岛大学基础医学院特种医学系,山东 青岛 266071)
子宫内膜癌(EN)是发生在子宫内膜的一组上皮性恶性肿瘤,是女性生殖系统常见恶性肿瘤之一,且近几年EN的发病率逐渐上升[1]。EN发病与多种因素有关,目前针对EN治疗以手术为主,辅以放疗和化疗[2]。但化疗药物具有较强的毒副作用,而中药抗肿瘤具有多靶点、多方位以及不易产生耐药性等优点,在临床上已成为肿瘤治疗的重要研究方向[3]。近年来临床上将黄芪应用于多种肿瘤的治疗,效果显著,且有体外细胞实验证明黄芪对EN细胞有较强的抑制作用[4]。本研究应用网络药理学的方法,系统地探究黄芪的有效活性成分、潜在作用靶点以及调控的通路信息,为黄芪治疗EN提供理论依据。现将结果报告如下。
1 材料和方法
1.1 黄芪成分筛选
以“黄芪”为关键词,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为活性成分筛选条件,检索中药系统药理学数据库和分析平台(TCMSP)[5]数据,获得黄芪的有效活性成分。
1.2 活性成分-靶点网络构建
使用Uniprot数据库校正与转化功能,将查询到的黄芪活性成分转换成靶蛋白的规范名称。将活性成分-靶点关联信息导入到Cytoscape 3.7.0软件,处理黄芪的活性成分和靶点的相关信息,从而构建出黄芪活性成分-靶点网络图。
1.3 EN相关靶点检索
以“endometrial carcinoma”为关键词,检索Genecards数据库[6]、在线人类孟德尔遗传数据库(OMIM数据库)[7]等疾病基因数据库,汇总疾病靶点并去除重复值,得到EN相关作用靶点。
1.4 蛋白质互作(PPI)网络的构建及关键靶点筛选
选用Cytoscape 3.7.0软件中的Biogenet插件构建PPI网络。分别将黄芪有效活性成分的靶点与EN的相关靶点导入Biogenet中,生成两个独立的PPI网络,使用Cytoscape软件中Merge功能对这两个PPI网络取交集,使用CytoNCA插件分析PPI交集网络中各个节点的属性值。
1.5 生物通路富集分析
应用Metascape在线分析平台[8]对靶点进行通路富集分析,解析黄芪中抗EN活性成分显著影响的生物通路,并探讨其发挥抗EN作用的可能机制。
2 结 果
2.1 黄芪活性成分及靶点获取
从TCMSP数据库获取到87个黄芪成分,根据OB≥30%和DL≥0.18筛选得到17个成分。其具体信息见表1。

表1 黄芪候选活性成分
2.2 黄芪活性成分-靶点网络构建与分析
将TCMSP查询到的黄芪活性成分与相关靶点的关联数据导入Cytoscape 3.7.0软件,得到黄芪活性成分-靶点网络图(图1)。共获得216个节点(包含198个靶点、17个活性成分和1个代表黄芪的节点)与427条关系,图中节点面积大小代表相应的Degree值,面积越大代表Degree值越大,表示与此点连接的边越多,其重要性越高。
2.3 EN疾病靶点
检索Genecards和OMIM数据库分别得到靶点个数为1 651个和196个。汇总靶点并去除重复靶点,最终收集到1 845个疾病靶点。
2.4 黄芪治疗EN的PPI网络与关键靶点
2.4.1黄芪治疗EN的PPI网络 运用Cytoscape 3.7.0构建黄芪PPI网络,结果显示,可以与黄芪产生直接或间接作用的靶点为6 304个,6 304个靶点之间可产生的相互关系多达153 949种。同样对EN的相关靶点绘制PPI网络,结果显示有13 172个靶点与EN可产生直接或者间接的关系,其间的相互关系高达243 806种。用Cytoscape 3.7.0中的Merge功能对二者取交集,交集网络见图2。
2.4.2黄芪治疗EN的关键靶点 对黄芪治疗EN的PPI交集网络进行拓扑属性分析,筛选出在网络中发挥重要作用的靶点。黄芪治疗EN关键靶点见图3。经过2次筛选后,共获得关键靶点238个,关键靶点的筛选策略见图4。在得到核心PPI网络后,应用 MCODE插件对PPI模块进行分析,得到了MCODE1~7共7个模块,见图5。根据P值,分别保留每个模块中2个评分最佳的生物学进程以及描述功能,见表2。
2.5 黄芪治疗EN的通路富集分析
应用Metascape平台对上述238个关键靶点进行了基因富集分析, 包括GO的Biological Process(BP)、Cellular Component (CC)、Molecular Function(MF)以及KEGG通路。分析结果显示,黄芪治疗EN主要涉及的生物学过程包括端粒结构(Telomere organization)、DNA修复(DNA repair)、DNA复制依赖性核小体装配(DNA replication-dependent nucleosome assembly)、DNA复制依赖性核小体结构(DNA replication-dependent nucleosome organization)、蛋白质-DNA复合物组装(Protein-DNA complex assembly)、rDNA染色质沉默(chro-matin silencing at rDNA)和基因沉默调控(regula-tion of gene silencing)等。这些过程直接作用于细胞损伤的修复和凋亡环节,表明黄芪对于EN细胞的修复和凋亡具有直接的调控作用。KEGG通路富集结果涉及病毒性癌症(Viral carcinogenesis)、EB病毒感染(Epstein-Barr virus infection)、细胞周期(Cell cycle)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、癌症转录失调(Transcriptional misregulation in cancer)、信号通路(Pathways in cancer)、MicroRNA(MicroRNAs in cancer)、HIF-1通路(HIF-1 signaling pathway)、Jak-STAT信号通路(Jak-STAT signaling pathway)、ErbB信号通路(ErbB signaling pathway)和蛋白聚糖(Proteoglycans in cancer)等。见图6。
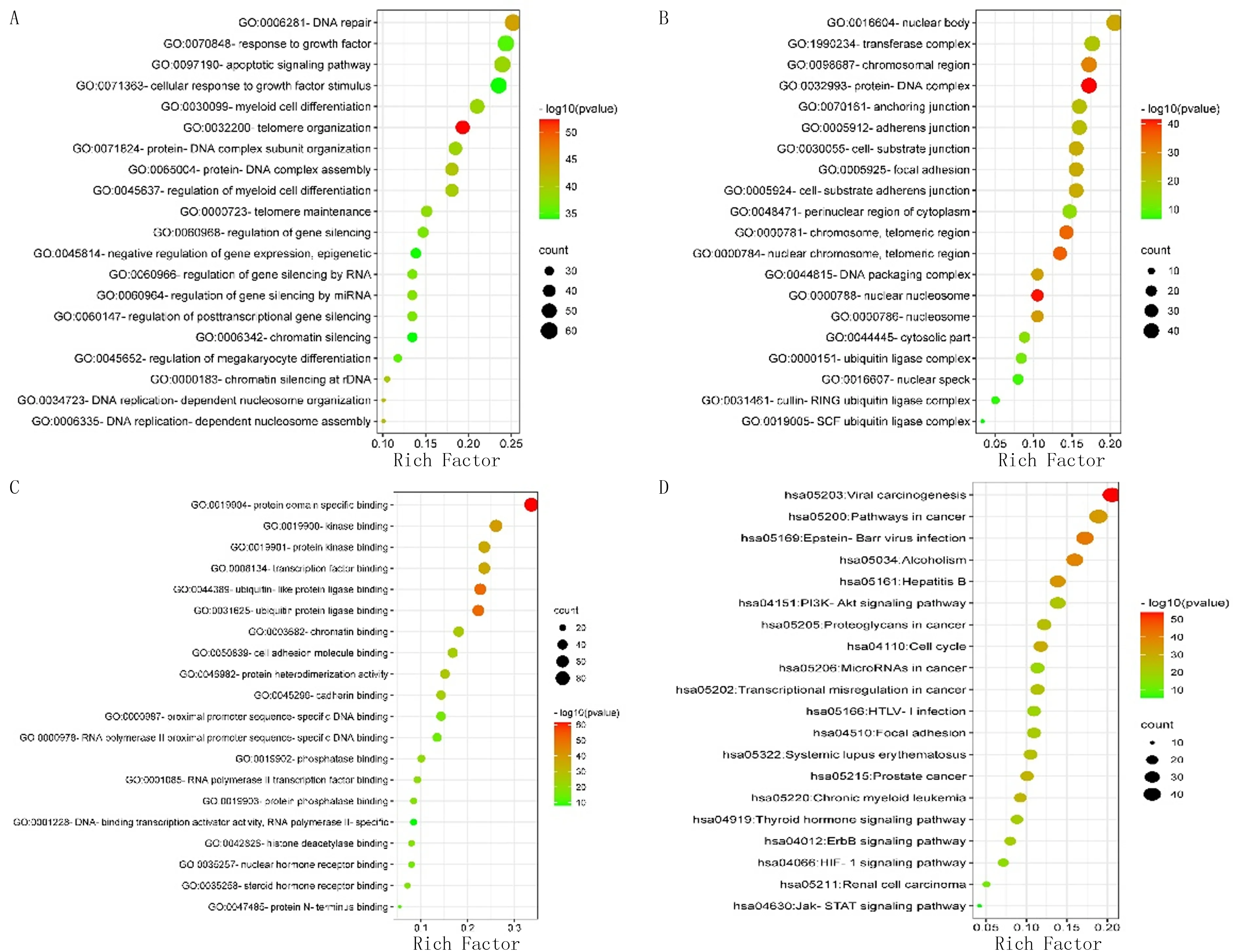
A:GO-BP分析;B:GO-CC分析;C:GO-MF分析;D:KEGG分析。气泡颜色由红色到绿色代表P值由大到小,越大代表显著性越强;气泡大小代表富集到该通路的基因数目,越大代表该通路的基因计数(Count值)越大;横轴代表该通路基因所占总体基因的比值(Rich Factor)。
3 讨 论
本研究应用网络药理学方法,初步探究了黄芪治疗EN的活性成分、作用靶点及相关联的生物学通路。根据OB≥30%和DL≥0.18,共筛选出黄芪活性成分17个,绘制上述活性成分-靶点网络关系图共获得198个靶点和427条相互关系。由此可知,黄芪的有效成分之间存在协同作用,而协同调控的靶点也在EN发生发展中发挥重要作用,具有用于治疗EN的潜力。
本文结果显示,黄芪治疗EN的主要成分可能为槲皮素、山奈酚、黄芪异黄烷苷等。其中,槲皮素可诱导肿瘤细胞过表达胱硫氨酸γ-裂解酶(CTH)从而诱导细胞凋亡[9];山奈酚可激活Caspase 9和诱导细胞凋亡[10],同时也可以上调p38、p53、p21、p-BRCA1和p-ATM等抑癌基因的表达,抑制肿瘤细胞增殖[11]。
3.1 关键靶点结果分析
本文研究按照筛选策略共得到238个潜在关键靶点。根据Degree值排序,其中较为重要的靶点有NTRK1、TP53和CUL3等。有研究表明,NTRK1基因可编码原肌球蛋白受体激酶(TRK)家族中的TRKA蛋白,TRKA蛋白与神经营养素结合后,通过PI3K、Ras/MAPK/ERK和PLC-γ诱导受体二聚化、磷酸化和下游信号级联激活。由于基因融合或核苷酸突变所导致的TRK通路异常,是许多癌症发生发展的重要原因[12]。抑癌基因TP53可以转录诱导编码FAS基因以及其他可能编码相关死亡受体的基因,还可通过PUMA和NOXA介导细胞凋亡从而发挥显著的肿瘤抑制功能[13]。CUL3属于Cullin蛋白家族,可参与多种细胞过程,包括细胞分裂、分化、细胞骨架重塑、应激反应和神经细胞功能等,也与肿瘤的发生发展密切相关[14]。提示黄芪可通过多靶点来影响EN发生和发展过程。

表2 黄芪治疗EN关键靶点潜在module功能描述(前2位)
3.2 通路与生物进程分析
本文生物进程富集分析结果显示,黄芪治疗EN涉及的生物学进程包括端粒结构、DNA修复、DNA复制依赖性核小体装配、DNA复制依赖性核小体组织、蛋白质-DNA复合物组装、rDNA染色质沉默、细胞凋亡信号通路、基因沉默调控等。这些进程与细胞修复和凋亡直接相关。这表明黄芪可能通过干扰EN细胞的修复和促进其凋亡来发挥作用。
本文通路富集分析结果显示,黄芪可干预病毒致癌、细胞周期、PI3K-Akt通路、MicroRNA、HIF-1通路、Jak-STAT信号通路、蛋白聚糖、ErbB通路等,调控EN病理过程中的不同环节。
综上所述,黄芪治疗EN的主要成分可能是槲皮素、山奈酚和黄芪异黄烷苷等,关键作用靶点有NTRK1、TP53、CUL3等和涉及细胞周期、DNA修复、细胞凋亡、癌症通路等多个生物学过程和信号通路。黄芪通过多成分-多靶点-多通路的方式来干预EN的发生和发展,体现了中药治疗疾病的整体性与系统性。

