基于HAH强化Fenton体系降解苯胺的研究
马巧璐,董海山,王 婷,王 栋
(西南交通大学 地球科学与环境工程学院,成都 610000)
前 言
苯胺作为一种重要的有机中间体,被广泛应用于染料、医药、农药、军工等行业,尤其是农药、染料及其中间体的合成过程[1]。同时,它是一种有机污染物,物质结构复杂,分子结构非常稳定,一般难以生物降解,且生物毒性较大,容易导致持久的环境污染。近年来,随着我国工业化进程加快,苯胺类废水污染物不断增加,对人体和环境存在着巨大的危害,因此研究其处理技术具有重要的工业应用价值和长远的环保意义。目前,苯胺类废水的处理有物理法、生物化学法、膜萃取、Fenton氧化法及其组合技术等,其中Fenton氧化法已广泛应用于废水预处理中[2]。Fenton氧化法是由Fe2+和H2O2组成的[3],即Fe2+/H2O2法,是利用H2O2和Fe2+之间的链反应催化生成氧化性极强的羟基自由基(·OH),相对于其他一些氧化剂,如O2,Cl2和O3等,·OH具有更高的氧化还原电位,氧化能力强,难生物降解[4],因此去除有机物污染物效果更好。
HAH作为还原剂能还原高价态过渡金属离子[5],且自身与氧化性自由基的反应速率较低,反应后生成的最终产物为无机物质,常用于强化铁活化高级氧化体系[6]。顾小钢[7]采用HAH强化Fe(Ⅲ)-乙二胺二琥珀酸活化过硫酸盐来去除水溶液中的三氯乙烯,结果证明引入HAH后,能够实现强化性能,提高对三氯乙烯的去除率。作者前期研究也发现用HAH强化Fenton体系处理AN比单独的Fenton体系处理效率能提高约40%。
虽然采用Fe2+/H2O2法氧化降解苯胺的研究较多,但有关HAH/Fe2+/H2O2体系降解AN的研究报道较少。因此,本文拟在前期关于HAH/Fe2+/H2O2体系降解AN的基础上,探究了在该体系下水中常见离子对AN的降解影响,旨在为苯胺类废水的处理提供新的思路与方法。
1 材料与方法
1.1 试验试剂
苯胺、硫酸亚铁、双氧水(30%)、盐酸羟胺、氯化钠、氯化镁、氯化钾、硝酸钠、硫酸钠、磷酸二氢钠、叔丁醇、硫代硫酸钠、氢氧化钠、浓盐酸、富里酸:均为分析纯,购自成都市科隆化学品有限公司;甲醇:为色谱纯,购自成都金山化学试剂有限公司。
1.2 试验仪器及设备
HPLC Ultimate 3000高效液相色谱仪、FA2004电子天平、SHJ-A4磁力搅拌水浴锅、KQ-100DB数控超声波清洗器、78HW-1恒温磁力搅拌器等。
1.3 分析检测方法
AN模拟废水处理前后的苯胺浓度采用高效液相色谱法测定;pH值采用PHS-25型pH计检测,且在试验操作过程中,为确保pH测定值的准确性,每次试验前先使用离子水冲洗,然后用pH校准液对pH计校准;H2O2溶液采用高锰酸钾标定法标定。
1.4 试验操作方法
2 结果与讨论
2.1 水中常见离子的影响
2.1.1 氯离子的影响
在HAH/ Fe2+/H2O2体系的基础上,考察了不同浓度Cl-对该体系去除AN的影响。影响分析见图1。
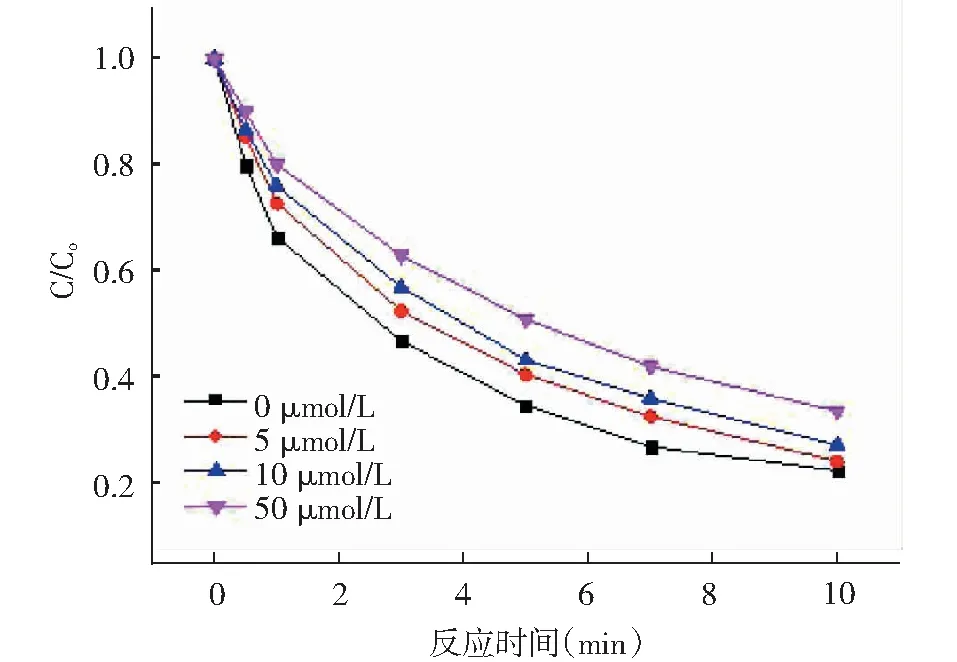
[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃
由图1可知,从整体看,随着时间的变化HAH/Fe2+/H2O2体系内AN的去除率逐渐增加。但随着Cl-浓度的增加AN的去除率呈逐渐降低趋势,在10min时,当其浓度为0μmol/L、5μmol/L、10μmol/L、50μmol/L, AN的去除效率分别为 77.6%、76.0%、72.9%、66.5%,说明Cl-对HAH/Fe2+/H2O2体系去除AN有抑制作用,且抑制效果随着Cl-浓度增大而提高。分析其原因可能是:Cl-会捕获体系内的·OH自由基,与·OH发生反应生成HOCl·-[8](如下式所示),使得体系内·OH自由基减少,进而对AN的去除产生抑制效果。
Cl-+HO·→ HOCl·-
2.1.2 硫酸根离子的影响
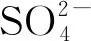

[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃

2.1.3 硝酸根离子的影响

[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃
2.1.4 磷酸二氢根离子的影响
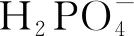

[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃

2.1.5 氯离子和磷酸二氢根离子抑制能力大小对比


[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃
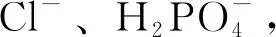
2.1.6 常见阳离子浓度的影响
在HAH/ Fe2+/H2O2体系的基础上,考察了不同浓度的 K+、Na+、Mg2+对该体系去除AN的影响。影响分析见图6~图8。

[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃

[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃

[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃
由图6~图8可知,从整体看,随着时间的变化HAH/Fe2+/H2O2体系内AN的去除率逐渐增加。比较在该体系内外加不同浓度的Na+、K+、Mg2+时,随着离子浓度的增加AN的去除率基本无变化,即这些离子对AN的去除效率产生的影响甚微。分析原因可能是:这些阳离子与体系产生的·OH自由基不会发生反应,因此不会影响AN的去除。
有学者[11]在考察无机阳离子浓度对羟胺强化Fe2+/PDS体系去除BA效能的影响时,发现K+、Mg2+、Na+在15min反应时间内基本不会影响对污染物的去除效果,因为这些离子既不会影响Fe2+的活化能力,也不会与污染物竞争体系产生的自由基,因此与本实验结论具有一致性。
2.1.7 NOM浓度的影响
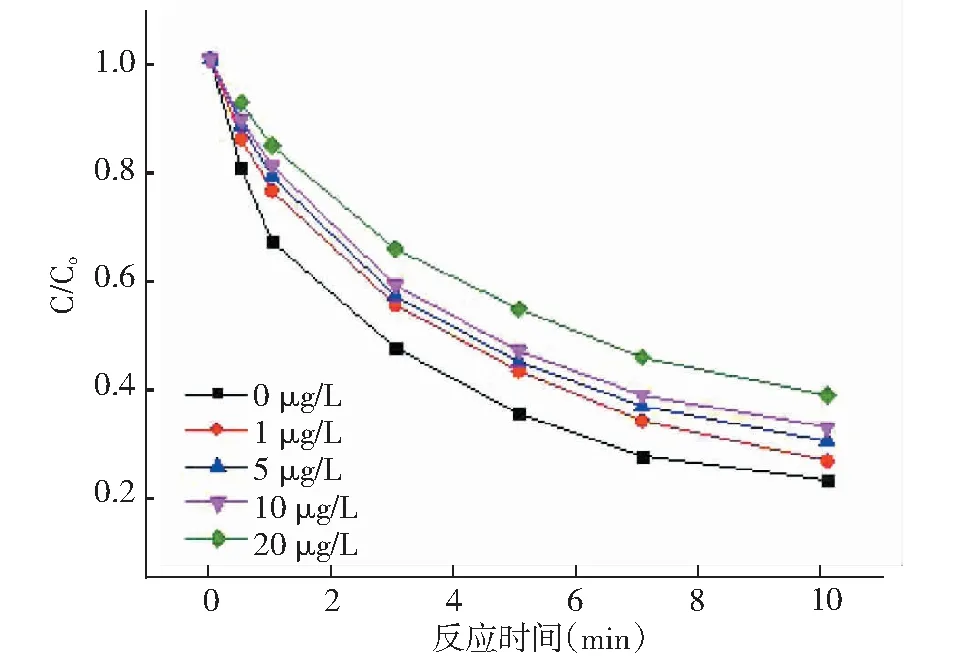
在HAH/ Fe2+/H2O2体系的基础上,考察了天然有机物(NOM)中不同浓度的FA对该体系去除AN的影响。影响分析见图9。
由图9可知,从整体看,随着时间的变化HAH/Fe2+/H2O2体系内AN的去除率逐渐增加。但随着FA浓度的增加AN的去除率下降的幅度越大,在10min时,当 FA浓度为 0μg/L、1μg/L、5μg/L、10μg/L、20μg/L, AN的去除率分别为 76.7%、74.1%、70.5%、67.9%、62.0%,说明FA对HAH/Fe2+/H2O2体系去除AN有抑制作用,且抑制效果随着FA浓度增大而提高。分析原因可能是:FA与·OH自由基发生反应,与AN竞争·OH自由基[12],导致了反应体系AN的去除效果降低。
[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃
2.2 自由基猝灭实验
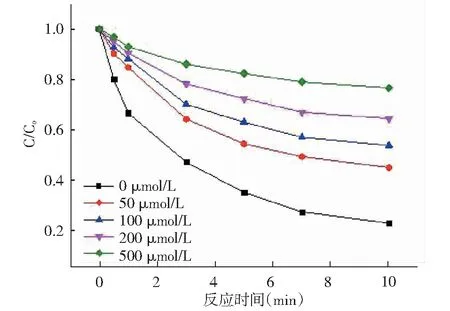
为验证·OH为该体系的主要活性自由基,本文选取了·OH自由基的淬灭剂叔丁醇进行试验。在HAH/ Fe2+/H2O2体系的基础上,考察了不同浓度的TBA对该体系去除AN的影响。影响分析见图10。
[AN]0=10μM,[H2O2]0=100μM,[Fe2+]0=10μM,[HAH]0=50μM,pH=3.0,25±0.5℃
由图10可知,从整体看,随着时间的变化HAH/Fe2+/H2O2体系内AN的去除率逐渐增加。但引入的TBA随着其浓度的增加,AN的去除率降低的幅度越大,在10min 时,当外加的 TBA浓度为 50μmol/L、100μmol/L、200μmol/L、500μmol/L, AN的去除率分别为 55.5%、46.6%、35.8%、23.6%,与不引入 TBA 的空白对照组比较(去除效率为77.6%),其AN的降解率下降速度较快,说明TBA对HAH/Fe2+/H2O2体系去除AN有明显的抑制作用,且抑制效果随着TBA浓度增大而提高。分析原因可能是:TBA会与·OH自由基反应,导致了·OH自由基链反应的终止[13]。
3 结 论
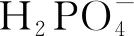
因此,要使苯胺废水的处理达到一个理想的水质效果,就必须解决在处理过程中遇到的离子干扰问题,而本研究为这一问题提供了参考依据和解决思路,从而达到经济效益与环境友好之间双赢的结果。

