紫杉醇调控NF-κB通路对FLT3-ITD突变急性髓细胞白血病细胞株MOLM-13增殖和凋亡的影响*
周宝文,吴梅青,石泽延,白子文,姚奕斌,刘振芳,庞如利,赵卫华
(广西医科大学第一附属医院血液内科,南宁 530021)
急性髓系白血病(acute myelocytic leukemia,AML)是由于造血细胞增殖能力提高、分化阻滞、凋亡障碍而引起的一类血液系统恶性肿瘤。其中,20%~30%的患者存在FLT3-ITD突变,此类患者往往诱导化疗不容易缓解,易复发,预后较差,且约有75%初次诊断时携带有FLT3-ITD突变的患者复发时仍携带此突变[1-2]。美国国立综合癌症网络(NCCN)和欧洲白血病网络(ELN)均将其列为AML患者预后不良的重要指标[3-4]。目前,FLT3抑制剂靶向联合化疗虽取得了较好的疗效,但耐药的出现带来了更大的挑战,寻找新的联合药物是应对耐药的重要策略[5]。1992年美国食品和药物管理局(FDA)已批准紫杉醇(paclitaxel,PTX)用于晚期卵巢癌的治疗,此后PTX被广泛应用于各种实体瘤的治疗如乳腺癌、结直肠癌、膀胱鳞状细胞癌、头颈癌、小细胞和非小细胞肺癌等[6-7]。PTX在杀伤肿瘤细胞的同时对免疫细胞还有调节功能[8]。近年来,一些基础研究表明PTX能够诱导不同类型白血病细胞发生凋亡[9]。本研究旨在探讨PTX在体外对FLT3-ITD突变AML细胞株MOLM-13增殖与凋亡的作用,并进一步探讨其可能的分子机制。
1 材料与方法
1.1细胞株FLT3-ITD突变AML细胞株MOLM-13购自南京科佰生物科技有限公司;FLT3未突变AML细胞株THP-1购自广州赛库生物技术有限公司。
1.2药品、主要试剂及仪器PTX(上海源叶生物科技有限公司);培养基及胎牛血清(Gibco);CCK8试剂盒(美仑生物技术有限公司);流式细胞凋亡检测试剂盒(美国BD公司);Trizol RNA提取试剂和逆转录以及RT-qPCR试剂盒(大连Takara公司)。引物由生工生物工程股份有限公司合成。抗FLT3抗体、抗NF-κB抗体、磷酸化(p)NF-κB抗体、辣根过氧化物酶(HRP)标记山羊抗兔IgG均购自CST公司。
1.3细胞培养MOLM-13细胞和THP-1细胞均用含10%胎牛血清、100 U/mL青霉素、100μg/mL链霉素的RPMI-1640完全培养液在37℃、5%CO2条件下培养,每2~3 d换液1次,取对数生长期、状态良好的细胞用于实验。
1.4 CCK8法测定PTX对MOLM-13和THP-1细胞增殖的影响 本实验设对照组(含有1‰DMSO溶剂)和实验组(2 nmol/L、4 nmol/L、8 nmol/L、10 nmol/L PTX),将细胞浓度调整为5×105个/mL,接种于96孔细胞培养板中,每组4个复孔,每孔100μL,分别培养24 h、48 h、72 h后,每孔加入10μL的CCK8溶液,37℃孵育2 h,用酶标仪测定各孔450 nm处的吸光度(OD)值。按以下公式计算细胞存活率:存活率=[(实验组-空白组OD值)/(对照组-空白组OD值)]×100%。
1.5流式细胞术检测细胞凋亡 实验设为对照组(含有1‰DMSO溶剂)和实验组(4 nmol/L、8 nmol/L PTX),处理48 h后,分别收集MOLM-13细胞和THP-1细胞,PBS洗涤细胞,用Binding Buffer重悬细胞,加入5μL Annexin Ⅴ,常温避光孵育15 min,加入5μL PI以及300μL Binding Buffer,轻轻混匀,用流式细胞仪检测。流式凋亡图左上象限(Q1)表示坏死的细胞,右上象限(Q2)表示晚期凋亡细胞,右下象限(Q3)表示早期凋亡细胞,左下象限(Q4)表示正常的细胞。细胞凋亡率=早期凋亡率+晚期凋亡率。
1.6实时荧光定量PCR法(RT-qPCR)检测FLT3、NF-κB基因表达 实验设对照组(含有1‰DMSO溶剂)和实验组(4 nmol/L、8 nmol/L PTX),处理48 h后,收集MOLM-13细胞,用trizol提取总RNA,逆转录成cDNA,然后进行PCR扩增,反应条件为95℃预变性30 s;95℃变性5 s;60℃退火、延伸30 s,共40个循环。GAPDH为内参基因,采用2-ΔΔCT法计算目的基因相对表达量。引物序列:GAPDH上游:5’-CTCTGCTCCTCCTGTTCGAC-3’,下游:5’-TAAAAAGCAGCCCTGGTGAC-3’;FLT3上游:5’-GCAATCATAAGCACCAGCCAGGAG-3’,下游:5’-TTCTGCGAGCACTTGAGGTTTCC-3’;NF-κB上游:5’-CCCGTGGTATCAGACGCCAT-3’,下游:5’-TCCTCCCCTCCAGTCACACA-3’。
1.7 Western blotting法检测FLT3、NF-κB蛋白表达
收集MOLM-13细胞,PBS洗涤,按比例加入RIPA(10μg/mL)裂解液和蛋白酶抑制剂,置于冰上充分裂解30 min后,4℃、12 000 r/min离心20 min,小心吸取上清液,为总蛋白液。采用BCA试剂盒对蛋白浓度进行测定。蛋白上样后,十二烷基硫酸钠—聚丙烯酰胺凝胶(SDS-PAGE)电泳2~3 h,湿法恒流转膜1~2 h,封闭液封闭30 min。一抗(FLT3、NF-κB、p-NF-κB)稀释倍数1∶1 000,4℃孵育过夜,TBST漂洗3次,每次8 min;二抗[辣根过氧化物酶(HRP)标记山羊抗兔IgG]稀释倍数1∶5 000,室温孵育1~2 h,TBST漂洗3次,每次8 min;滴加ECL发光液,在凝胶成像系统中曝光。用Image J软件对各蛋白条带灰度值进行定量分析。
1.8统计学方法 采用SPSS 17.0软件进行统计分析以及半数抑制浓度(IC50)计算,计量资料以均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PTX对MOLM-13和THP-1细胞增殖的影响
通过CCK8检测不同浓度不同时间的PTX处理后MOLM-13和THP-1细胞活性,不同浓度的PTX作用于MOLM-13和THP-1细胞后,细胞存活率均有下降,呈剂量和时间依赖性,见图1。其中,PTX作用于MOLM-13细胞24 h、48 h、72 h的IC50分别为7.659 nmol/L、3.748 nmol/L、3.408 nmol/L;而PTX作用于THP-1细胞24 h、48 h、72 h的IC50分别为61.164 nmol/L、11.804 nmol/L、9.834 nmol/L。
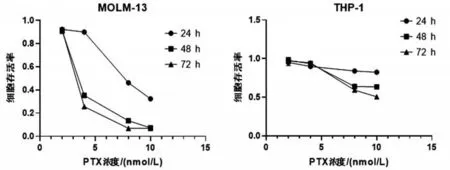
图1 不同浓度PTX作用不同时间对MOLM-13和THP-1细胞增殖的影响
2.2 PTX对MOLM-13和THP-1细胞凋亡的影响
不同浓度的PTX(0 nmol/L、4 nmol/L、8 nmol/L)作用MOLM-13和THP-1细胞。PTX处理后的MOLM-13细胞凋亡率、早期凋亡率均高于对照组(0 nmol/L PTX组)(P<0.05)。而4 nmol/L PTX处理后的THP-1细胞凋亡率、早期凋亡率与对照组相比,差异无统计学意义(P>0.05);8 nmol/L PTX处理后的THP-1细胞凋亡率、早期凋亡率升高(P<0.05),见表1。且相同浓度的PTX作用下,4 nmol/L PTX组、8 nmol/L PTX组中MOLM-13细胞的凋亡率、早期凋亡率均高于THP-1细胞(均P<0.05),见图2。

图2 不同浓度PTX作用48 h对MOLM-13和THP-1 细胞凋亡的影响
表1 不同浓度PTX处理48 h对MOLM-13和THP-1细胞凋亡的影响
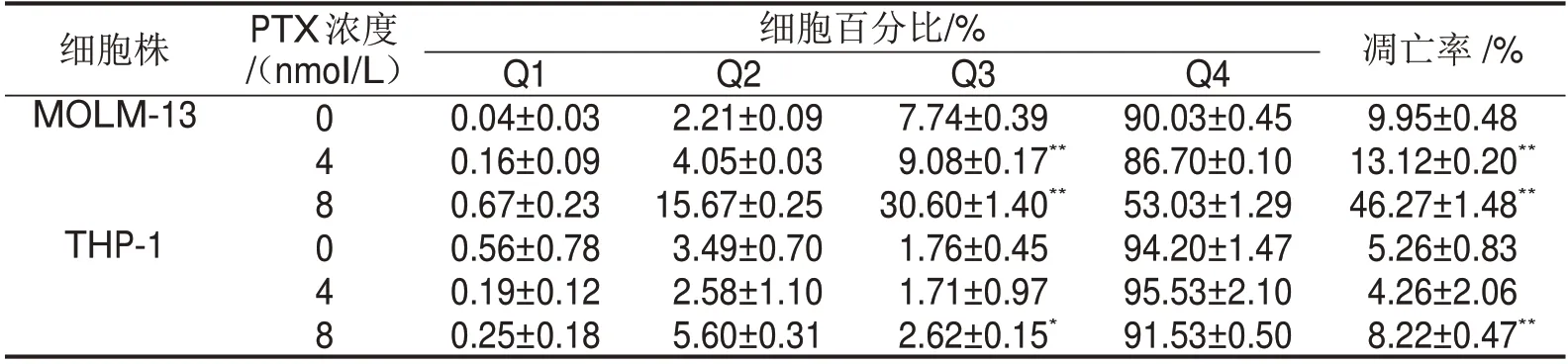
表1 不同浓度PTX处理48 h对MOLM-13和THP-1细胞凋亡的影响
与对照组比较,*P<0.05,**P<0.01。
2.3 PTX作用MOLM-13细胞株后对FLT3、NF-κB基因的影响 不同浓度的PTX(0 nmol/L、4 nmol/L、8 nmol/L)作用MOLM-13细胞48 h后,与对照组(0 nmol/L PTX组)相比,实验组(4 nmol/L、8 nmol/L PTX)FLT3mRNA相对表达量降低,且随着PTX剂量的增加而降低(P<0.05),见图3。4 nmol/L的PTX作用MOLM-13细胞48 h后,NF-κBmRNA相对表达量无明显变化,而8 nmol/L的PTX作用MOLM-13细胞48 h后,与对照组(0 nmol/L PTX)相比,NF-κBmRNA相对表达量降低(P<0.01),见图3。

图3 PTX对MOLM-13细胞FLT3、NF-κB基因表达的影响
2.4 PTX作用MOLM-13细胞株后对FLT3、NF-κB及p-NF-κB蛋白表达的影响PTX作用于MOLM-13细胞48 h后FLT3蛋白表达量与对照组(0 nmol/L PTX组)相比降低(P<0.05)。4 nmol/L的PTX作用MOLM-13细胞48 h后NF-κB蛋白表达量无明显变化,而8 nmol/L的PTX作用MOLM-13细胞48 h后,与0 nmol/L PTX组相比,NF-κB蛋白表达量降低(P<0.05),见图4。4 nmol/L与8 nmol/L PTX作用于MOLM-13细胞48 h后,两组细胞p-NF-κB蛋白表达量与对照组(0 nmol/L PTX组)相比均降低(P<0.05),见图4。
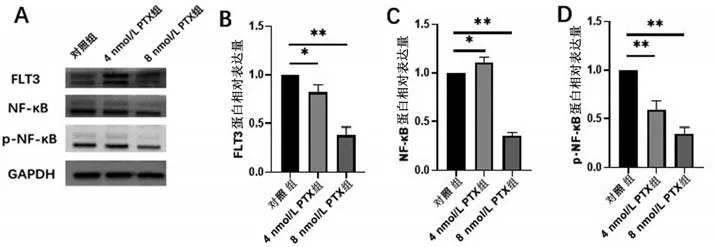
图4 不同浓度PTX处理48 h对MOLM-13细胞蛋白表达的影响
3 讨论
近年来,随着造血干细胞移植技术的成熟应用和靶向药物进入临床,AML的治疗取得了很多新的突破。FLT3抑制剂如索拉菲尼、米朵妥林、奎扎替尼等均在复发/难治性AML的治疗中显示出了显著的临床效果[10]。一项研究表明,采取同种异体造血干细胞移植和FLT3抑制剂治疗的FLT3-ITD突变阳性的AML患者,有更大的比例在连续几年内达到完全缓解,相应的中位生存期和中位复发时间延长[11]。但同时也有研究表明,FLT3-ITD突变阳性的AML患者即使进行了异基因造血干细胞移植,复发的风险也很高[12]。而FL3抑制剂治疗也面临着单药抗性小、耐药等问题[10]。耐药与复发仍是FLT3-ITD阳性AML治疗中存在的难题,寻找和尝试新的有效的治疗药物是提高疗效的关键。
PTX是一种微管稳定剂,其主要作用机制是通过诱导和促进微管蛋白聚合、抑制微管解聚、诱导细胞周期阻滞及促进凋亡。有研究表明,PTX可诱导原代慢性淋巴细胞白血病细胞的凋亡[8, 13]。本研究将PTX应用于AML细胞MOLM-13和THP-1,结果显示PTX可抑制MOLM-13和THP-1细胞生长,且发现24 h、48 h、72 h PTX对FLT3-ITD突变阳性的细胞株MOLM-13的IC50均小于该突变阴性的THP-1细胞株。相较于THP-1细胞,PTX诱导MOLM-13细胞凋亡,且随着PTX浓度的增加,细胞数量逐渐减少,说明PTX能特异性地抑制MOLM-13细胞增殖与诱导凋亡。同时本课题组也证实了PTX还能抑制FLT3基因和蛋白的表达,可以推测PTX对FLT3突变存在特异性的作用。本课题组前期实验已经证实PTX能抑制MOLM-13细胞增殖,且与抑制PI3K/AKT/mTOR信号通路的活性有关。而PI3K/AKT和(或)RAS/MEK/MAPK通路的激活,以及FLT3介导的细胞转化相关基因的持续表达是FLT3激酶抑制剂耐药的机制之一[14]。
NF-κB是广泛存在于各种类型细胞中的一种转录因子,其被发现在许多实体肿瘤和血液恶性肿瘤中异常激活,使得肿瘤细胞异常增殖和耐药[15]。在AML中,FLT3-ITD突变或过表达FLT3会激活NFκB,使得NF-κB成组性地与DNA结合[16-17]。而在本实验中,8 nmol/L的PTX能降低MOLM-13细胞中NF-κB基因和蛋白的表达,4 nmol/L PTX可能是由于时间或剂量的关系没有发挥抑制作用;同时PTX也能抑制MOLM-13中磷酸化NF-κB蛋白的表达,可以推测PTX是通过抑制NF-κB通路,从而抑制MOLM-13细胞的增殖及诱导其凋亡的。
综上,PTX对FLT3-ITD突变阳性AML细胞株存在抑制增殖和诱导凋亡作用,其诱导凋亡作用是通过抑制FLT3和NF-κB mRNA和蛋白表达实现。该研究为PTX治疗AML提供了理论基础,有望提高FLT3-ITD突变阳性AML的治疗效果,为AML化疗联合药物提供了新的思路。今后拟将PTX应用于荷瘤小鼠以及AML原代细胞中,进一步阐明其对FLT3-ITD突变阳性AML的体内、外抗肿瘤作用,为临床治疗提供实验基础。

