对苯二甲酸二钠内标在定量核磁共振代谢组学中的应用
王 峥,黄慧英,徐庆妍*,李 健*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.厦门大学生命科学学院,福建 厦门 361102)
近年来,随着核磁共振(NMR)技术的迅速发展,基于NMR分析的代谢组学研究逐渐成为一项不可或缺的研究内容,在药物研发和医疗领域发挥着重要作用[1-5].如何准确、定量判断样品中各种物质的含量从而完成对药效的评价、毒性的研究和疾病的诊断,是定量NMR(qNMR)技术在代谢组学研究、医学诊断等应用中的重要研究内容之一[6].qNMR作为代谢组学的重要检测分析手段之一,具有显著的优势:首先,该技术对样品是非破坏性的,无需对测试样品进行分离或衍生化,样品处理简单;其次,它可同时全面分析检测代谢产物的组成和实时变化,并可通过对内源性小分子代谢物的定量分析来识别代谢标志物,为生物体的病理或生理状态判定提供信息.
qNMR主要通过质子峰面积和质子数量的比值来实现定量,常用定量方法包括相对定量和绝对定量[7].相对定量中代谢物的变化不会被独立评估,而是与其他代谢物相关,因而无法与其他体系进行对比[8-9];而绝对定量中通常使用内标法,即使用已知结构和浓度的化合物作为内标物,与待测样品混合测定并通过对比定量峰的面积来实现定量[10].内标在NMR谱图中有着稳定的峰高和峰形[6],将其直接添加到样品中可以形成可靠的内部参考标准,因而长期用于qNMR代谢组学[10].
在代谢组学和临床研究中,血液样品为最常见的体液样品,但血液中含有大量的蛋白,qNMR中常用的水溶性内标常因为与蛋白结合而导致定量误差.例如,qNMR代谢组学常用的内标3-(三甲基硅基)-2,2,3,3-四氘代丙酸钠盐(TSP-D4)、4,4-二甲基-4-硅戊烷-1-磺酸(DSS)和4,4-二甲基-4-硅戊烷-三氟乙酸胺(DSA),常因为与血液中蛋白结合而导致NMR谱图中特征峰的变形和化学位移的变化,从而造成qNMR测定的不准确性[11-13];此外,由于TSP-D4和DSS是弱酸,它们的结构和化学位移也容易受到测试样品pH变化的影响[14],为浓度的定量检测带来不确定性.甲酸和马来酸也常被用作qNMR测定的内标,尽管二者不与蛋白结合[11,13,15],但它们却是天然存在的内源性代谢产物(如甲酸代谢和糖酵解的产物),容易为qNMR的测定带来不确定性.因此,内标物的选择对qNMR测定的准确性十分重要.
为了解决以上qNMR代谢组学分析中存在的问题,迫切需要寻找新的内标物.理想的内标需要满足以下要求:1)与蛋白没有相互作用;2)在NMR谱图中特征峰的化学位移与血液样品中的内源性代谢物有明显区别,便于通过特征峰的峰面积测定实现血液样品的定量检测分析.本研究通过对一系列芳香族化合物的分析发现:对苯二甲酸二钠(图1)在脂肪区没有氢原子,芳环区的4个氢原子出峰位置相同,其信号峰为一个尖锐的单峰,易于准确计算积分面积且远离大多数内源性代谢物的信号峰;同时该内标不易挥发,性质稳定,也不是代谢途径中的天然内源性代谢产物.因此,对苯二甲酸二钠有望成为qNMR代谢组学分析中新的内标物.
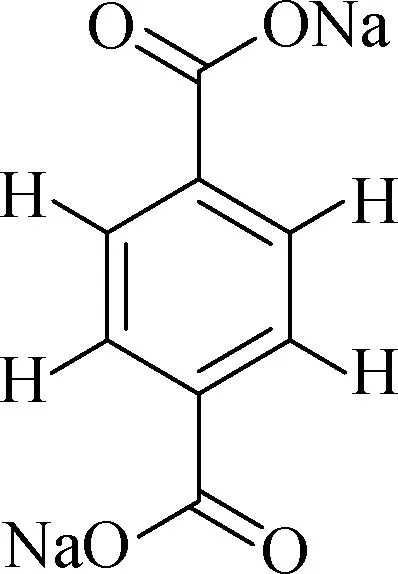
图1 对苯二甲酸二钠结构式
1 材料与方法
1.1 仪器与材料
Bruker AVANCE Ⅲ 600 MHz超导NMR波谱仪(Bruker),BBO正相观察宽带探头(Bruker),BVT 3200数字控温仪(Bruker),台式酸度计(Mettler Toledo),氘代水(Sigma-Aldrich,氘代度>99.8%),对苯二甲酸二钠(安耐吉化学,分析纯,99%),对苯二甲酸(安耐吉化学,分析纯,99%),对苯二酚(安耐吉化学,分析纯,99%),对苯醌(安耐吉化学,分析纯,98%),草酸钠(国药集团化学试剂有限公司,分析纯,99%),离心管(Eppendorf),SPF级BALB/c小鼠(购自中国科学院上海实验动物中心),肠癌患者血液样品(由厦门中山医院和哈尔滨医科大学提供).
1.2 内标溶液的制备
精密称取对苯二甲酸二钠(内标)适量,用氘代水配制成浓度为10 mmol/L的内标溶液,pH=7.4.同时在pH酸度计的指示下,用NaOH饱和溶液调节对苯二甲酸二钠氘水溶液为pH=9.0的测试溶液,用对苯二甲酸饱和溶液调节对苯二甲酸二钠氘水溶液为pH=6.0的测试溶液.
精密称取对苯二甲酸、对苯二酚和对苯醌适量,分别用氘代水配制成10 mmol/L的标准溶液.
1.3 NMR测试的样品制备
1.3.1 血液样品的制备
对小鼠进行眼眶采血,让血液滴入事先灭菌的1.5 mL离心管中,得到全血;取小鼠全血,用0.1 mol/L草酸钠作为抗凝剂,抗凝剂与血液按体积比1∶9混合进行抗凝处理后,冰上放置30 min,3 000 r/min离心10 min,得到血浆;取小鼠全血于冰上放置1 h,3 000 r/min离心10 min,得到血清.
取肠癌患者的血液样品并保存于常规生化采血管(柠檬酸钠抗凝)后用干冰低温运输,测试前将采血管中血液样品混匀.
分别取100 μL小鼠全血、血浆、血清及肠癌患者的全血样品,加入550 μL氘代水,3 000 r/min离心2 min 后,得到血液样品待测液;取590 μL该血液样品待测液,加入1.2节所述内标溶液至总体积为600 μL,混合均匀后置于5 mm核磁管中待测.
1.3.2 标准样品溶液的制备
分别取1.2节所述内标溶液、测试溶液和标准溶液600 μL,置于5 mm核磁管中待测.
1.4 样品的qNMR测试
测试条件:实验温度为25 ℃,氘代试剂为D2O.所有血液样品均采用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列采集信息,参数如下:谱宽(SWH)为12 335.50 Hz,采样时间(AQ)为1.63 s,采样数据点(TD)为40 212,扫描次数(NS)为96次,延迟时间(D1)为2 s,回波时间(2nτ)为144 ms.所有标准样品的氘水溶液采用NOESY(Nuclear Overhauser Effect Spectroscopy)脉冲序列采集信息,参数如下:SWH为10 000 Hz,AQ为1.63 s,TD为32 768,NS为40次,D1为2 s,混合时间(D8)为120 ms.
在上述实验条件下,设置仪器参数、温度控制、调谐、匀场、采样,得到1H-NMR谱图.对谱图进行相位调整并调平基线,选择对苯二甲酸二钠(内标)和乳酸的峰作为定量参考峰,并对其进行积分.乳酸双峰的左侧谱峰化学位移为1.33.根据《中华人民共和国药典2015年版 四部》附录的内标定量法[16],按以下公式计算乳酸的绝对含量:
cl=(Al×Vi×Ni×ci)/(Ai×Vl×Nl),
其中,Nl为被测样定量峰包含的质子数,Ni为内标定量峰包含的质子数,Al为被测样定量峰的积分面积,Ai为内标定量峰的积分面积,cl为被测样浓度(mmol/L),ci为内标浓度(mmol/L),Vi为加入的内标体积(μL),Vl为加入的被测样体积(μL).
2 结果与讨论
2.1 内标化合物的筛选
针对目前常用内标物易与蛋白发生作用,或其本身为天然内源性代谢产物等影响qNMR代谢组学血液样品分析准确性的问题,分析显示大部分小分子内源性代谢物信号峰集中在δ0~6.00,如果从芳香类化合物中选取合适的分子作为内标物将有可能解决上述问题.首先选用对苯二酚、对苯醌、对苯二甲酸作为内标物分子,采用CPMG序列研究其在qNMR检测中的应用.实验结果(图2)表明:这些化合物在小鼠全血样品中的NMR信号峰都为相对独立、尖锐的单峰,在δ6.60~8.00,明显区别于血液样品中内源性小分子代谢物的信号峰δ0~6.00,具备作为内标物的基本条件.
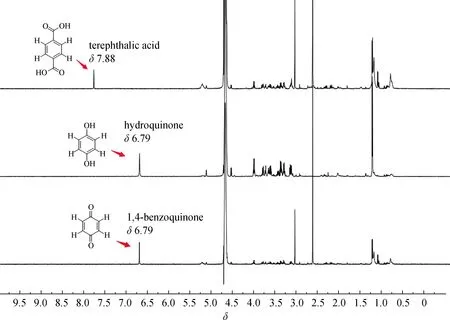
图2 小鼠全血样品中对苯二酚、对苯二甲酸和对苯醌的1H-NMR谱图
除了对内标物特征峰的独立化学位移的要求,对于血液样品检测还要求内标物具有低毒性和水溶性,以避免破坏血液样品中的物质影响制样稳定性和结果可重复性.已有研究表明对苯二酚和对苯醌的毒性较大[17-18],不适合于血液样品的检测,且对苯二酚在暴露于空气中时非常容易发生氧化而导致内标化合物的结构变化.对苯二甲酸的毒性和稳定性均能够满足要求,但该类化合物的水溶性差[19].在应用中为了保证内标物的量,需使用较大体积的内标液,内标物溶解度差不仅不利于保证批间制样的稳定性,而且为达到相同的内标浓度会使血液样品的浓度降低并影响NMR谱图的信噪比.因此,考虑使用对苯二甲酸盐来改善内标的水溶性问题.钠离子是血液中最多的阳离子,在维持正常渗透压和调节酸碱平衡上有着重要的意义,因此本研究考察了以对苯二甲酸二钠为血液样品qNMR内标的情况.结果发现:对苯二甲酸二钠既可以保留对苯二甲酸低毒和稳定的优点,又能够很好地解决水溶性差的问题.人体血液的正常pH范围为7.3~7.4,对苯二甲酸二钠的氘水溶液pH为7.4.分别在pH 6.0,7.4和9.0条件下考察内标对酸碱环境的敏感性,采用NOESY序列进行研究,结果表明:在上述pH条件下其化学位移均不发生改变,为7.88,可见对pH的变化极不敏感(图3).因此,确定对苯二甲酸二钠作为优选的qNMR代谢组学内标.
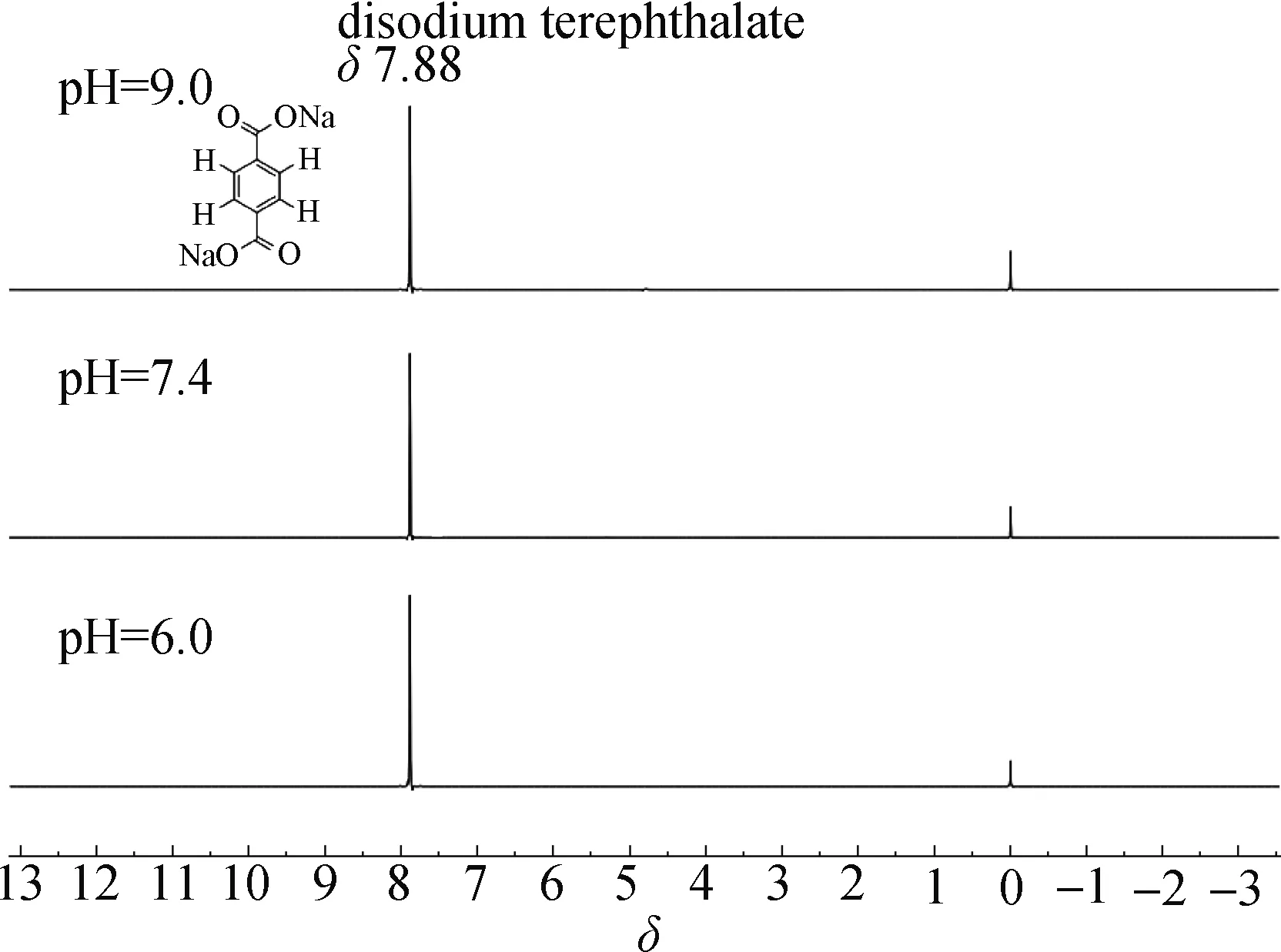
图3 对苯二甲酸二钠在不同pH的氘水溶液中的1H-NMR谱图
2.2 对苯二甲酸二钠内标与蛋白结合情况的评价
通常内标物与蛋白的结合程度可以从二者混合后内标特征峰的半峰宽和峰面积两方面进行评价.半峰宽变宽的程度越小,峰面积减少的程度越低,说明内标与蛋白的结合程度越小,也就表明该物质越适合作为内标物进行定量分析[20].由于β-葡萄糖较α-葡萄糖的耦合常数更大,谱峰裂分更清晰,所以用β-葡萄糖δ4.64处谱峰作为半峰宽参考[21].乳酸虽然与蛋白相结合,但其游离与结合的量之比为常数[22],且在δ4.14 处的谱峰不存在和脂类谱峰重叠的干扰,因此以乳酸δ4.14处谱峰作为峰面积的参考.用半峰宽比(内标/β-葡萄糖)和峰面积比(内标/乳酸)来评价蛋白结合程度,详细考察对苯二甲酸二钠内标与蛋白的结合情况.将苯二甲酸二钠作为内标分别加入同一只小鼠的全血、血浆和血清中(n=3),使用CPMG序列采集获得相应待测血液样品的1H-NMR谱图(图4).参照文献[18]报道的方法,计算对苯二甲酸二钠在小鼠全血、血浆和血清中的半峰宽比和峰面积比.
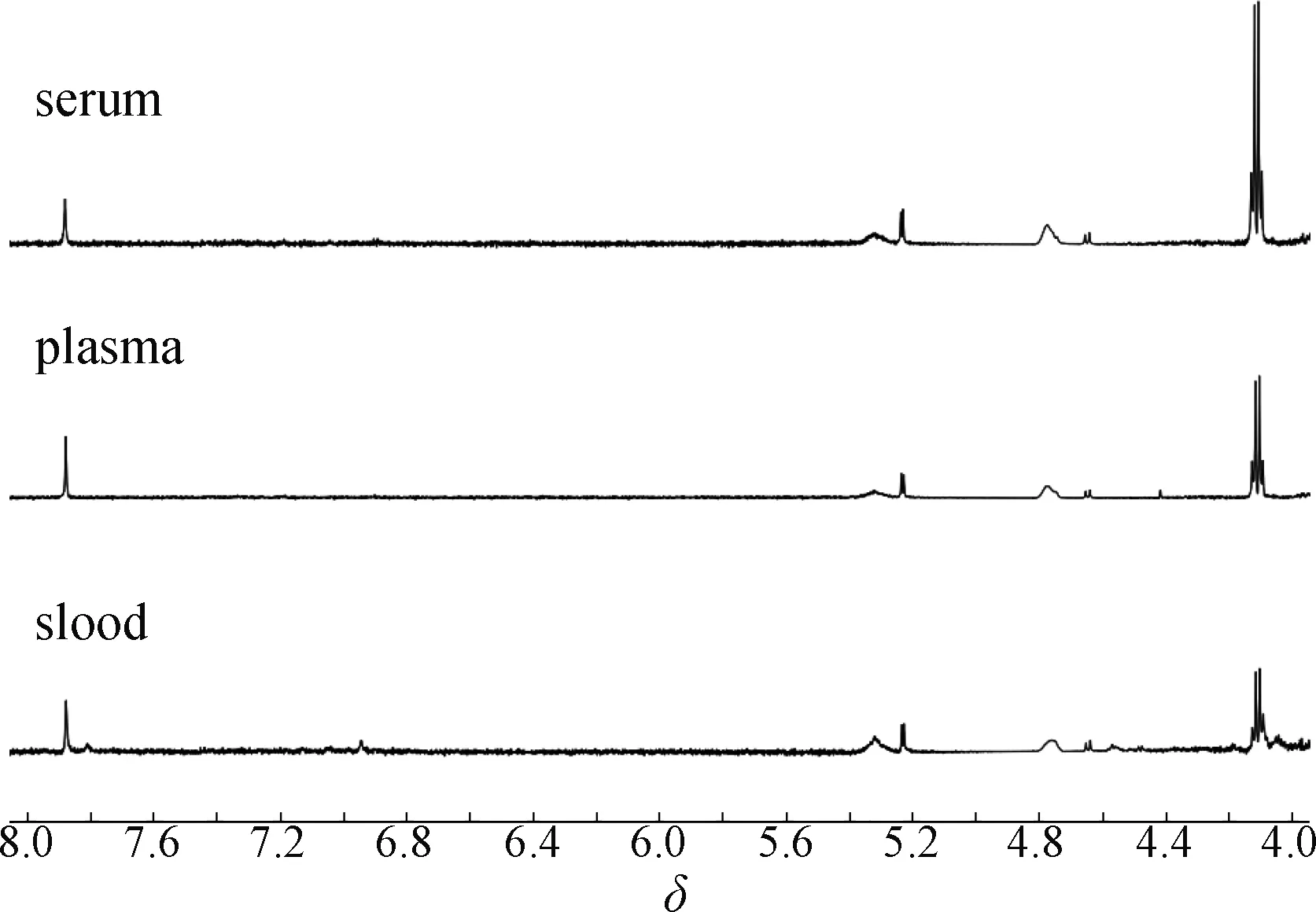
图4 对苯二甲酸二钠在小鼠全血、血浆和血清中的1H-NMR谱图
从图4可以看出:对苯二甲酸二钠在小鼠全血、血浆和血清中的化学位移均为7.88,化学位移的改变,说明该内标没有与待测血液样品中的物质发生作用;同时该内标在小鼠全血、血浆和血清中的半峰宽比和峰面积比表现较为一致,说明该内标不与血液样品中的蛋白相结合.如表1所示,与已知内标(DSA、TSP、二甲基亚砜、三噁烷、马来酸、甲酸钠)在小鼠血浆中蛋白结合参数[20,23-25]相比,对苯二甲酸二钠的半峰宽比和峰面积比最小,可见该内标与蛋白的结合程度最弱.这些结果进一步表明对苯二甲酸二钠可作为qNMR检测血液样品中代谢物的优选内标.
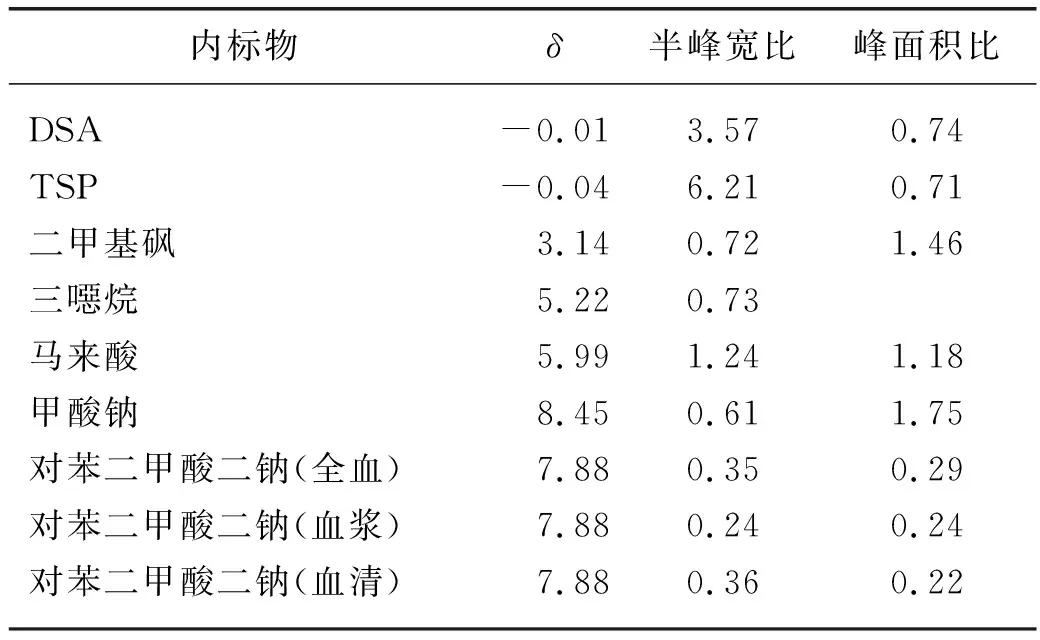
表1 内标与蛋白结合程度的结果
2.3 以乳酸为代表的代谢物定量表征
以对苯二甲酸二钠作为内标,对小鼠血液中的乳酸浓度进行定量分析.取同一只小鼠的全血、血浆和血清样品(n=3)进行测试,当将对苯二甲酸二钠的化学位移为7.88时,乳酸的化学位移为4.14,根据1.4节所述公式计算乳酸浓度(表2).
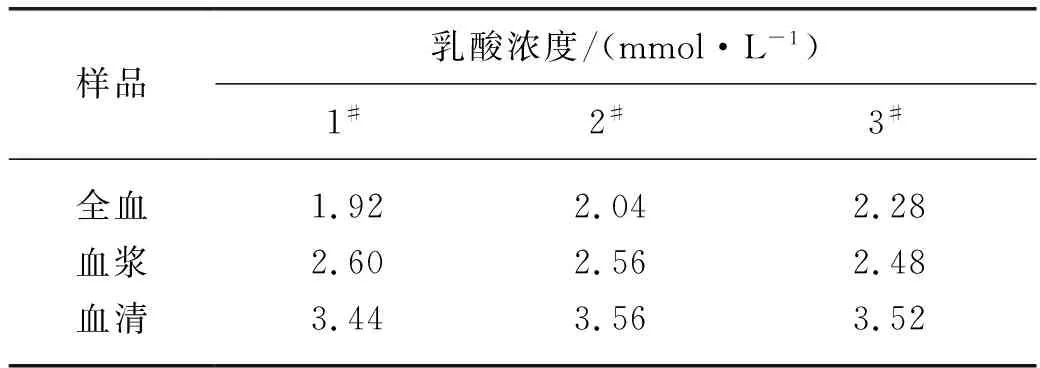
表2 小鼠全血、血浆、血清中乳酸浓度
从表2可以看出,小鼠全血、血浆、血清中乳酸浓度(1.92~3.56 mmol/L)与文献[26-27]报道的正常小鼠的乳酸浓度(1.0~5.6 mmol/L)结果相吻合,均在正常生理范围内.该结果验证了对苯二甲酸二钠内标应用于血液样品中代谢物定量分析的可行性.
2.4 对苯二甲酸二钠内标在肠癌患者全血样品分析中的应用
乳酸是癌症的发生和发展过程中重要的检测指标.2018年Simona Corso研究团队发现:癌细胞在治疗过程中处于抗癌药物的环境下,新陈代谢会发生改变,引起糖酵解从而导致乳酸增加;增加的乳酸会进一步刺激癌细胞周围间质细胞使其分泌肝细胞生长因子,从而增强癌细胞对靶标药物的抗药性;在疾病的动物模型中也证实,采用药物抑制癌细胞分泌乳酸可以削弱癌细胞的抗药性[28].另有研究提出,循环乳酸在肿瘤组织中提供了主要的代谢燃料并促进了肿瘤生长[29].因此,对乳酸的定量检测可能成为对癌症的发生和发展进行评价和监测的有效手段.
以对苯二甲酸二钠为内标,对20例肠癌患者的全血样品进行qNMR检测,并按照1.4节所述方法计算乳酸浓度,结果如表3所示.在所有样品中,对苯二甲酸二钠均表现出稳定性好、溶解性好、出峰简单、不干扰待测样品等性质,所测结果稳定.
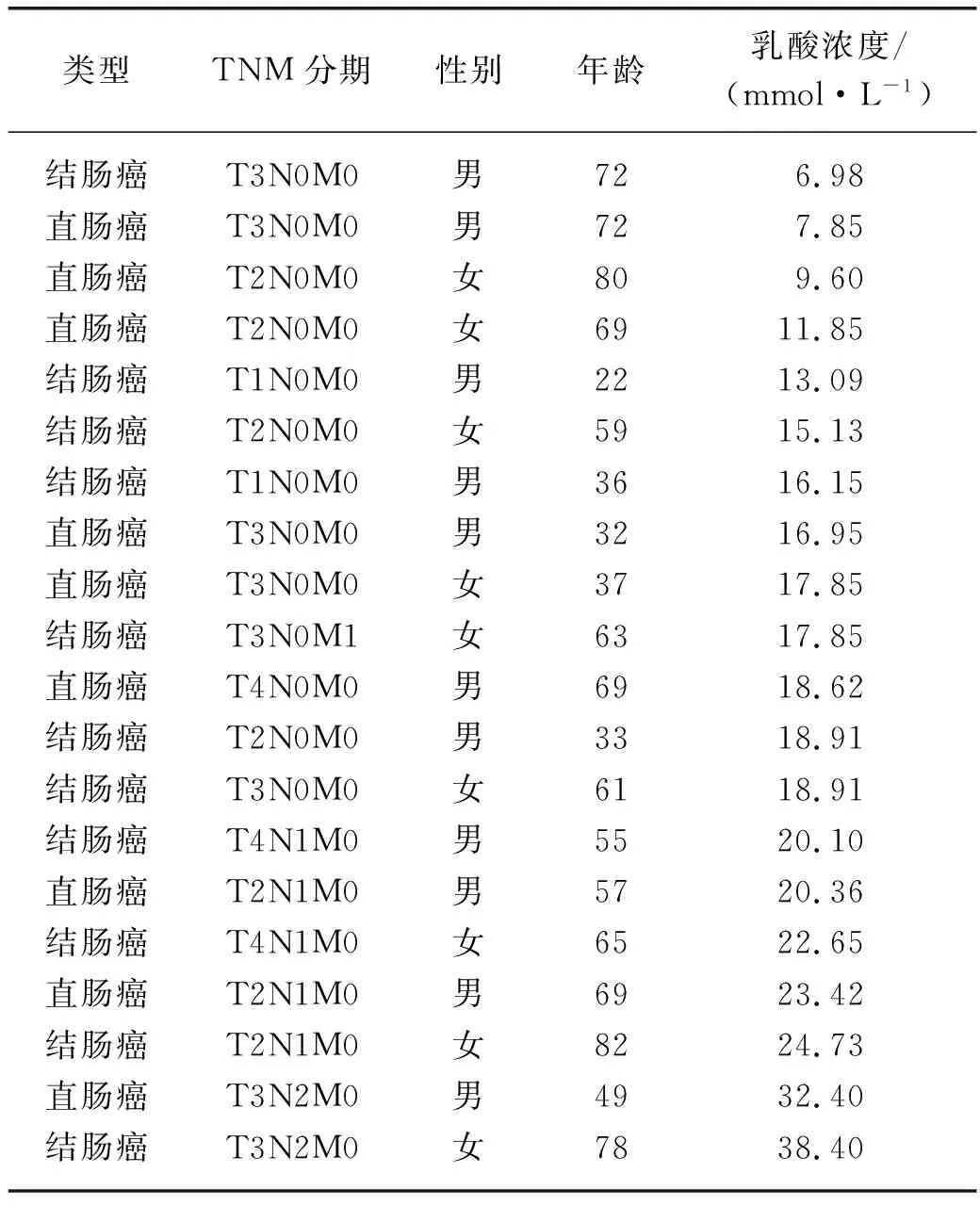
表3 肠癌患者全血样品中乳酸浓度
在正常生理条件下,静息状态时人体血液的乳酸浓度为1~2 mmol/L,而在剧烈运动下乳酸浓度可达20 mmol/L[30].已有研究表明,癌症患者血液中的乳酸水平与肿瘤的发生程度有着紧密的联系[31-32].从表3可以看出,肠癌患者血液中的乳酸浓度为6.98~38.40 mmol/L,根据临床信息得知该组肠癌患者在住院期间处于静息状态,而其血液中的乳酸浓度明显高于正常人体静息状态下的值,提示基于乳酸浓度测定的血液qNMR代谢组学检测有望作为肠癌疾病发展监测的重要手段.
3 结 论
本研究从分析内标化合物的分子结构出发,系统考察了对苯二酚、对苯醌、对苯二甲酸以及对苯二甲酸二钠作为qNMR检测分析内标物的可行性.结果表明对苯二甲酸二钠不与血液样品中的蛋白发生作用,与内源代谢物能有效区分并且较为稳定,有效解决了常用内标在qNMR代谢组学分析中易与蛋白结合、与内源性代谢物谱峰重叠等问题,可用作理想的内标物.将此基于对苯二甲酸二钠的qNMR代谢组学分析方法应用于乳酸浓度的定量测定,结果初步揭示了肠癌病人的血液样品中乳酸浓度与疾病临床进展阶段的相关性.综上所述,本研究发现了一种qNMR代谢组学的理想内标对苯二甲酸二钠,建立了qNMR代谢组学在血液中的分析方法.该方法有望用于与疾病进展相关的代谢物鉴定和监测,为疾病的临床辅助诊断和监测提供一种方便、快捷的分析手段.

