木质素磺酸钠对1060工业纯铝在盐酸介质中的缓蚀性能
陈永强,雷然,李向红
(西南林业大学 化学工程学院,云南 昆明 650224)
添加缓蚀剂是抑制铝在HCl酸洗过程中的主要方法[1-2]。表面活性剂是一类低毒、高效、价廉的缓蚀剂,其在金属/溶液界面上的吸附行为及缓蚀机理已被国内外学术界广泛关注[3-4]。溴化十六烷基吡啶[5]、苯扎氯铵[6]、1,1(月桂酰胺)丙基氯化铵[7]、溴化十四烷基吡啶(TDPB)等[8]阳离子表面活性剂及吐温[9]、聚氧乙烯单油酸酯(OL[EO]n)等[10]非离子表面活性剂作为铝在HCl中的有效缓蚀剂已有研究报道。
除此之外,阴离子表面活性剂对铝的缓蚀作用也有相关研究报道,如十二烷基硫酸钠[11]、十二烷基磺酸钠[11]、十二烷基苯磺酸钠[11-12]、异丙苯磺酸钠[13]、石油磺酸钙[14]。木质素磺酸钠(SLS)作为抑制钢腐蚀的缓蚀剂已有报道[15-17]。本文采用失重法、电化学法和表面分析测试系统研究了不同温度条件下SLS对铝在HCl中的吸附行为及缓蚀作用。
1 实验部分
1.1 材料与仪器
1060工业纯铝片组成成分:铝(Al)质量分数99.60%、硅(Si)质量分数0.15%、铜(Cu)质量分数0.024%、铁(Fe)质量分数0.30%、镁(Mg)质量分数0.002 5%、钛(Ti)质量分数0.001%;盐酸(35%~37%)、木质素磺酸钠(SLS)均为分析纯。
SPA-400 SPM unit原子力显微镜;S4800场发射扫描电子显微镜;HWS-20型恒温电热水浴箱;AX224ZH/E型电子天平;PARSTAT2273型电化学工作站。
1.2 失重法测试
将铝片试样裁剪为25 mm×20 mm×0.5 mm规格,依次用180#、600#、1200#耐水砂纸打磨处理后储存于真空干燥器中备用。实验前使用电子天平(±0.1 mg)精确地称量铝片质量,用尼龙线悬挂于250 mL烧杯中,确保铝片不接触杯壁。将未添加和添加不同浓度SLS的1.0 mol/L HCl溶液移入烧杯,确保铝片全浸于溶液中,并将烧杯放入节能恒温电热水浴箱(±0.1 ℃)中2 h,取出铝片用自来水洗净表面附着的腐蚀产物,并用鼓风机冷风快速吹干,再次精确称重,从而得出铝片失重(W)。根据式(1)计算腐蚀速率[v,g/(m2·h)]:
(1)
式中W——铝片放入1.0 mol/L HCl溶液中浸泡腐蚀前后的质量差,g;
S——铝片表面积,m2;
t——铝片放入1.0 mol/L HCl溶液中浸泡腐蚀时长,h。
根据式(2)计算SLS缓蚀率(ηw,%):
(2)
式中v0、v——未添加和添加一定浓度缓蚀剂SLS的铝片试样的腐蚀速率,g/(m2·h)。
1.3 电化学测试SLS缓蚀性能
采用三电极工作系统测试其电化学曲线,参比电极(RE)为套有Luggin 毛细管的饱和KCl甘汞电极、辅助电极(CE)选用Pt电极、工作电极(WE)为环氧树脂灌封铝电极。进行测试之前,工作电极(WE)必须按照“1.2失重法测试”时的操作步骤进行打磨处理。为确保开路电位足够稳定,打磨处理好的铝电极用丙酮脱脂后放入250 mL不含和含有SLS (0.1~1.0 g/L)的1.0 mol/L HCl电解池溶液中2 h 后进行分析测试。测试仪器选用电化学工作站。Tafel曲线测试区间为:-250~+250 mV,扫描速率 0.5 mV/s。EIS测试频率为:0.01~105Hz,交流激励幅值为10 mV。根据式(3)计算极化曲线法缓蚀率(ηp,%):
(3)
式中icorr(0)——空白溶液(1.0 mol/L HCl)中铝的腐蚀电流密度,μA/cm2;
icorr(inh)——添加SLS的1.0 mol/L HCl溶液中铝的腐蚀电流密度,μA/cm2。
1.4 SEM和AFM测试
将铝试样按照1.2节中所述进行表面处理后,25 ℃条件下,在不添加和添加1.0 g/L SLS的1.0 mol/L HCl溶液中恒温浸泡2 h后取出,用自来水洗净铝片表面附着腐蚀产物,试纸擦拭悬于铝片表面水珠,冷风快速吹干,采用场发射扫描电子显微镜完成铝片表面SEM测试,用原子力显微镜完成铝片表面AFM测试。
2 结果与讨论
2.1 失重法测试SLS对铝在HCl中的缓蚀及吸附行为
在HCl溶液中铝片受到严重腐蚀。实验中清晰可见铝片表面析出大量气泡,并且随着温度的升高而愈加剧烈。然而,在1.0 mol/L HCl溶液中加入SLS后明显抑制了铝片的腐蚀。图1为20,25,30,35 ℃条件下缓蚀率(ηw)随SLS浓度(c)变化关系。
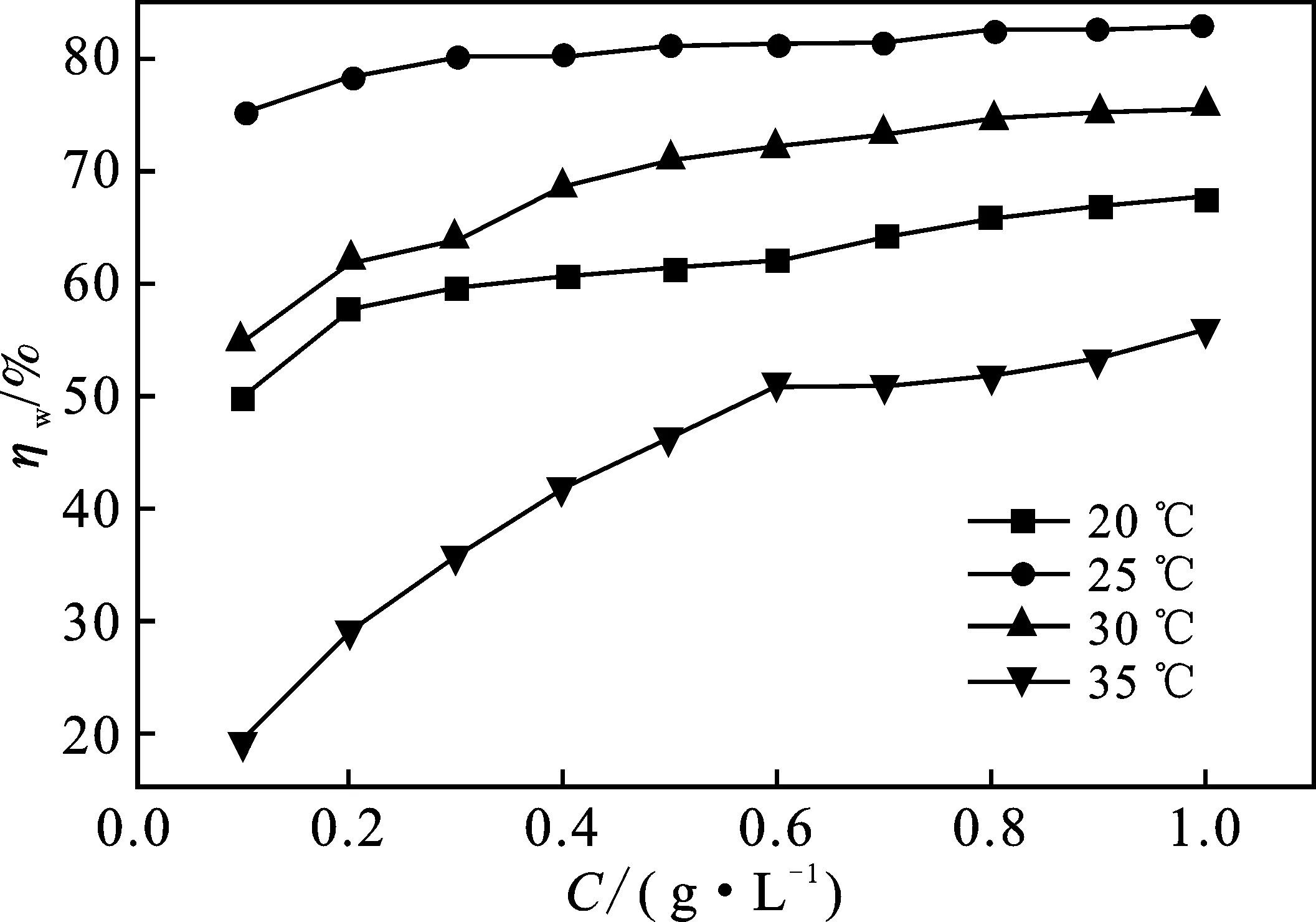
图1 不同温度下1.0 mol/L HCl溶液中缓蚀率(ηw)随SLS浓度(c)变化关系Fig.1 Corrosion inhibition rate (ηw) varies with SLS concentration (c) in 1.0 mol/L HCl solution at different temperature conditions
由图1可知,缓蚀率(ηw)随着SLS浓度的增加而升高,表明SLS对铝在HCl中具有良好的腐蚀抑制作用。当SLS添加量低于0.3 g/L时,缓蚀率(ηw)增长幅度较为明显;但在0.3~0.7 g/L范围内缓蚀率(ηw)增长幅度变小,说明SLS在铝表面的吸附在较低浓度时吸附量随浓度用量增加而急剧上升,但超过0.7 g/L后吸附量逐渐趋于饱和,故0.7 g/L 可以看作是SLS的临界浓度。当温度升高至25 ℃时,缓蚀率高达83.0%,但如果温度继续上升,SLS对铝在腐蚀抑制作用则随着温度的升高而急剧下降。原因可能是温度升高加快了酸与铝表面的接触频率,使铝片发生析氢腐蚀而产生大量气泡(H2),吸附在铝片表面的SLS分子受气泡影响而脱落,SLS分子难以继续吸附在铝表面,从而造成腐蚀加剧,缓蚀性能降低[18]。
采用失重法数据对几种吸附等温方程式进行拟合分析,结果表明1.0 mol/L HCl溶液中SLS在铝表面的吸附服从Langmuir吸附等温方程:
(4)
式中c——缓蚀剂浓度,g/L;
K——SLS在铝表面的吸附平衡常数,L/g,表征吸附性能强弱程度;
θ——表面覆盖度,其值可近似用缓蚀率代替[19]。
图2为1.0 mol/L HCl溶液中c/θ-c拟合直线图。不同温度条件下,c/θ与缓蚀剂SLS质量浓度(c)存在良好的线性关系,线性相关系数(r2)≈1,表明SLS在铝片表面的吸附方式服从Langmuir吸附等温方程[19],斜率又有所偏离1,说明吸附在铝表面的SLS分子间存在相互作用力。

图2 1.0 mol/L HCl溶液中c/θ-c拟合直线Fig.2 c/θ-c Fitting straight line in 1.0 mol/L HCl solution

表1 1.0 mol/L HCl溶液中c/θ-c线性回归参数Table 1 c/θ-c Linear regression parameters and standard free energy of adsorption in 1.0 mol/L HCl
SLS在铝/溶液界面的吸附过程主要是缓蚀体系中SLS分子取代已吸附在铝表面水分子的过程,这种程度用吸附平衡常数(K)表示。K值越大,说明SLS分子在铝表面的吸附程度越高,即水分子吸附在铝表面的程度越小,铝表面受酸腐蚀程度降低。K在各温度条件下的排序:25 ℃>30 ℃>20 ℃>35 ℃,表明SLS的吸附性能在25 ℃条件下最强。表1列出了1.0 mol/L HCl溶液中c/θ-c线性回归参数。
采用式(5)计算标准吸附Gibbs自由能(ΔG0)[20]:
(5)
式中 R——气体常数;
c溶剂——溶剂质量浓度,g/L,取近似值1 000 g/L[21];
T——热力学温度,K。
通过式(5)可计算出不同温度条件下的ΔG0值。由表1可知,在20~35 ℃条件下,ΔG0绝对值处于20 ~ 28 kJ/mol,表明SLS在铝表面具有较强的吸附能力,且吸附方式为以物理吸附为主的混合吸附[22-25]。
2.2 电化学法测试SLS对铝在HCl中的缓蚀及吸附行为
2.2.1 动电位极化曲线 图3是铝电极在25 ℃时未添加和添加不同浓度(0.1,0.5,1.0 g/L)的SLS在1.0 mol/L HCl溶液中的电位动力学极化曲线图。
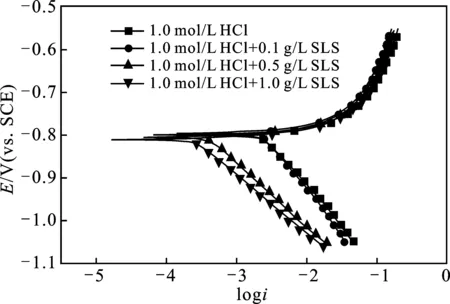
图3 25 ℃条件下铝在1.0 mol/L HCl溶液中不含和含不同浓度SLS的Tafel曲线Fig.3 Tafel curve for aluminum in 1.0 mol/L HCl solution without and with different concentrations of SLS at 25 ℃
由图3可知,在HCl溶液中加入SLS后,腐蚀电位(Ecorr)绝对值处于870 mV附近,没有明显变化,阴极区域腐蚀电流密度(icorr)向负方向移动,但阳极区域腐蚀电流密(icorr)变化不明显。不同浓度条件下的阴极极化曲线相互平行,说明铝电极表面发生的析氢反应过程由活化控制,并且添加SLS后并未改变铝的腐蚀机理。添加SLS后对阳极极化曲线基本无影响,表明SLS在1.0 mol/L HCl介质中为抑制阴极型缓蚀剂。
表2列出了腐蚀电位(Ecorr)、腐蚀电流密度(icorr)、阴极Tafel斜率(bc)等参数[26]。在空白溶液(1.0 mol/L HCl)中,icorr高达5 753 μA/cm2,但添加1.0 g/L SLS后,icorr急剧降至834 μA/cm2,此时缓蚀率高达91%。明显看出在HCl溶液中加入SLS后腐蚀电流密度(icorr)显著降低,表明在HCl溶液中SLS对铝具备优越的腐蚀抑制性能,并且这种缓蚀性能会随着SLS浓度的增加而呈上升趋势。

表2 25 ℃条件下铝电极在1.0 mol/L HCl溶液及添加不同浓度梯度SLS的Tafel曲线参数Table 2 Tafel curves parameters for aluminum in 1.0 mol/L HCl solutions without and with different concentrations of SLS at 25 ℃
2.2.2 电化学阻抗谱(EIS) 图4为25 ℃条件下1.0 mol/L HCl溶液中不添加和添加一定浓度SLS的铝电极的Nyquist图。图中直观描述了添加SLS并未改变Nyquist图谱形状,Nyquist图在添加SLS前后均呈现由高频区容抗弧和低频区感抗弧组成的椭圆形状,这与李向红教授课题组前期报道的结果相符[27]。空白溶液和添加SLS后的EIS图谱形状一致,故铝在HCl溶液中添加SLS并未改变腐蚀电化学机理。

图4 25 ℃时添加不同浓度SLS的1 mol/L HCl介质对铝的EISFig.4 Electrochemical impedance spectroscopy of aluminum in different concentrations of SLS in 1.0 mol/L HCl at 25 ℃
图4为高频区容抗弧与低频区感抗弧构成的近乎完整的椭圆形。电荷转移电阻(Rt)和铝电极界面电容组成阻容弛豫过程是形成高频区容抗弧的原因。由于腐蚀抑制体系中铝电极表面粗糙度不均匀形成“频率弥散效应”[28],致使容抗弧形成椭圆形状的半圆。形成感抗弧的原因可能是铝电极表面的Al2O3溶解[29],也有可能跟HCl溶液中的H+[30]、Cl-[31]、缓蚀剂等[32]在铝电极表面的吸附脱附过程存在密切联系。
添加SLS后,容抗弧和感抗弧的半径均随SLS的质量浓度增加而增大,表明SLS对铝在HCl溶液中起到良好的缓蚀作用。图5为电化学阻抗谱(EIS)数值拟合得到的等效电路图,图中Rs为溶液电阻、Rt为电荷转移电阻、RL为电感电阻、CPE为常相位角元件、L为电感值。通过式(6)计算缓蚀率(ηR)[33]:
(6)
式中,Rt(0)、Rt(inh)为铝在不含和含SLS的1.0 mol/L HCl溶液中的电荷转移电阻,Ω·cm2。
数据处理结果见表3。
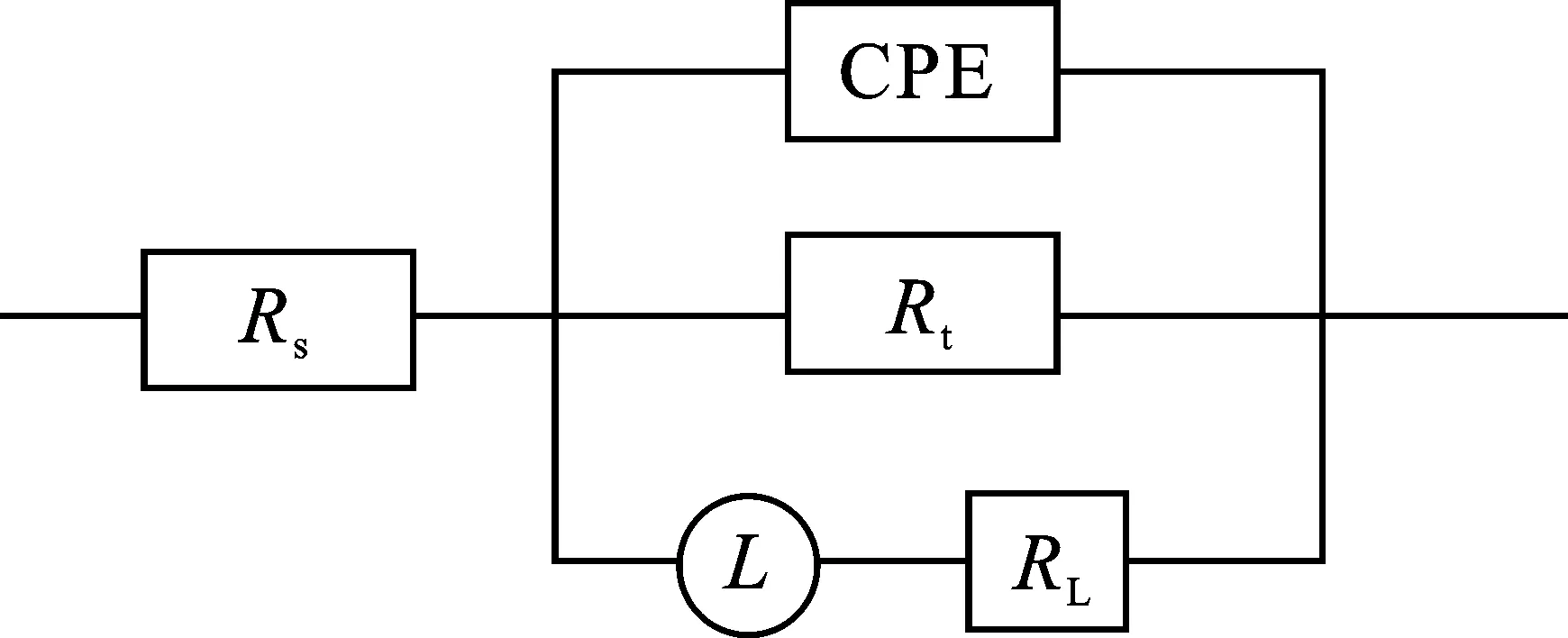
图5 拟合电化学阻抗谱形成的等效电路图Fig.5 Equivalent circuit diagram formed by fitting EIS
由表3可知,空白HCl溶液电阻(Rs)数值极小(仅为1.8 Ω·cm2),这表明HCl溶液导电性能优良,溶液电阻可以忽略不计。电荷转移电阻(Rt)在未添加SLS的HCl溶液中仅为13.87 Ω·cm2,但加入SLS后其值明显变大,并且随SLS质量浓度的增加而增大,表明SLS对铝在HCl中起到良好的缓蚀作用。由于缓蚀体系中的铝电极/溶液界面存在频率弥散效应,故缓蚀体系中添加或不添加SLS,弥散效应系数(n)均<1。在空白溶液(1.0 mol/L HCl)中,电感值(L)为8.02 H·cm2,但加入SLS后电感值(L)明显增大,当SLS添加量为1.0 g/L时,电感值(L)甚至高达27.03 H·cm2,表明在空白溶液(1.0 mol/L HCl)中引起电感效应的电极表面中间吸附产物主要是H3O+、Cl-,而在缓蚀体系中引起电感效应的电极表面中间吸附产物主要是缓蚀剂分子[34],有力证明SLS在铝电极表面发生吸附。
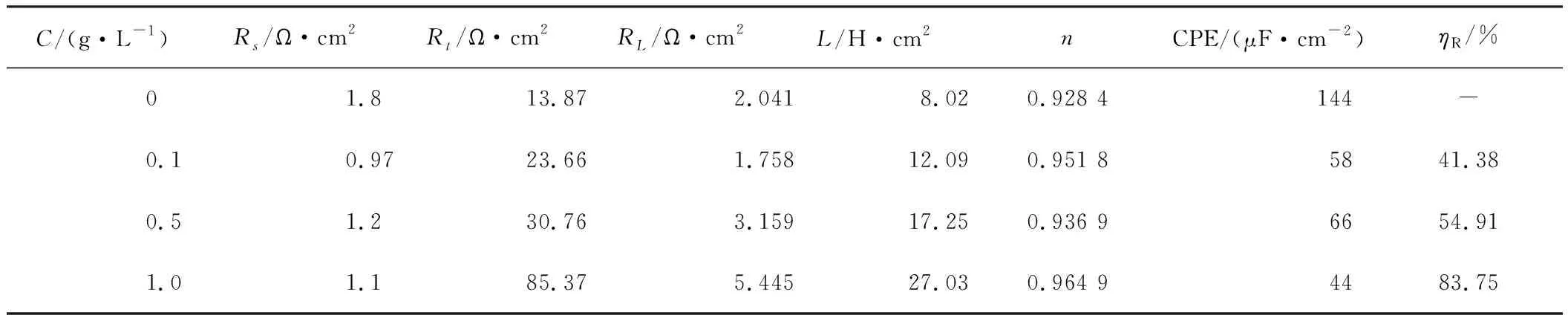
表3 25 ℃ 铝电极在1.0 mol/L HCl溶液中未添加和添加不同浓度SLS的EIS参数Table 3 EIS data of aluminum in 1.0 mol/L HCl solution without and with different concentrations of SLS at 25 ℃
2.3 表面分析测试SLS对铝在HCl中的缓蚀及吸附行为
2.3.1 铝的SEM图像 图6a是使用180#、600#、1200#耐水砂纸逐级打磨处理后的铝片表面,明显看到砂纸打磨留下的痕迹。由图6b可知,铝片在空白溶液中腐蚀2 h后,铝片表面遭受严重腐蚀,并且留下凹凸不平的腐蚀孔隙。在1.0 mol/L HCl溶液中加入1.0 g/L SLS后,铝表面变得相对平整且光滑,见图6c,可以看到铝表面受腐蚀留下的坑孔不明显,表明添加SLS很好地抑制了铝在HCl溶液中的腐蚀。

图6 铝表面的SEM微观形貌Fig.6 SEM micro-morphology of aluminum surfacesa.浸泡前;b.25 ℃条件下1.0 mol/L HCl溶液中腐蚀浸泡2 h;c.25 ℃条件下1.0 mol/L HCl溶液中添加1.0 g/L SLS腐蚀浸泡2 h
2.3.2 铝的AFM图像 AFM测试不仅能给出高分辨率的三维微观形貌,而且能给出表面粗糙度的定量化数值[35-36]。图7为铝表面的高分辨率3D-AFM微观形貌。
由图7a可知,经打磨处理后的铝表面光滑平整,砂纸打磨留下的条痕清晰可见;图7b是铝片在1.0 mol/L HCl中腐蚀6 h后的微观形貌,铝表面腐蚀严重,粗糙不平的坑孔清晰可见。由图7c可知,铝片在缓蚀体系(SLS浓度为1.0 g/L)中浸泡6 h后,铝片表面相对光滑平整,腐蚀坑孔明显减少,被腐蚀程度显著降低。表4列出了铝表面AFM微观形貌的表面粗糙度参数,其中Ra表示平均表面粗糙度、Rq表示均方根表面粗糙度、Rmax表示最大起伏程度。

图7 铝表面的3D-AFM微观形貌Fig.7 3D-AFM micro-morphology of aluminum surfacesa.浸泡前;b.25 ℃条件下1.0 mol/L HCl溶液中腐蚀浸泡6 h;c.25 ℃条件下1.0 mol/L HCl溶液中添加1.0 g/L SLS腐蚀浸泡6 h
由表4可知,浸泡前铝表面的Ra、Rq和Rmax数值最小,故表面最为平整;但在1.0 mol/L HCl溶液中腐蚀浸泡2 h后粗糙程度急剧增大,这主要是由于表面被酸介质严重腐蚀所致;而当添加缓蚀剂SLS后,缓蚀剂分子在铝表面形成保护吸附膜层,故表面粗糙度显著下降。

表4 铝表面的AFM微观形貌表面粗糙度参数Table 4 Surface rough parameters of AFM micrographs of aluminium surfaces
2.4 腐蚀及缓蚀作用机理

Al + H+←→ (AlH+)ads
(7)
(AlH+)ads+ e-←→ (AlH)ads
(8)
(AlH)ads+ H++ e-←→Al + H2↑
(9)

Al +Cl-←→ (AlCl-)ads
(10)
(11)
(12)
SLS在盐酸溶液中表现出良好的缓蚀性能,这与其在铝表面的吸附形成缓蚀膜层有关,图8为SLS在铝表面的吸附示意图。SLS为在水溶液中发生电离:

(13)
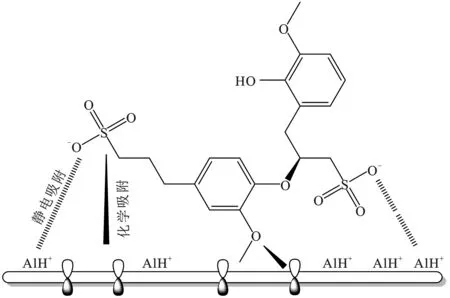
图8 铝片在1 mol/L HCl溶液中的吸附示意图Fig.8 Schematic diagram of adsorption of aluminum sheet in 1.0 mol/L HCl solution

3 结论
(1)阴离子表面活性剂SLS在HCl介质中对铝具有良好的缓蚀性能,缓蚀率随着SLS浓度的增大而呈上升趋势。当温度为25 ℃时,缓蚀率高达83.0%,但随着温度的升高,腐蚀抑制作用则呈下降趋势。
(2)HCl介质中SLS在铝表面的吸附行为服从Langmuir吸附等温方程,并且吸附平衡常数在各温度条件下的排序为:25 ℃>30 ℃>20 ℃>35 ℃,标准吸附Gibbs自由能(ΔG0)绝对值处于20 ~ 28 kJ/mol。 SLS在铝表面具有较强的吸附能力,且吸附方式为混合吸附。
(3)HCl介质中SLS对铝腐蚀的阴极反应产生了明显抑制作用,对阳极反应基本无抑制作用,为阴极型缓蚀剂。Nyquist图谱在高频区域现弥散容抗弧,在低频区域呈感抗弧。添加SLS后电荷转移电阻和电感值均显著增大,而常相位角元件值明显降低。
(4)SEM和AFM表明在盐酸介质中加入SLS后,铝表面腐蚀程度显著降低,且表面粗糙度参数下降。

