微小RNA-29a在膝骨关节炎兔子中的表达及其对干细胞生长因子β、血管内皮生长因子表达和炎症反应的影响
李 冕 刘宣毅 董朝军 东 彬
(河北省沧州市人民医院骨4科,沧州市 061000,电子邮箱:13463476668@qq.com)
膝关节作为人体主要的负重关节,会因日常工作、生活而受到损伤,出现慢性损伤性病变,进而发展为膝骨关节炎(knee osteoarthritis,KOA)。KOA是临床上常见的关节疾病,主要以膝关节局部肿胀及关节疼痛为主要临床表现。研究显示,2018年我国KOA患病率为18%,其中女性患病率明显高于男性[1]。除了高患病率,KOA还具有高致残率、反复发作以及难以痊愈等临床特点,如不及时给予有效的治疗措施,患者极大可能会出现行走困难、瘫痪等后遗症,日常生活质量受到严重影响[2]。因此,明确KOA的发病机制从而给予针对性的干预,具有重要的意义。有研究显示,各种细胞因子介导的炎症反应与KOA的发生、发展有密切关系[3-4],而微小RNA(microRNA,miRNA)-29a及血管内皮生长因子(vascular endothelial growth factor,VEGF)也与KOA发病相关,两者在KOA患者滑膜和关节液中的水平呈负相关[5]。还有研究表明,KOA患者的疼痛和残疾程度与血清干细胞生长因子β(stem cell growth factor β,SCGF-β)表达显著相关[6]。本研究分析KOA模型兔的miRNA-29a表达水平及其对SCGF-β、VEGF的表达水平及炎症反应的影响,旨在为今后相关研究提供数据支持。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:4月龄无特定病原体级新西兰兔48只,雌雄各半,体重(2 500.0±50.0)g,均购自河北医科大学实验动物中心[许可证号:SYXK(冀)2008-0026],饲养条件为雌雄分笼饲养,温度20℃~25℃,湿度维持在45%~65%之间,饲养过程中保证充足的饲料、饮水,每天清理排泄物。本研究通过了动物伦理委员会批准,符合伦理要求。
1.1.2 实验试剂:抗SCGF-β抗体和抗VEGF抗体购自上海研盟生物科技有限公司(批号:bs-0522r、98168127),磷酸缓冲盐溶液(phosphate buffered saline,PBS)和末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling,TUNEL)试剂盒均购自南京凯基生物科技发展有限公司(批号:10010-023、11684817910),miRNA-29a模拟物、miRNA-29a阴性对照物和miRNA-29a抑制物均购自上海吉玛生物公司(批号:2020002、2020005、2020008),RPMI-1640细胞培养基、胎牛血清购自美国Gibco公司(批号:FBS00219-1、nUC0153);总RNA提取试剂盒、miRNA反转录试剂盒和miRNA定量检测试剂盒均购自Invitrogen公司(批号:D1981、D1971、218161);SCGF-β和VEGF检测试剂盒购自上海晶抗生物工程有限公司(批号:0708AFC34、DVE00),肿瘤坏死因子(tumor necrosis factor,TNF)-α和C反应蛋白(C-reactive protein,CRP)检测试剂盒购自上海酶联生物科技有限公司(批号:R2856c、310051);miRNA-29a引物由上海达科为生物技术公司合成。
1.1.3 实验仪器:H-600型透射电镜购自日本日立公司,ABI-7500型实时荧光定量检测仪购自美国ABI公司,BX50型光学显微镜购自日本Olympus公司。
1.2 实验方法
1.2.1 KOA模型建立及鉴定:参照文献[7]的造模方法,从雌、雄两个整体中各选取20只兔子用于建立KOA模型,即KOA组(n=40),其余兔子为空白对照组(n=8),建模4周后,进行干预及分组。将KOA组兔子固定于无菌实验台上,保持其后肢伸直,在右侧膝关节处做一4 cm左右的纵向切口,切断内侧副韧带以暴露关节腔,再依次切除内侧半月板及前、后交叉韧带,对切口进行清洗、缝合,用无菌敷料包扎后肢。术后给予兔子右侧后肢肌内注射40万U青霉素进行抗感染治疗,1次/d,连续1周。术后每天驱赶兔子活动30 min,饲养条件为温度20℃~25℃,湿度维持在45%~65%之间,饲养过程中保证充足的饲料、饮水,每天清理排泄物;密切观察兔子的右后肢情况,发现异常情况须及时进行相关处理,例如出现切口红肿等感染情况则要及时清洁伤口。建模4周后观察兔子的活动情况、关节软骨表面变化情况,以及HE染色情况以评估KOA模型是否成功。评估标准为:兔子右肢关节活动明显受限,关节软骨表面可见凹陷,HE染色可见软骨表层有裂隙、软骨细胞层次不清晰、排列无序。
1.2.2 抗SCGF-β抗体、抗VEGF抗体干预:建模4周后,将KOA组兔子按随机数字表法分为非干预组、SCGF-β组、VEGF组和SCGF-β+VEGF组,每组8只,其余8只进行模型鉴定,每组雌雄各半。给予SCGF-β组兔子通过耳静脉注射1 mL 10 μg/mL的抗SCGF-β抗体稀释液+1 mL生理盐水,给予VEGF组兔子通过耳静脉注射1 mL 10 μg/mL的抗VEGF抗体稀释液+1 mL生理盐水,给予SCGF-β+VEGF组兔子通过耳静脉注射1 mL 10 μg/mL 的抗SCGF-β抗体稀释液+1 mL 10 μg/mL的抗VEGF抗体稀释液,空白对照组与非干预组兔子通过耳静脉注射2 mL生理盐水,1次/d,共干预1周,干预1周后检测兔血清炎性指标水平。
1.2.3 KOA软骨细胞的制备:干预1周完成采血后,采用耳静脉空气注射法处死非干预组兔子,以兔子右侧股骨内侧为切口,分层切开组织,打开兔子膝关节腔,观察关节液及关节软骨面情况,并在无菌操作环境中摘取关节软骨,剥离软骨膜与筋膜后,取0.5 mm左右的软骨组织碎块,放入培养瓶内,采用含双抗(青霉素浓度为100 U/mL,链霉素的浓度为0.1 mg/mL)的PBS冲洗组织3次,每次冲洗3 min;加入0.25%胰蛋白酶,37℃恒温下进行消化2 h,再加入0.02%Ⅱ型胶原酶,37℃恒温下进行消化20 h。培养瓶内加入杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM;上海联硕生物科技有限公司,批号:20201223)终止消化反应,用200目滤网对吹打后过滤细胞,收集滤液,室温(25℃)下3 500 r/min离心5 min后去除上清液,加入低糖(1.0 g/L)DMEM培养基重悬,在5% CO2、37℃培养箱中孵育24 h后处理。
1.2.4 细胞转染:取上述制备的KOA软骨细胞接种于六孔板中,细胞接种密度为2×105个/L,用含10%胎牛血清的DMEM在37℃、5%CO2饱和湿度培养箱中进行培养,等细胞融合度达到90%以上时,按照Lipofectamine 2000说明书(上海恪敏生物科技有限公司,批号:20210819)进行转染,随机分为正常组、miRNA-29a模型组(Mimic组)、miRNA-29a阴性对照组(NC组)和miRNA-29a抑制组(Inhibitor组),每组设6个复孔。正常组不予转染。模型组用miRNA-29a模拟物转染至细胞,NC组用miRNA-29a阴性对照物转染至细胞,Inhibitor组将含miRNA-29a反向互补片段的抑制物转染至细胞。将各组质粒与脂质体混合物分别加入已标记的对应孔板中,轻摇使其均匀分布于孔板内;再将细胞孵育6 h后换液,先用PBS清洗3次,保证清洗充分,再用含10%胎牛血清的RPMI-1640培养基在37℃、5%CO2饱和湿度培养箱培养7 d,3 d进行一次换液。
1.2.5 miRNA-29a相对表达水平的检测:干预1周后抽取各组兔子耳静脉血2 mL,3 000 r/min离心10 min后取上清液。利用总RNA提取试剂盒提取各血清样本和各组转染后的细胞中的总RNA,在NanoDrop2000分光光度计(上海如海光电科技有限公司)上定量。取1 μg RNA进行反转录反应,设置反应条件为37℃ 60 min,95℃ 5 min,4℃。配制实时荧光定量PCR反应体系(寡核苷酸0.5 μL、4种dNTP 3 μL、Taq DNA聚合酶1 μL、靶系列DNA和PCR反应缓冲液2.5 μL),用U6作为内参,用定量PCR仪进行miRNA-29a相对表达水平的检测,设置反应条件为95℃ 15 min,94℃ 15 s,55℃ 30 s,70℃ 35 s,40个循环。采用2-ΔΔCt法计算miRNA-29a相对表达水平。miRNA-29a引物序列正义链为5′-GAGTTGACCACAGCACCTC-3′,反义链为5′-GAGACATCGTGGTAGACTTT-3′;U6引物序列正义链为5′-CTCGCTTCGGCAGCACA-3′,反义链为5′-AACGCTTCACGAATTTGCGT-3′。
1.2.6 酶联免疫吸附试验检测血清SCGF-β、VEGF、TNF-α及CRP表达水平:干预1周后抽取各组兔子耳静脉血1.5 mL,3 000 r/min离心10 min后取上清液,采用酶联免疫吸附试验分别检测各组实验兔血清SCGF-β、VEGF、TNF-α和CRP表达水平,实验步骤严格按照试剂盒说明书进行操作。
1.2.7 蛋白免疫印迹法检测转染细胞SCGF-β和VEGF蛋白的相对表达水平:取各组转染后的细胞,利用细胞裂解液(北京百奥莱博科技有限公司,批号:Z808072)裂解细胞,提取细胞总蛋白,使用二喹啉甲酸蛋白定量试剂盒(上海生工生物有限公司,批号C503021)对提取的总蛋白进行定量,按比例加入4×蛋白上样缓冲液,95℃变性5 min,置于-20℃保存备用。设置浓缩胶电压为80 V,分离胶电压为100 V,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转印。取聚偏二氟乙烯膜用TBST洗膜5 min,共3 次,加入含2%牛血清白蛋白的TBS缓冲液配制的封闭液进行封闭,室温摇床孵育2 h。 洗膜后加入一抗(上海恒远生物科技有限公司,批号:A91102205)(1 ∶200)4℃孵育过夜,再加入二抗(上海恒远生物科技有限公司,批号:A91205204)(1 ∶1 000)室温下孵育1 h。将新鲜配制的化学发光试剂液滴加到聚偏二氟乙烯膜表面,转移至成像分析系统暗箱中曝光,采集图像并分析。以GAPDH为内参进行分析,以相对灰度值代表蛋白相对表达量,实验至少重复3次。
1.2.8 实时荧光定量PCR检测转染细胞SCGF-β和VEGF mRNA的相对表达水平:取各组转染后的细胞,用TRIzol法(美国Life technologies公司,批号:15596-303)提取总RNA,按照PCR反转录试剂盒(Invitrogen公司,批号:11752050)说明书进行反转录,设置实时荧光定量PCR反应体系(10×扩增缓冲液2.5 μL,4种dNTP混合物3 μL,引物1 μL,模板DNA 1 μL,Taq DNA聚合酶1 μL,Mg2+1.5 μL,三蒸水30 μL),设置反应条件为95℃ 5 min,95℃ 30 s,55℃ 30 s,72℃ 35 s,共40个循环。采用2-ΔΔCt法计算SCGF-β 和VEGF mRNA的相对表达水平。
1.3 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用t检验,多组间比较用单因素方差分析,两两比较采用LSD-t检验。以P<0.05表示差异具有统计学意义。
2 结 果
2.1 KOA模型鉴定结果 空白对照组兔子膝骨关节活动自如,关节软骨表面均匀光滑,HE染色显示软骨细胞分布均匀、排列整齐。KOA组兔子右肢关节活动明显受限,关节软骨表面可见凹陷,HE染色显示软骨表层有裂隙、软骨细胞层次不清晰、排列无序。见图1。
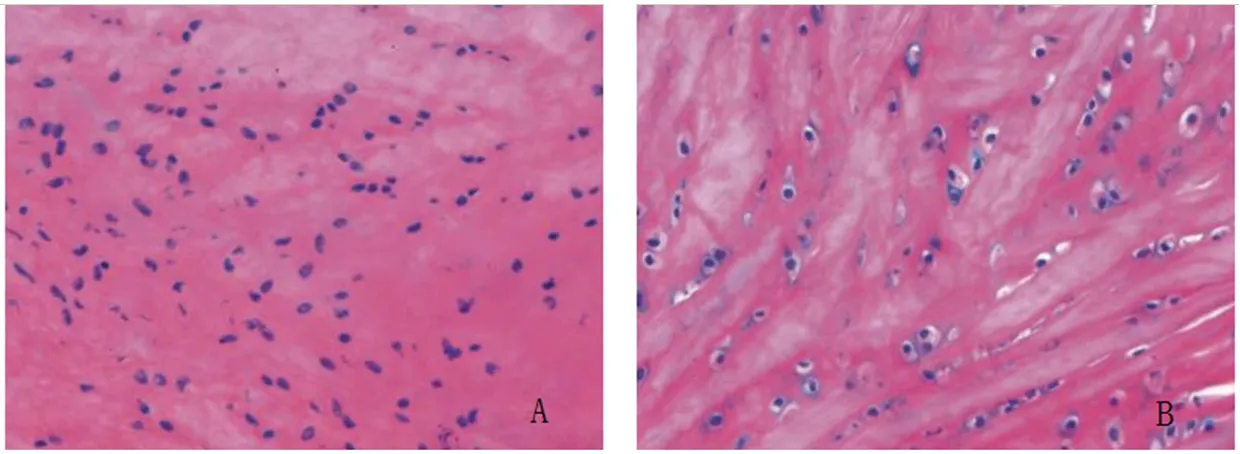
图1 兔子膝骨关节软骨组织(HE染色,×200)
2.2 各组兔子血清指标的比较 5组血清miRNA-29a、SCGF-β、VEGF、TNF-α和CRP表达水平比较,差异均有统计学意义(均P<0.05)。其中,与空白对照组相比,非干预组、SCGF-β组、VEGF组及SCGF-β+VEGF组的血清miRNA-29a相对表达水平均降低,而血清SCGF-β、VEGF、TNF-α和CRP水平均升高(均P<0.05);与非干预组和VEGF组比较,SCGF-β组和SCGF-β+VEGF组血清SCGF-β表达水平均降低;与非干预组和SCGF-β组比较,VEGF组和SCGF-β+VEGF组血清VEGF表达水平均降低;与非干预组比较,SCGF-β组、VEGF组和SCGF-β+VEGF组血清TNF-α和CRP表达水平均降低(P<0.01),且SCGF-β+VEGF组血清TNF-α和CRP表达水平均低于SCGF-β组和VEGF组(均P<0.05)。见表1。

表1 各组兔子血清指标的比较(x±s)
2.3 转染后4组软骨细胞miRNA-29a相对表达水平的比较 4组软骨细胞的miRNA-29a相对表达水平比较,差异有统计学意义(P<0.05)。其中,正常组及NC组miRNA-29a相对表达水平低于Mimic组,高于Inhibitor组;且Inhibitor组miRNA-29a相对表达水平低于Mimic组(均P<0.05)。见表2。

表2 各组软骨细胞miRNA-29a相对表达水平的比较(x±s)
2.4 转染后3组软骨细胞中SCGF-β、VEGF的蛋白及mRMA相对表达水平的比较 4组转染软骨细胞SCGF-β、VEGF的蛋白及mRMA相对表达水平比较,差异均有统计学意义(均P<0.05)。其中,3组转染软骨细胞SCGF-β、VEGF的蛋白及mRMA相对表达水平均为Inhibitor组>NC组>Mimic组(均P<0.05)。见图2、表3。
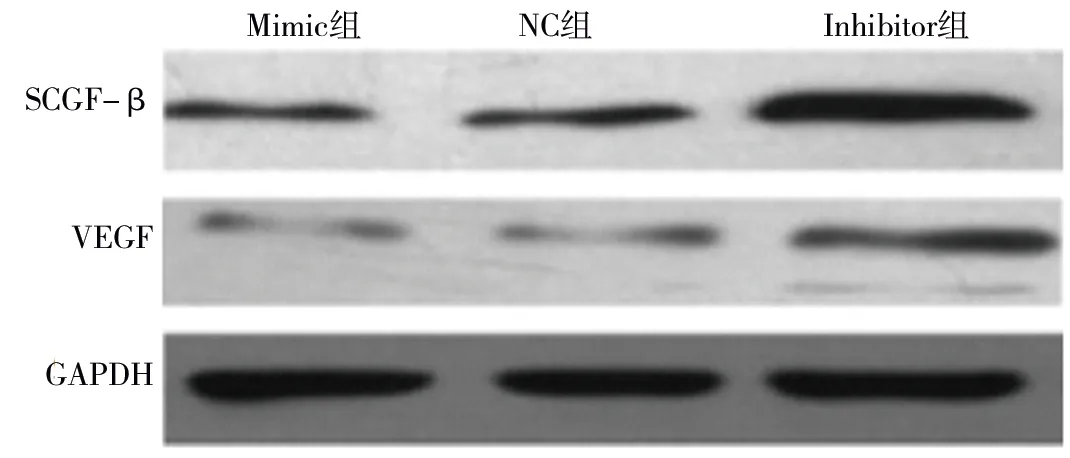
图2 蛋白免疫印迹法检测结果
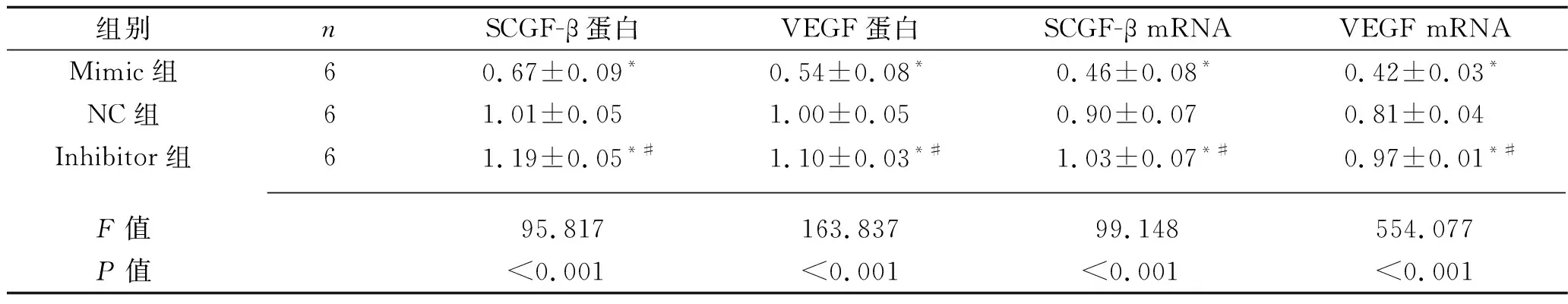
表3 各组软骨细胞中SCGF-β、VEGF的蛋白及mRMA相对表达水平的比较(x±s)
3 讨 论
由于受到伦理道德等因素的限制,往往在人体上不能直接进行实验研究,只能选用理想的动物模型代替。动物模型中对动物的选择直接关乎实验成败,因此,选择实验动物时除了考虑是否容易控制、饲养、费用、伦理等因素,同时也要兼顾动物基因与人类基因的相似性以及疾病发病机制的相似性[8]。KOA模型的建模方法多种多样,通过基因敲除、手术诱发、关节内注射诱发等方法均可得到理想的KOA模型。兔子性格温顺,其膝关节面较鼠类大,关节内操作方便,且关节的大体外观与人相似,可用于实验的组织较多,而且既往研究提示采用前交叉韧带横断法可成功建立KOA模型[9-11]。因此,本次实验研究选用新西兰兔作为实验动物,采用前交叉韧带横断法建立KOA模型。本研究结果显示,KOA组实验兔右肢关节活动明显受限,关节软骨表面可见凹陷处,HE染色显示软骨表层有裂隙、软骨细胞层次不清晰、排列无序,提示KOA模型建模成功。
miRNA广泛分布于机体中,是非编码短链RNA,通过互补靶基因mRNA的3′端非编码区的碱基,使靶基因mRNA降解或翻译受到抑制,从而调控相关靶蛋白的表达,在人体一系列病理生理进展中发挥极其重要的作用[12]。研究表明,多种miRNA在KOA患者中表达异常。例如,血清miRNA-300表达水平随KOA患者X线分级及Kellgren-Lawrence分级的增高而增加,可较好地反映出KOA的严重程度和软骨损伤程度[13];KOA患者滑膜中miRNA-140和miRNA-199的表达水平与KOA进展相关[14];miRNA-140-5p通过调控Toll样受体4/髓样分化因子88/核因子κB信号通路来保护KOA大鼠模型的滑膜[15]。miRNA-29a作为miRNA成员之一,广泛参与甲状腺乳头状癌、肠癌、肝纤维化等多种疾病的病理生理过程[16-18]。此外,miRNA-29可通过抑制信号转导子和转录激活因子3(signal transducer and activator of transcription 3,STAT3)抑制类风湿关节炎成纤维细胞样滑膜细胞的增殖并诱导其凋亡[19],同时可靶向B细胞淋巴瘤-2相关蛋白X以调节骨关节炎软骨细胞凋亡[20]。本研究结果显示,非干预组兔子血清miRNA-29的表达水平明显低于空白对照组(P<0.05),提示miRNA-29表达降低可能是KOA形成的潜在危险因素。
有研究显示,VEGF参与多种关节炎的发生和发展[21-22]。关于SCGF-β表达水平与KOA的关系的研究虽然不多见,但在不稳定无症状颈动脉斑块相关研究中,可在患者斑块内检测到SCGF-β,这提示SCGF-β参与局部和全身炎症[23]。血清TNF-α和CRP水平与炎症的发生密切相关,是衡量机体发生炎症的重要指标。本研究结果显示,非干预组兔子血清SCGF-β、VEGF、TNF-α和CRP的表达水平均高于空白对照组(均P<0.05),即KOA会导致兔子血清SCGF-β、VEGF、TNF-α和CRP的表达水平升高,提示KOA形成的过程中会伴随炎症反应的发生。本研究中,利用抗SCGF-β抗体和抗VEGF抗体治疗KOA模型兔子后,发现SCGF-β组和SCGF-β+VEGF组血清SCGF-β的表达水平低于VEGF组与非干预组,VEGF组和SCGF-β+VEGF组血清VEGF的表达水平低于SCGF-β组与非干预组,而且SCGF-β组、VEGF组和SCGF-β+VEGF组血清TNF-α和CRP的表达水平均低于非干预组,SCGF-β+VEGF组血清TNF-α和CRP的表达水平均低于SCGF-β组与VEGF组(均P<0.05),提示采用这两种抗体中和KOA模型兔子血清中的SCGF-β或VEGF后,可抑制机体炎症反应,且两者联合干预的抗炎效果更佳[24]。为验证miRNA-29a对SCGF-β和VEGF的作用,本研究制备KOA软骨细胞后分别转染miRNA-29a 模拟物与抑制物,观察两者对KOA软骨细胞SCGF-β和VEGF表达的影响。结果显示,上调miRNA-29a的表达(即Mimic组),KOA软骨细胞的SCGF-β、VEGF的蛋白及mRNA表达水平降低;反之,下调miRNA-29a的表达(即Inhibitor组),转染KOA软骨细胞的SCGF-β、VEGF的蛋白及mRNA表达水平升高。表明miRNA-29a对KOA软骨细胞的SCGF-β和VEGF的表达具有反向调控作用,这有助于减轻KOA引起的炎症反应,从而控制病情,但其具体机制还需进一步研究。
综上所述,KOA兔子血清miRNA-29a的表达水平降低,血清SCGF-β、VEGF、TNF-α和CRP的表达水平升高,下调SCGF-β和VEGF表达可抑制KOA兔子体内的炎症反应;上调miRNA-29a表达水平可抑制KOA软骨细胞SCGF-β、VEGF的表达,这有助于减轻KOA引起的炎症反应,从而控制病情。

