3D 打印多孔钽浸提液体外细胞毒性和遗传毒性研究*
蒋 波,张 玲,张 佩,彭 兰,杨 柳,王 旖,曾荣荣
(1. 重庆市食品药品检验检测研究院,重庆 401121; 2. 重庆医药高等专科学校,重庆 401331)
近年来,医用增材制造技术(3D 打印)在医疗领域发展迅速,以3D打印技术制备的各类医用增材,为再生医学领域复杂组织器官的制造带来了希望。以3D 打印制备的多孔钽被认为是目前最理想的骨科植入材料,可根据患者的需求制成个体化植入体,广泛应用于股骨头坏死、关节置换、骨缺损等骨科领域[1]。目前,国内外关于3D 打印多孔钽制备与性能的研究报道较多,但关于其生物相容性评价的资料较少。本研究中参考医疗器械生物学评价国家标准[2-3]及医疗器械行业标准[4-6],采用体外细胞毒性试验、细菌回复突变试验(Ames 试验)、体外哺乳动物细胞染色体畸变试验及体内哺乳动物骨髓细胞微核试验,对3D 打印多孔钽潜在的细胞毒性及遗传毒性进行研究,旨在为探索医用增材类医疗器械的生物安全性提供参考。现报道如下。
1 材料与方法
1.1 材料
仪器:MJ-250F-Ⅲ型微生物培养箱(上海龙跃仪器设备);CB150 型CO2培养箱(德国Binder 公司);CX21FSIC 型显微镜;IX71 型倒置生物显微镜(日本Olympus 公司);Synergy HTX 型多功能酶标仪(美国Biotek公司)。
试剂与样品:大鼠肝脏微粒体酶S9(江苏齐氏生物科技有限公司,批号为19FS063M);2,4,7-三硝基-9-芴酮(美国AccuStandard公司,批号为212111087);叠氮化钠(浙江东阳天宇化工,批号为20000406);丝裂霉素 C(MMC,MYM Biologich Technology,批 号 为SLBD1982V);甲磺酸甲酯(批号为1001800914),2-氨基芴(批号为101393989),秋水仙素(批号为011M1244V),环磷酰胺(CP,批号为1001686731),均购自美国Sigma - Aldrich 公司;吉姆萨染色液(上海乐辰生物科技有限公司,批号为20200528);RPMI 完全1640培养液(批号为20200220)、MTT 细胞增殖及细胞毒性检测试剂盒(批号为20200510),均购自江苏凯基生物技术股份有限公司。多孔钽材料(重庆某材料公司,3D打印方式制备)。
动物:健康SPF级KM 小鼠50只,雌雄各半,体质量20~22 g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证号SCXK(京)2019-0010,实验动物质量合格证号1103242011011279。饲养于重庆市食品药品检验检测研究院药理毒理室屏障系统,实验动物使用许可证号SYXK(渝)2015-0002。动物房室温16~26 ℃,日温差不超过4℃,相对湿度40%~70%,12 h/ 12 h 明暗交替,试验期间动物饲喂全价营养颗粒饲料,灭菌自来水自由饮用。
菌株:鼠伤寒沙门氏菌组氨酸营养缺陷型突变株TA97a(批号为5462D)、TA98(批号为5470D)、TA100(批号为5467D)、TA102(批号为5468D)、TA1535(批号为5469D),均购于美国Moltox 公司,贮存于液氮生物容器内。
细胞株:小鼠成纤维肌细胞L929(批号为20180511),中国仓鼠肺细胞CHL(批号为20200330),均购于中国科学院上海细胞库,贮存于液氮生物容器内。
1.2 方法
样品浸提液制备:取多孔钽适量,称量后121 ℃湿热灭菌30 min,以氯化钠注射液和注射用大豆油分别作为极性和非极性浸提介质[7],在(37±1)℃条件下浸提(72±2)h,制成样品浸提液A 和B(0.2 g/mL)。取多孔钽适量,称量后121 ℃湿热灭菌30 min,以RPMI 完全1640 培养液浸提,在(37 ± 1)℃条件下浸提(24 ± 2)h,制成样品浸提液C(1S-100%),加入3倍量的RPMI完全1640培养液制成样品浸提液C(2S-75%),同法分别制成样品浸提液C(3S-50%)、样品浸提液C(4S-25%)。
体外细胞毒性试验:取传代48~72 h的L929 细胞,用胰蛋白酶-EDTA消化液消化,离心后加入RPMI完全1640培养液重悬细胞悬液,制成细胞密度为1×105mL-1的细胞悬液。取细胞悬液接种于96孔板中(每孔100 μL),于37 ℃条件下CO2培养箱中培养24 h;倒置显微镜下观察细胞状态,确保各孔细胞增长相对相等,吸出培养基,分组,加入样品浸提液C1,C2,C3,C4100 μL,阴性对照组(高密度聚乙烯浸提液)、阳性对照组(10%DMSO)及空白对照组(RPMI 完全1640 培养液),于37 ℃条件下CO2培养箱中培养24 h,倒置显微镜下观察细胞形态;吸出培养基,各孔加入50 μL MTT 溶液,在37 ℃条件下CO2培养箱中孵育4 h,弃去MTT 溶液,各孔加入150 μL DMSO,低速振荡10 min,以酶标仪检测570 nm波长处的吸光度(OD570)值,计算各组细胞存活率(OD570样品/OD570空白× 100%),并按6 级毒性评级标准作毒性级别评定[8]。
体外哺乳动物细胞染色体畸变试验:取CHL 细胞,分别在加或不加S9液条件下试验[5],取样品浸提液C1,C2,C3,C4,分别设为C1组、C2组、C3组、C4组,并设溶剂对照组(RPMI 完全1640 培养液浸提),丝裂霉素C(不加S9 液,终质量浓度0.2 μg/mL)、环磷酰胺(加S9 液,终质量浓度15 μg/mL)分别作为阳性对照1组、2组。正式试验前1 d,取对数生长期CHL细胞,接种于25 cm²细胞培养瓶中(1×106个/瓶),置37 ℃条件下CO2培养箱中培养24 h,确保细胞覆盖程度大于60%。试验时,倾去培养液,磷酸盐缓冲液(PBS)清洗2 次,各组加相应溶液(终浓度1%)及S9液,置培养箱培养4 h,去上清,PBS清洗2 次,加入完全1640 培养液继续培养20 h,加入秋水仙素(终质量浓度1 μg/mL)处理4 h,观察细胞生长状态后收获细胞,低渗、固定、常规制片,染色,镜检;不加S9 液条件,各组加入相应溶液,分别培养4 h 和24 h 后,同法制片。在油镜下每组观察200个分散良好的中期分裂相细胞,记录染色体畸变细胞数和畸变类型,计算细胞畸变率。在加或不加S9液的条件下,若出现C1~C4组与溶剂对照组染色体畸变率差异有统计学意义并呈量效关系,则判定结果为阳性。
Ames试验:取5种试验用菌株,在加或不加S9液条件下试验[4]。设A 组及B 组(样品浸提液A 和B)及溶剂对照1 组、2 组(氯化钠注射液,注射用大豆油),分别以2,4,7-三硝基-9-芴酮(TA97a、TA98菌株不加S9液条件下的阳性物)、甲磺酸甲酯(TA100、TA102 菌株不加S9条件下的阳性物)、叠氮化钠(TA1535菌株不加S9液条件下的阳性物)、2-氨基芴(TA97a、TA98、TA100、TA102 菌株加S9 条件下的阳性物)、CP(TA1535 菌株加S9条件下的阳性物)为阳性对照1组、2组、3组、4组、5 组,同时设置空白对照组。采用平板掺入法,在保温的顶层琼脂试管中依次加入0.5 mL 10% S9 液或PBS(不加S9 液条件),0.1 mL 样品浸提液A,B 0.1 mL 预先振荡培养的各菌株增菌液;溶剂对照组加入0.1 mL 相应浸提介质,阳性对照1 组、2 组、3 组、4 组、5 组分别加入0.1 mL 相应阳性对照物(每皿分别含0.5,5.0,0.5,50.0,200.0 μg),空白对照组仅加菌液,其余操作同样品组。每组做3 管平行样,混匀后迅速将各管中溶液倾倒在底层琼脂上,转动平皿使混合液均匀分布于底层琼脂,平放固化后倒置于37 ℃条件下CO2培养箱中培养48 h,计数每皿回变菌落数,并计算平均值和标准差。试验重复2 次,在加或不加S9 液的条件下,若A组、B组有1个或多个菌株的回变菌落数是溶剂对照组的2倍或2倍以上并有可重复性,则判定结果为阳性。
体内哺乳动物骨髓细胞微核试验:将50只KM小鼠先按体质量随机分为5组,各10只,雌雄各半。设A组及B组(样品浸提液A和B)组,溶剂对照1组、2组(同Ames试验)和阳性对照组(环磷酰胺50 mg/kg)。各组小鼠腹腔注射相应药物20 mL/kg,间隔24 h给药1次,第2次给药后6 h 脱颈处死小鼠,取股骨骨髓涂于事先加有1 滴小牛血清的玻片上,混匀推片,自然晾干,甲醇固定后染色观察。油镜下观察每只小鼠2 000 个嗜多染红细胞(PCE),记录含微核细胞数。同时观察200个PCE计数中见到的正染红细胞(NCE)数,计算PCE/(NCE+PCE)。溶剂对照组的微核率应<5‰,A组及B组与溶剂对照组比较,微核率有显著升高时判定结果为阳性。
1.3 统计学处理
采用SPSS 19.0 统计学软件分析。计量资料以±s表示,行t检验;计数资料以率(%)表示,行χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 体外细胞毒性试验
L929 细胞接触浸样品浸提液C1~C424 h 后,胞浆内有离散颗粒,无细胞溶解,与空白对照组细胞形态无差异。样品浸提液C1~C4接触后细胞存活率均大于75%,毒性评级均为1级,无潜在细胞毒性。详见表1。
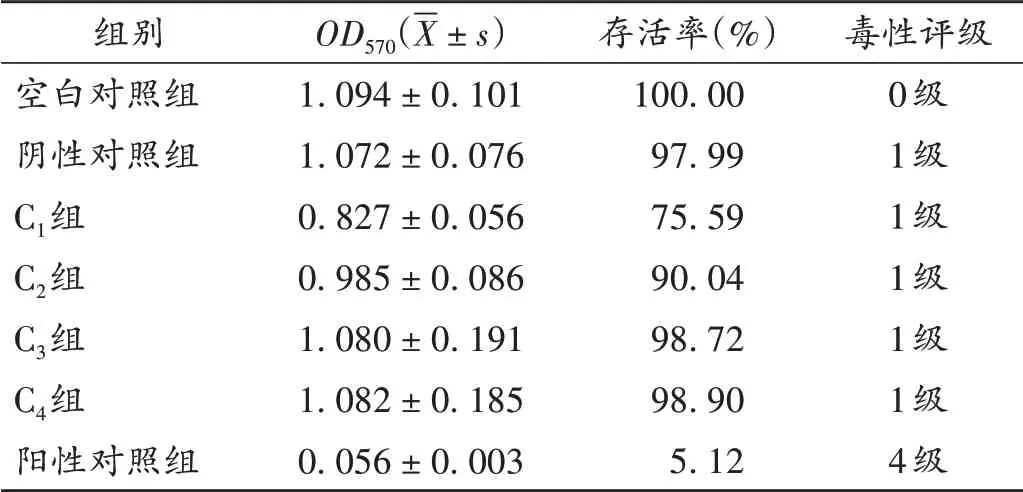
表1 细胞毒性试验结果(n=6)Tab.1 Results of the cytotoxicity test(n=6)
2.2 体外哺乳动物细胞染色体畸变试验
不加S9 液条件下,除阳性对照1 组4 h 畸变率为16%外,其余各组均为0;加S9 液条件下,除阳性对照2 组4 h畸变率为17%外,其余各组均为0。详见表2。

表2 CHL细胞染色体畸变试验结果Tab.2 Results of the chromosome aberration test of CHL cells
2.3 Ames 试验
在加或不加S9液条件下,空白对照组5种菌株回变菌落数符合文献[9]及相关标准数据[4],溶剂对照1 组、2 组回变菌落数与空白对照组相当,各阳性对照组回变菌落数显著多于溶剂对照组(P<0.01),显示出强烈的诱变作用,表明该试验系统符合要求。在加和不加S9液条件下,A 组、B 组与相应溶剂对照组比较无显著差异(P>0.05),两次试验结果一致,表明2种样品浸提液无抑菌作用,无诱发细菌回复突变性。详见表3。
表3 Ames试验菌株回变菌落数(±s,个,n=3)Tab.3 Number of revertant colonies of strains in the Ames tests(±s,n=3)
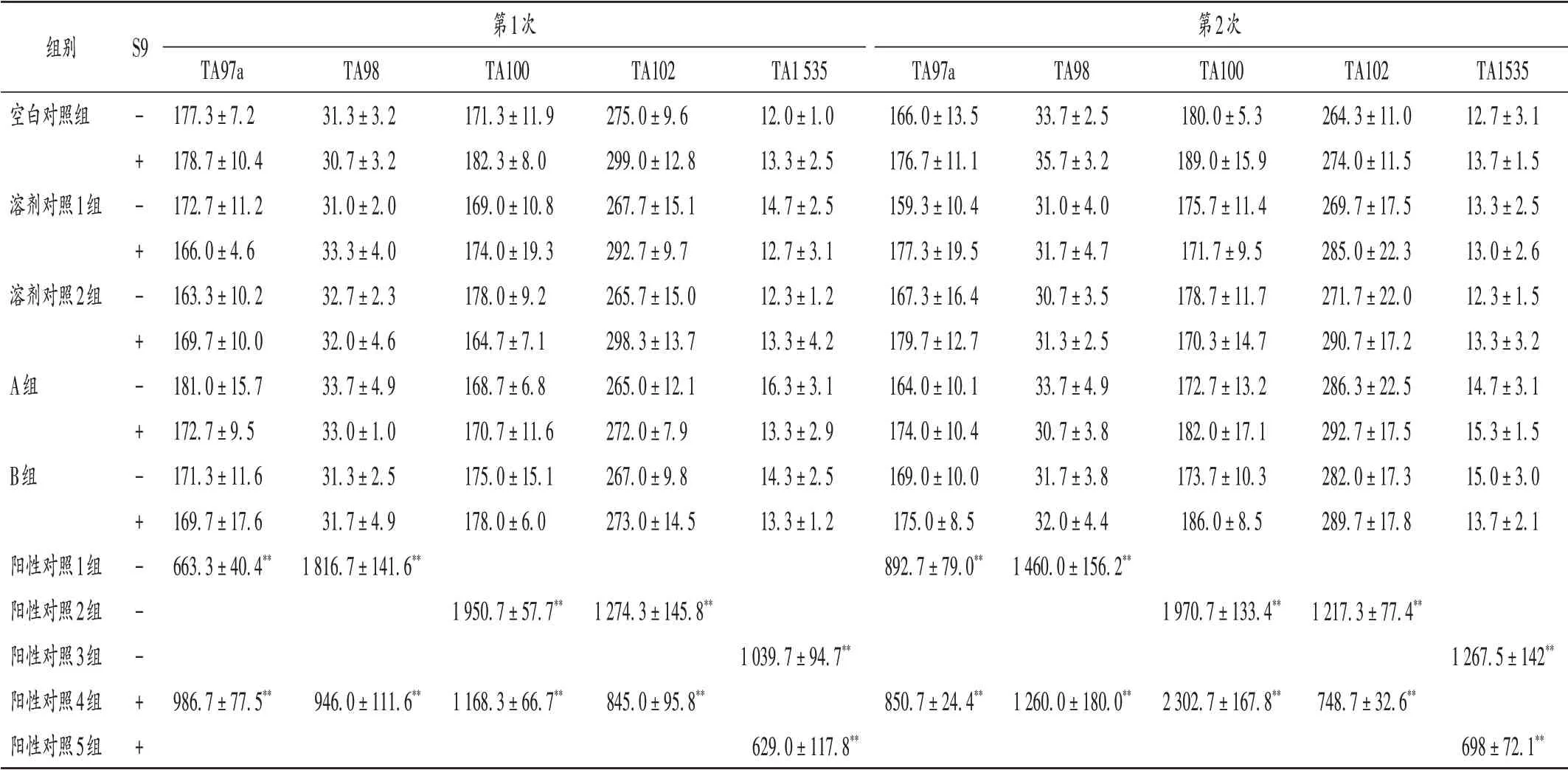
表3 Ames试验菌株回变菌落数(±s,个,n=3)Tab.3 Number of revertant colonies of strains in the Ames tests(±s,n=3)
组别空白对照组溶剂对照1组溶剂对照2组A组B组阳性对照1组阳性对照2组阳性对照3组阳性对照4组阳性对照5组S9-+ - + - + - + - + - - - + +第1次TA97a 177.3±7.2 178.7±10.4 172.7±11.2 166.0±4.6 163.3±10.2 169.7±10.0 181.0±15.7 172.7±9.5 171.3±11.6 169.7±17.6 663.3±40.4**986.7±77.5**TA98 31.3±3.2 30.7±3.2 31.0±2.0 33.3±4.0 32.7±2.3 32.0±4.6 33.7±4.9 33.0±1.0 31.3±2.5 31.7±4.9 1 816.7±141.6**946.0±111.6**TA100 171.3±11.9 182.3±8.0 169.0±10.8 174.0±19.3 178.0±9.2 164.7±7.1 168.7±6.8 170.7±11.6 175.0±15.1 178.0±6.0 1 950.7±57.7**1 168.3±66.7**TA102 275.0±9.6 299.0±12.8 267.7±15.1 292.7±9.7 265.7±15.0 298.3±13.7 265.0±12.1 272.0±7.9 267.0±9.8 273.0±14.5 1 274.3±145.8**845.0±95.8**TA1 535 12.0±1.0 13.3±2.5 14.7±2.5 12.7±3.1 12.3±1.2 13.3±4.2 16.3±3.1 13.3±2.9 14.3±2.5 13.3±1.2 1 039.7±94.7**629.0±117.8**第2次TA97a 166.0±13.5 176.7±11.1 159.3±10.4 177.3±19.5 167.3±16.4 179.7±12.7 164.0±10.1 174.0±10.4 169.0±10.0 175.0±8.5 892.7±79.0**850.7±24.4**TA98 33.7±2.5 35.7±3.2 31.0±4.0 31.7±4.7 30.7±3.5 31.3±2.5 33.7±4.9 30.7±3.8 31.7±3.8 32.0±4.4 1 460.0±156.2**1 260.0±180.0**TA100 180.0±5.3 189.0±15.9 175.7±11.4 171.7±9.5 178.7±11.7 170.3±14.7 172.7±13.2 182.0±17.1 173.7±10.3 186.0±8.5 1 970.7±133.4**2 302.7±167.8**TA102 264.3±11.0 274.0±11.5 269.7±17.5 285.0±22.3 271.7±22.0 290.7±17.2 286.3±22.5 292.7±17.5 282.0±17.3 289.7±17.8 1 217.3±77.4**748.7±32.6**TA1535 12.7±3.1 13.7±1.5 13.3±2.5 13.0±2.6 12.3±1.5 13.3±3.2 14.7±3.1 15.3±1.5 15.0±3.0 13.7±2.1 1 267.5±142**698±72.1**
2.4 体内哺乳动物骨髓细胞微核试验
与溶剂对照组比较,阳性对照组小鼠PCE 中微核明显增多,微核率显著升高(P< 0.01),A 组、B 组小鼠PCE微核率与相应溶剂对照组比较无明显差异(P>0.05)。详见表4。
表4 小鼠骨髓微核试验结果(±s,n=20 000)Tab.4 Results of the bone marrow micronucleus test in mice(±s,n=20 000)

表4 小鼠骨髓微核试验结果(±s,n=20 000)Tab.4 Results of the bone marrow micronucleus test in mice(±s,n=20 000)
组别溶剂对照1组溶剂对照2组A组B组阳性对照组微核数45 39 41 36 381微核率(‰)2.25±0.59 2.05±0.90 1.95±0.69 1.80±0.63 19.05±2.73**PCE/(NCE +PCE)0.55±0.06 0.53±0.09 0.52±0.06 0.57±0.07 0.50±0.06
3 讨论
医用增材多以植入体内的方式应用于临床,故探讨医用增材类医疗器械原料和成品的生物安全性具有重要意义,为确保医用增材在临床应用时的安全性,在完成理化性能、加工性能及外形等有效性测试后,必须对成型材料进行生物相容性评价[10]。体外细胞毒性试验是安全性评价的一项基本内容,可用于初步了解医疗器械产品的安全性。遗传毒性研究是生物安全性评价的重要内容,与致癌性、生殖毒性等其他毒理学研究密切相关[11],试验方法根据检测的遗传学终点可分为基因突变、染色体畸变和DNA 损伤3 大类,根据试验系统又可分为体外试验和体内试验,目前尚无一种遗传毒性试验方法能检测出所有类别的遗传毒性机制,因此在实践中常组合采用多种方法,以相互补充,全面评估受试样品的遗传毒性风险[12]。
与普通化学物质的遗传毒理学研究不同,医疗器械多采用样品浸提液进行试验,当浸提液未表现出明显的体内体外毒性时,在进行遗传毒性试验时可选择单一剂量(即100%样品浸提液)进行研究[13-14]。故本研究中首先进行体外细胞毒性试验,以3D 打印多孔钽浸提液及稀释液与L929 细胞直接接触,结果表明,100%样品浸提液及稀释液均不具有细胞毒性。其后的遗传毒性研究中组合使用Ames 试验、染色体畸变试验、微核试验,从基因水平、染色体水平、动物体内水平3个层面对3D打印多孔钽进行了致突变作用研究,并在进行体外哺乳动物细胞染色体畸变试验时选择同细胞毒性试验相同的剂量。同时,由于浸提样品所使用的含血清细胞培养液兼具极性和非极性介质的特性,细胞毒性结果提示,由单一惰性金属材料钽制成的医疗器械,其极性和非极性浸提介质条件下均具有低毒性,故在Ames试验和微核试验中2种浸提介质条件下,样品浸提液组均仅使用100%样品浸提液。
本研究结果表明,根据体外细胞毒性试验结果评估医用增材的毒性,可为某些体外遗传毒性试验剂量设计提供参考。但由于本研究的对象是由惰性较强的钽材料制成,样品未体现出显著的细胞毒性,这种试验设计思路还需后续更深入研究,可选用一系列具有明确细胞毒性的样品,根据细胞毒性的结果设计遗传毒性的剂量,从中探明样品细胞毒性与遗传毒性的关联性,从而建立起一套体外细胞毒性与遗传毒性综合的生物学评价标准。
综上所述,不同浓度3D 打印多孔钽浸提液均无细胞毒性,3 种遗传毒性试验(Ames 试验、染色体畸变试验、微核试验)结果均为致突变阴性,表明3D 打印多孔钽无遗传毒性。该细胞毒性试验结合遗传毒性试验的评价体系可供建立医用增材生物学评价方法参考。

