药品中需氧菌总数计数能力验证结果分析
张煜琳,李哲,王建声,杜彦辉
1.庆阳市药品检验检测中心,甘肃 庆阳 745000;2.庆阳市食品检验检测中心,甘肃 庆阳 745000
药品检验检测能力验证是药品质量技术监管的重要手段,推动实施药品检验检测技术能力持续有效提升,更加体现权威性、可靠性、公正性,是药品检验检测工作高质量发展的永恒课题。本实验组人员参加了2021 年由上海市食品药品检验研究院负责实施的“NIFDC-PT-340 药品中需氧菌总数计数能力验证”,按照预先制定的实验方案和作业指导书,对3 份未知样品进行检测,结果为满意。本研究以此为契机,准确考量影响实验结果的人员、试剂、设施、环境等关键因素,全面回顾梳理实验过程,对比分析全国实验室数据,重点总结本次实验结果,为健全完善微生物检验内部质量控制管理体系[1-3]提供理论和实践参考。
1 实验材料与试剂
1.1 样品
样品来源于上海市食品药品检验研究院,编号QA03400502、QA03400327、QA03400657,为药品制剂的冷冻干燥物,采用玻璃西林瓶密封包装,瓶身贴有编号标识。收到样品后立即放置-20 ℃保存,并尽快检测。
1.2 培养基及耗材
胰酪大豆胨液体培养基,批号:20210412,海博生物;红四氮唑(TTC),批号:20171101,天津大茂;一次性无菌培养皿,广东环凯,规格:90 mm×15 mm;实验用水均为无菌用水。
1.3 仪器设备
超净工作台(上海树立)型号:SW-CJ-2D,生物安全柜(苏州安泰)型号:BHC-1300IIA2,立式压力灭菌器(山东新华)型号:LMQ.C-80E,电热恒温培养箱(上海博讯)型号:HPX-9162MBE。
2 实验方法
2.1 检测方法
按照《中国药典》2020 版四部通则1105 非无菌产品微生物限度检查:微生物计数法中需氧菌总数计数平皿法[4]和NIFDC-PT-340 药品中需氧菌总数计数能力验证作业指导书的要求进行检测。
2.2 操作步骤
2.2.1 样品前处理 首先将样品放至室温,用75%乙醇擦拭瓶身,待平衡后,在生物安全柜内小心打开西林瓶盖,向瓶内缓缓加入10 mL 灭菌用水,盖好瓶盖,将样品完全溶解且混匀,作为待测供试品10 mL,室温放置15 min 后操作。依照此方法处理3 份样品。
2.2.2 样品稀释 用移液管吸取上述待测供试品5 mL,置装有45 mL 的胰酪大豆胨液体培养基中,充分振摇,混匀,制成1∶10 的样品。吸取1 mL 该溶液置9 mL胰酪大豆胨液体培养基中,制成1∶100 的样品,依次稀释制备至1∶100 000。以此方法,处理3 份样品。
2.2.3 样品培养 阴性对照:吸取1 mL 胰酪大豆胨液体培养基加入到无菌培养皿中;样品:从各稀释度取1 mL 加入无菌培养平皿中(平行两份)。倾注培养基时温度不超过45 ℃,按反时针方向匀速旋转平皿,注意不要将培养基溅到皿边及皿盖上,使混匀,等待凝固后,将平皿倒置在33 ℃恒温培养箱内,培养3~5 d,观察菌落情况。
2.2.4 计数与报告 样品QA03400502 平板上(1∶1 000 稀释度)有片状菌落且菌落之间没有明显界限,按1 个菌落计,样品QA03400327 平板上(1∶100稀释度)有2 个菌落重叠,肉眼能分辨,按2 个菌落计。其余均按平板上生长良好的菌落数计数按照《中国药典》2020 年版四部通则及本次实验作业指导书进行报告。
3 实验结果与分析
3.1 样品检测结果
样品检测结果及报告数见表1。相同稀释度两个平板的菌落总数非常相近,说明试验平行性很好,结果准确。阴性对照试验无菌落生长,说明试验过程中无污染,试验结果有效。对QA03400502 样品选取1∶1 000 稀释度进行报送,结果3.8×104cfu/mL。对QA03400327样品选取1∶10和1∶100 稀释度进行报送,结果1.6×103cfu/mL。QA03400657 样品无菌落生长,结果按<10 cfu/mL报送。

表1 样品检测结果(cfu/mL)
3.2 能力验证结果与分析
本实验室收到中国食品药品检定研究院能力验证结果报告通知单,见表2。按照│z│≤2 为满意结果,2<│z│≤3 为可疑结果,│z│>3 为不满意结果,最终评价为三个样品结果均满意,则最终结果判定为“满意”;有一个结果为“可疑”,则最终结果判定为“可疑”;有一个结果为“不满意”,则最终结果判定为“不满意”进行评价。从表中得知本实验室最终结果为满意。虽然QA03100657 的指定值<1,而本实验室测定的结果是<10 cfu/mL,评价结果为满意,但为了提高样品检出限,以后进行未知样品的需氧菌总数计数检验时,应对供试品原液进行计数。

表2 能力验证评价表
从中国食品药品检定研究院能力验证结果计划报告中获悉,全国共223 家实验室报送结果,按照每个实验室z 值大小顺序排列成柱状图,每个柱条对应唯一编码的实验室,本单位编码为876。从图1、图2 中可直观地反映出本实验室测定的数据趋近准确值。实验室具备很好检测药品中需氧菌总数计数的能力。

图1 样品QA03400502能力评价统计图
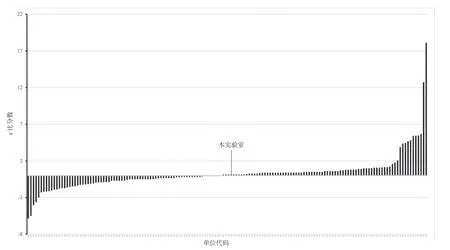
图2 样品QA03400327能力评价统计图
3.3 需氧菌总数计数质量控制分析
3.3.1 实验前的准备控制 收到样品,应及时检查样品是否完好、编号是否与能力验证平台显示的样品编号一致。若样品存在破损或污染等情况,应及时与实施机构联系处理。收样后应立即单独放置于-20 ℃保存,并尽快检测。实验用的培养基、吸管、毛巾、镊子、剪刀等均需按要求灭菌,并进行灭菌效果验证。为了防止高压灭菌过程中稀释液和培养基量的减少及减少传递过程中的污染,装培养基和稀释液的每支试管和三角瓶应用硅胶塞塞住后用牛皮纸单独包扎。吸管在灭菌前,上端应塞入一小段棉花,可避免外界杂菌吹入管内或不慎将菌液吸出管外,造成污染。
3.3.2 操作环境的控制 检测环境不低于生产关键区环境的要求[5],所以在D 级背景下的B 级单向流空气区域内进行。并且要严格按照无菌操作要求进行实验,并做好个人安全防护。因样品内可能含有致病菌,所以本次实验在生物安全柜中进行。实验前后要对实验环境进行灭菌。
3.3.3 样品的制备及稀释过程控制 实验前先将样品放至室温,用75%的乙醇擦拭瓶盖后,在生物安全柜内以无菌操作打开西林瓶,向瓶内缓缓加入10 mL 灭菌水,将样品完全溶解并混匀,作为待测供试品(作业指导书明确规定),室温放置15 min 后再进行后续稀释操作。为了确保样品稀释的准确性,用无菌吸管吸取待测供试品5 mL,置盛有45 mL 的胰酪大豆胨液体培养基锥形瓶中,充分振摇,制成1∶10 的样品溶液。参考《中国药典》2020 年版四部药品中需氧菌总数的控制限度,将3 份样品均稀释至10-5,每个稀释级至少制备2 个平板。样品的制备和稀释过程中,菌液的均匀性很重要,因此每次稀释前后,均要在混匀器上充分混匀。混匀过程要注意控制力度,避免菌液飞溅,造成污染。为了提高样品检出限,应对供试品原液进行计数。
3.3.4 培养基控制 实验所使用培养基的pH 值、适用性检查经前期确认[6-7],确保所使用的培养基性能良好。培养基应临用新配,配制后,微生物易增殖[8],应立即灭菌。灭菌后放入45~50 ℃的水浴中保温,避免温度过低或过高影响实验结果。培养基倾注量应为15~20 mL,太少时在培养过程中培养基会干裂,太多则容易污染,影响计数。倾注培养基混匀时应注意防止混合物溅到皿边及皿盖上。培养皿应倒置培养,既可防止培养过程中水分蒸发形成的冷凝水滴落到培养基上造成染菌,也可防止菌落蔓延造成计数不准。计数时,在琼脂培养基中加入TTC,因TTC 的浓度过高会有抑菌作用[9],经试验,TTC 的使用浓度为0.01 g/L,即每1 000 mL 胰酪大豆胨琼脂培养基中加入1 mL 无菌的1% TTC 溶液。
3.3.5 计数观察控制 胰酪大豆胨琼脂培养基平板在培养2 d 后就应进行一次观察计数,以防菌落被覆盖而影响计数结果。之后分别再培养3、4、5 d 各计数一次,查看菌落变化情况。必须注意计数应在超净工作台内进行,不要打开培养皿盖子,轻拿轻放,防止自身及交叉污染。此次实验中菌落计数时平板上有2 个菌落重叠,肉眼能分辨,按2 个菌落计。有片状菌落且菌落之间没有明显界限,按1 个菌落计。
3.3.6 废弃物的处理控制 所有的实验用具、含菌溶液或培养物均需经过灭菌后洗涤或处理,保证生物安全,减少环境污染。
3.3.7 结果上报控制 点计菌落数后,计算各稀释级供试液的平均菌落数,选取平均菌落数小于300 cfu的稀释级,作为菌数报告依据。若同稀释级两个平板的菌落数平均值不小于15,则两个平板的菌落数不能相差1 倍或以上。取最高的平均菌落数,计算每1 mL 供试品中所含的需氧菌总数,取两位有效数字报告。若各稀释级的平板上均无菌落生长,或仅最低稀释级的平板上有菌落生长,但平均菌落数小于1 时,以小于1 乘以最低稀释倍数的值报告菌数。数据上传到能力验证平台时应仔细核查校对,确保所填信息准确无误,并在截止日期前按要求上报所有数据和记录。
4 总结
根据能力验证的结果反馈情况,说明了本实验室具备药品中需氧菌总数计数能力测定。能力验证已逐渐成为实验室技术能力和管理水平的考核方法,同时也成为重要且有效的实验室外部质量控制评估手段。通过参加药品中需氧菌总数计数能力验证,分析总结检验过程中的控制要点,能够提升实验室内部质量控制,进一步确保实验室检测结果的真实性、可靠性,同时强化政府监管部门对实验室水平的信任度,最终为人民用药安全保驾护航。

