8周有氧运动对Nrf2敲除鼠骨骼肌抗氧化系统及运动能力的影响
刘雨佳 ,毛雅芸 ,张 缨 *
运动能力受到多种因素的影响,骨骼肌内的氧化还原状态是影响骨骼肌工作能力的重要因素。当骨骼肌内自由基生成增多超出了机体正常水平时,骨骼肌处于氧化应激状态,进而引起骨骼肌运动性疲劳。正常情况下,机体内存在着抗氧化系统,可以清除多余的自由基,使机体氧化还原状态保持平衡。在长时间大强度的运动中,骨骼肌处于缺血缺氧状态,由于运动中的能量需求增加,引起骨骼肌线粒体电子漏增加以及黄嘌呤代谢途径的激活,导致骨骼肌自由基生成增多(Jin et al.,2015,Kerksick et al.,2015),进而引起骨骼肌氧化还原状态失衡,使骨骼肌的收缩功能下降。
研究发现,核因子E2相关因子2(nuclear factor-erythroid 2p45-related factor 2,Nrf2)在调节机体抗氧化系统中起到非常重要的作用。当机体处于氧化应激状态时,Nrf2受到自由基的激活,转运进入细胞核,识别并结合核内大部分抗氧化酶基因中都含有的特异DNA启动子序列——抗氧化反应元件(antioxidant response element,ARE),促进过氧化氢酶(CAT)、醌氧化还原酶(NQO1)和血红素加氧酶(HO-1)等一系列抗氧化酶基因转录的启动,从而上调多种保护性酶的表达,进而清除体内过多的自由基(Harvey et al.,2009;Leonard et al.,2006;Zhong et al.,2013)。
近年研究发现,Nrf2受到运动干预的影响。急性运动可以显著增强Nrf2活性,从而作用于抗氧化酶的表达(Li et al.,2015);而长期有氧运动训练对Nrf2的作用和机制仍未完全明确,且长期有氧运动训练能否通过Nrf2通路增强骨骼肌工作能力仍有待进一步探索。因此,本研究采用Nrf2敲除鼠进行8周有氧运动训练,探讨Nrf2信号通路在有氧运动调节抗氧化系统和运动能力中的作用。
1 研究对象与方法
1.1 研究对象
8周龄雄性Nrf2敲除小鼠(Nrf2 KO鼠,购自中国医学科学院医学实验动物研究所)和同周龄野生型C57BL/6J雄性小鼠(WT鼠,购自北京维通利华实验技术有限公司)各20只,敲除鼠和野生鼠均随机分为安静对照组和运动组,即野生安静组(WC组)、野生运动组(WE组)、敲除安静组(KC组)和敲除运动组(KE组),每组10只。动物房采用12∶12昼夜灯光循环照明,室内湿度控制在50%~70%,室温保持在22℃~25℃,自由饮食、饮水。
安静组小鼠正常笼中活动,运动组小鼠先进行1周适应性跑台训练,方案为:坡度0°,跑速12 m/min,持续时间15 min/天,运动频率5天/周。之后运动组采用正式训练方案:坡度 0°,跑速 12 m/min(约 75%V.O2max)(Fernando et al.,1993),运动强度持续时间60 min/天,运动频率5天/周,共8周。
1.2 运动能力测试
在运动训练8周后采用递增负荷强度测定小鼠运动能力。测试方案为:起始速度为10 m/min,持续5 min,然后跑速每3 min增加3 m/min直至力竭。记录小鼠达到力竭的跑速、时间和距离。力竭的判断标准为小鼠不能维持跑速,且电刺激10 s后仍不能坚持。
1.3 取材
所有小鼠取材均在最后一次运动后48 h进行。小鼠脱颈椎处死,立即取小鼠两侧股直肌下段,迅速称量,用锡纸包裹,标记,立刻投入液氮中。然后转入-80℃冰箱,保存待用。
1.4 组织ROS水平测定
细胞ROS水平测定采用GENMED(GMS10016.3)试剂盒,荧光比色法进行测定。取各组100 mg骨骼肌组织样品置于离心管,加入清理液A清洗,弃去清理液,用滤纸吸干。然后加入稀释液C,用剪刀将组织剪碎,匀浆。静置10 min后,4℃10 000 rpm离心10 min。取上清,BCA法测蛋白浓度。根据蛋白浓度将蛋白匀浆液稀释至20 μg/μL,取10 μL加入避光酶标板,按照试剂盒要求稀释染色液B,加入到含蛋白匀浆液的酶标板孔中,37℃避光孵育20 min,激发波长490 nm,散发波长520 nm检测荧光强度值。计算与空白荧光强度差值,以表示该孔细胞ROS含量。
1.5 RT-PCR法测定mRNA的表达
取50 mg的骨骼肌加入0.8 mL预冷Trizol中,剪碎,匀浆后,依次采用氯仿、异丙醇、75%酒精进行分离提纯总RNA,用紫外分光光度计测定总RNA的纯度和浓度,采用RT-PCR试剂盒(Toyobo,FSQ101)将RNA逆转录为cDNA,然后用PCR扩增仪扩增。
采用美国ABI7500荧光定量PCR仪进行PCR扩增测定,引物分别采用Nrf2(QT00095270),过氧化氢酶(CAT;QT010558106),醌氧化还原酶1(NQO1;QT00094367)和血红素氧合酶(HO-1;QT00159915)。反应体系采用:SYBR Green Realtime PCR Master Mix 10 μL,引物 2 μL,CDNA模版2 μL,ddH2O 6 μL。使用ABI7500PCR仪自带的软件对实时荧光定量CT值进行读取,用比较CT法对目的基因表达结果进行相对定量。具体计算公式为:目的基因=2-△△C。
1.6 Western Blot测定蛋白表达
取100 mg冻存骨骼肌组织,加入1 mL含蛋白酶抑制剂的RIPA蛋白裂解液(碧云天)中。剪碎,高速匀浆;冰上静置30 min;12 000 rpm,4℃离心30 min,取上清液于离心管中,-20℃冻存备用。采用美国Pierce公司生产的蛋白浓度试剂盒,BCA方法测定骨骼肌的蛋白浓度。以上样蛋白量20 μg为一次上样量,根据测定的蛋白浓度计算蛋白上样量。采用美国life technologies公司产Bolt 4%~12%Bis-Tris Plus凝胶,电泳分离Nrf2、CAT、NQO1、HO-1及内参(β-actin),然后采用美国Invitrogen公司的iBlot Gel Transfer System转移电泳胶将电泳后蛋白从凝胶转移至NC膜上。5%脱脂奶粉封闭1 h,4℃一抗过夜,一抗分别为 Nrf2(1∶200,Santa Cruz,SC-722),CAT(1∶500,Santa Cruz,SC-50508),NQO1(1∶500,Santa Cruz,SC-16464),HO-1(1∶1 000,abcam,ab13248),室温孵育摇床1 h,后用TBST洗膜3次,每次10 min。ECL发光显影,放入Bio-Rad凝胶成像仪中进行拍摄得到目的条带图像。用Image Lab软件读取条带的积分灰度值,用式(1)计算比值表示最后结果:

1.7 统计学分析
使用SPSS 17.0统计软件进行统计学处理,数据采用平均值±标准误(M±SE)的形式显示,采用双因素方差分析方法,对干预方式(安静和运动训练)和不同基因型的主效应以及两因素的交互作用进行分析。如果无主效应,同种干预方式或同种基因型组间采用独立样本t检验,显著性水平取P<0.05,非常显著性水平取P<0.01。
2 研究结果
2.1 8周有氧运动对小鼠运动能力的影响
野生鼠和Nrf2敲除鼠的运动组的终止跑速、达到力竭时间和运动距离均显著高于各自安静组;而不同基因型鼠的同种干预方式间并未呈现出显著性差异(表1)。
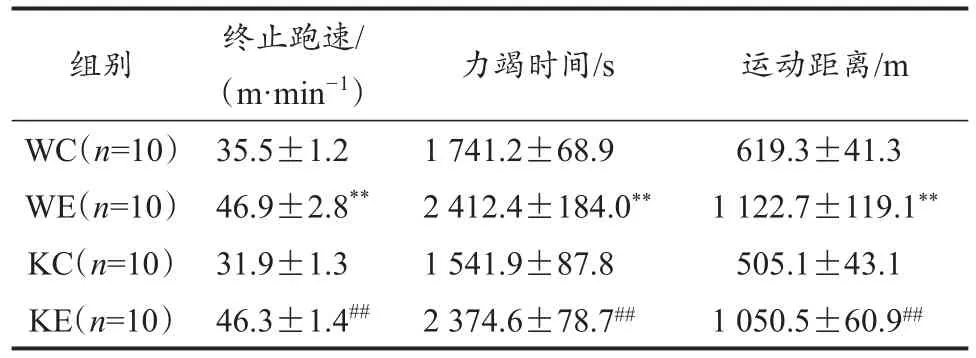
表1 不同组别小鼠的运动能力Table 1 Exercise Capacity in Mice from Various Groups
2.2 8周有氧运动对Nrf2敲除鼠ROS的影响
与WC组相比,KC组小鼠ROS无显著变化,Nrf2敲除并未引起小鼠骨骼肌ROS水平升高;与WE组相比,KE组小鼠ROS水平显著下降(P<0.05),8周有氧运动训练后野生鼠ROS高于Nrf2敲除鼠。WE组与WC组相比无显著性差异,KE组与KC组相比也无显著性差异(图1)。
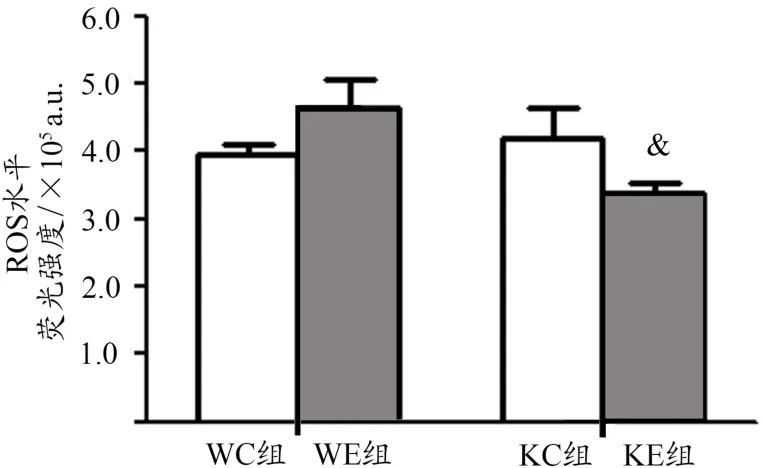
图1 8周有氧运动对Nrf2敲除鼠骨骼肌ROS的影响Figure 1. Effects of 8 Weeks Exercise on ROS in Nrf2 Knockout Mice
2.3 8周有氧运动对Nrf2及抗氧化酶mRNA表达的影响
KC组小鼠Nrf2、NQO1和CAT mRNA非常显著低于WC组,但KC、WC组HO-1 mRNA表达无显著性差异;与WC组相比,WE组Nrf2、NQO1和HO-1 mRNA非常显著升高,而Nrf2敲除鼠运动组与安静组间mRNA均无显著性差异(图2)。
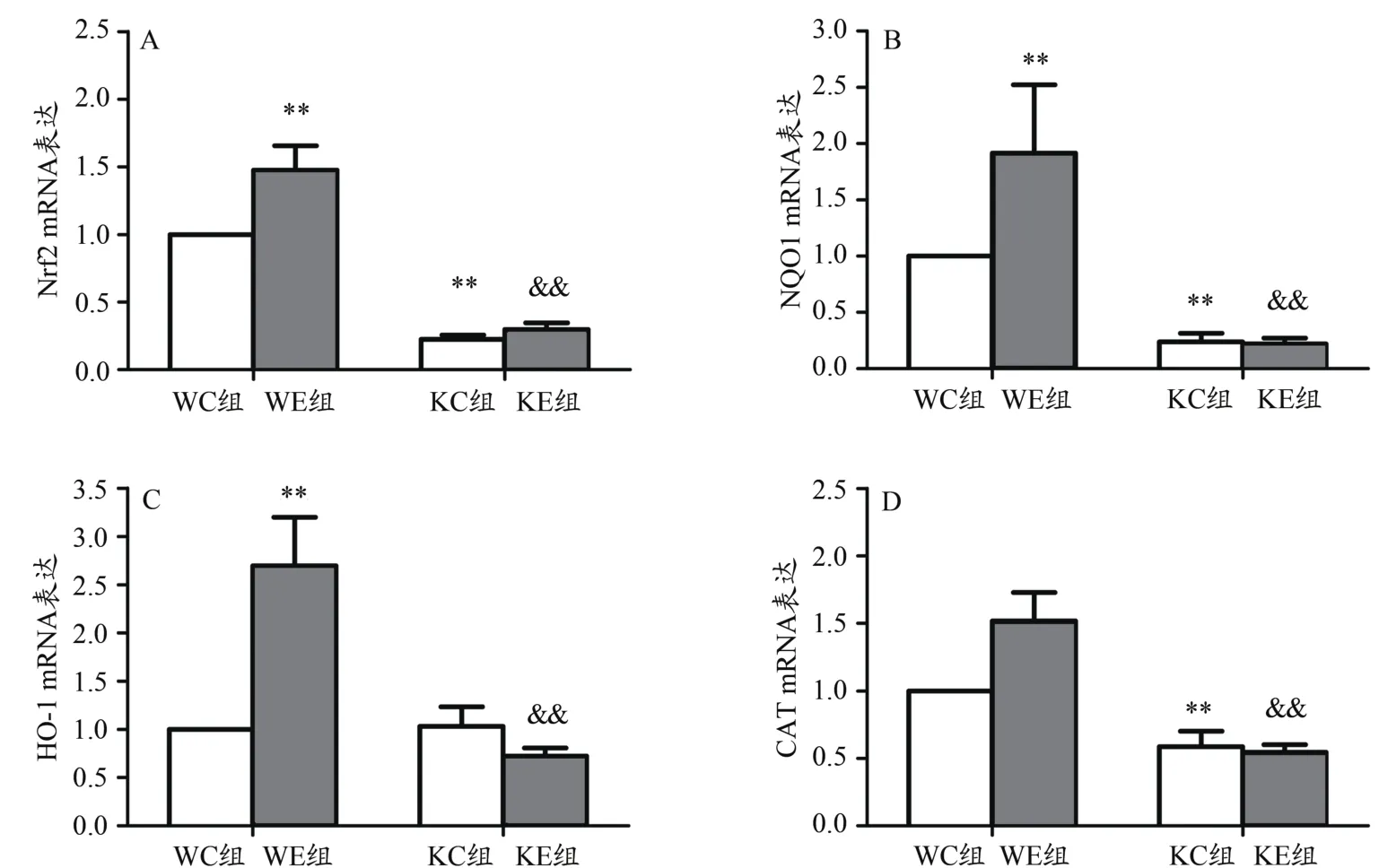
图2 8周有氧运动对Nrf2敲除鼠骨骼肌Nrf2及抗氧化酶mRNA的影响Figure 2. Effects of 8 Weeks Exercise on mRNAof Nrf2 andAntioxidant Enzymes in Nrf2 Knockout Mice
2.4 8周有氧运动对Nrf2及抗氧化酶蛋白表达的影响
KC组与WC组相比,Nrf2蛋白表达非常显著降低,而NQO1、HO-1和CAT表达均无显著性差异;KE组与WE组相比,Nrf2及其调节的NQO1、HO-1和CAT的蛋白表达均显著降低。WE组与WC组相比,Nrf2及其调节的NQO1、HO-1和CAT的蛋白表达均无显著差异;KE组较KC组各蛋白无显著改变(图3)。
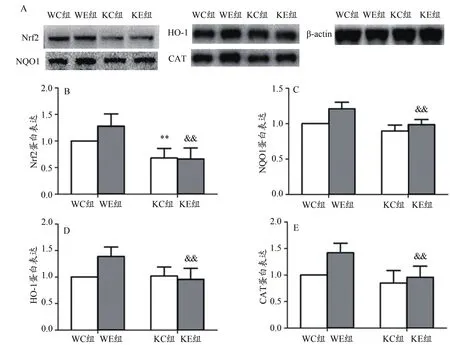
图3 8周有氧运动对Nrf2敲除鼠骨骼肌Nrf2及抗氧化酶蛋白表达的影响Figure 3. Effects of 8 Weeks Exercise on Expression of Nrf2 andAntioxidant Enzymes in Nrf2 Knockout Mice
3 分析讨论
3.1 Nrf2对运动能力的作用
有研究发现,运动作为一种应激,对骨骼肌中ROS的生成起到刺激作用(Powers et al.,2020)。Nrf2是细胞内氧化还原状态中关键的核转录因子。Nrf2可通过细胞内ROS激活,转运至细胞核内,调节多种抗氧化解毒酶的表达,进而清除ROS,维持细胞内氧化还原状态平衡。而Nrf2是否会受到运动的影响,进而提高运动能力?相关的研究仍没有明确结论。本研究发现,经过8周的有氧运动训练,野生鼠和Nrf2敲除鼠达到力竭的时间都呈现显著提高,但两种基因型小鼠间并没有显著性差异。Crilly等(2016)的研究结果与本研究一致,采用Nrf2敲除小鼠和野生鼠进行自由转轮训练6周,在最后一次运动后48 h进行最大运动能力测试,结果显示,两种基因型小鼠在运动后均比各自的安静组运动能力显著性增加,但Nrf2敲除小鼠达到力竭时的运动距离与野生鼠相比并无显著性差异。关于Nrf2对运动能力作用的研究结论并不一致,有研究采用外源性药物补充的方式激活Nrf2,发现Nrf2的激活增强了运动能力。如,Wafi等(2019)研究证明,姜黄素可以上调骨骼肌Nrf2信号,增强了骨骼肌的运动能力;Oh等(2017)研究发现,萝卜硫素(SFN)可以通过激活骨骼肌Nrf2,降低了力竭运动导致的骨骼肌氧化应激,从而使运动能力增强,且可以减少运动至力竭引起的骨骼肌结构损伤。研究结果的不一致可能与Nrf2的激活方式不同有关。结合本研究结果来看,有氧运动可以增强Nrf2敲除鼠和野生鼠的运动能力,但并不依赖于Nrf2系统实现运动能力的改善。
3.2 8周有氧运动对Nrf2敲除鼠骨骼肌ROS的影响
有研究发现,在Nrf2敲除状态下,多个器官ROS水平有所升高(He et al.,2009;Kovac et al.,2015),也有研究发现,Nrf2的缺失并未引起ROS以及氧化损伤标志物的增加(Gong et al.,2006;Osburn et al.,2006)。Muthusamy等(2012)对Nrf2敲除小鼠心肌ROS的检测发现,在一次性运动应激后,心肌ROS水平增加;而在基础状态下,Nrf2敲除鼠与野生鼠ROS水平并无显著性差异。因此,Nrf2敲除对ROS的影响,一方面是由于在体和离体状态下细胞或器官生存环境不同,另一方面,还跟细胞或器官的活动状态有关。本研究结果显示,在安静状态下Nrf2敲除鼠ROS水平与野生鼠无显著性差异,由此也说明ROS的生成不仅与Nrf2有关,可能存在其他的通路对骨骼肌中ROS的生成产生影响。本实验中动物取材时间选择在基础状态下,因而Nrf2敲除并未引起小鼠骨骼肌基础状态下氧化还原状态的失衡。
运动作为一种应激,可以影响线粒体的功能,使骨骼肌ROS水平增加(Saborido et al.,2011)。另有研究发现,规律性的运动训练也可以引起机体ROS的适应性变化。运动训练可以增强机体抗氧化系统的功能,且运动训练可能影响了线粒体和胞浆中ROS的生成(He et al.,2016)。Merry等(2016)研究发现,Nrf2除了调节抗氧化系统多种抗氧化酶的表达外,还可能影响细胞内线粒体代谢相关的酶。该研究通过对Nrf2敲除鼠V.O2max检测发现,Nrf2敲除鼠V.O2max也显著低于野生鼠,由此说明Nrf2敲除引起线粒体代谢功能下降,而ROS的生成也因此受到限制。在本研究中,KC组与WC组ROS水平相比无显著性差异,而KE组ROS水平低于WE组,这与最初的预期结果并不一致。ROS的生成与骨骼肌线粒体代谢关系密切。Kovac等(2015)研究发现,Nrf2通路参与调节了线粒体内NADPH氧化酶(NOX)的表达。Nrf2敲除鼠NOX4表达降低,而NOX2出现代偿性增加,这可能是ROS水平升高的原因。Crilly等(2016)研究发现,Nrf2敲除引起小鼠骨骼肌线粒体功能降低,而运动训练并不依赖Nrf2途径提高细胞色素c氧化酶4的表达,进而增强线粒体功能,这也可能是运动训练后导致Nrf2敲除鼠ROS水平低于安静组的原因。因此结合本研究结果推测,运动训练可能影响了Nrf2敲除鼠骨骼肌ROS水平,具体的机制仍有待进一步研究。
3.3 8周有氧运动对Nrf2敲除鼠骨骼肌抗氧化系统的影响
ROS除了引起氧化损伤外,在细胞内还担任着信号分子的作用,例如,Nrf2的激活就依赖于ROS。有氧运动训练引起Nrf2敲除鼠骨骼肌的抗氧化系统的适应性变化可能是通过对ROS的改变来起作用的(Merry et al.,2016)。近些年来关于长期耐力运动训练的研究发现,有氧耐力训练可以增加Nrf2及其调控的Ⅱ相解毒酶的表达和/或活性增加(Aguiar et al.,2016;Asghar et al.,2007;Camiletti-Moirón et al.,2014;da Silva Fiorin et al.,2016;George et al.,2009;Gounder et al.,2012;Jiang et al.,2014;Kumar et al.,2011;Muthusamy et al.,2012;Strobel et al.,2011;Sun et al.,2013;Zhao et al.,2013)。本研究结果显示,尽管在安静状态下,Nrf2敲除小鼠Nrf2、NQO1、HO-1和CAT抗氧化酶mRNA表达低于野生鼠,但NQO1、HO-1和CAT蛋白表达并未显著低于野生鼠。而KE组与WE相比,Nrf2、NQO1、HO-1和CAT的表达均显著降低。结合ROS水平的结果发现,Nrf2和抗氧化酶蛋白表达结果与ROS水平变化趋势相似,即在安静的基础状态下,Nrf2的缺失并未引起机体内ROS和抗氧化系统的明显差异,但在经过有氧运动训练后,ROS和抗氧化酶的表达出现差异。有氧运动训练可能增加了基础状态下的ROS水平,而NQO1、HO-1和CAT抗氧化酶的表达增加可能是对ROS的敏感性增加,这一运动适应性变化过程依赖于Nrf2的参与。
4 结论
8周有氧运动通过Nrf2促进骨骼肌抗氧化酶的表达。8周有氧运动增强了小鼠运动能力,但并不依赖于Nrf2发挥作用。

