跑台运动和二甲双胍在改善2型糖尿病小鼠血管炎症中的作用及机制研究
姬丽丽,王 丹,江东谋,余蓉蓉,许桂清,王少兵,刘一平*
糖尿病是一组由多病因引起的以慢性高血糖为特征的常见且高发的代谢性疾病。血管病变是糖尿病的主要并发症,是其导致患者致残、致死的主要原因。目前,我国糖尿病患病人数居于全球首位,因此,防控糖尿病血管病变刻不容缓。2型糖尿病(type 2 diabetes mellitus,T2DM)机体内糖脂代谢紊乱、胰岛素抵抗、氧化应激以及炎症反应相互作用,导致血管内皮功能障碍,促进动脉粥样硬化(atherosclerosis,AS)的发生与发展。内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)是一氧化氮(nitric oxide,NO)合成的关键酶,NO和内皮素-1(endothelin 1,ET-1)是血管内皮细胞分泌的具有拮抗作用的血管活性因子,NO/ET-1的失衡可促进糖尿病血管损伤与病变,因此,eNOS在维持血管功能中起着重要作用。在体内,低密度脂蛋白(low density lipoprotein,LDL)的氧化修饰主要发生在动脉管壁(潘玉婷等,2014)。在糖尿病氧化应激状态下,LDL易被氧化成氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)。凝集素样氧化型低密度脂蛋白受体-1(lectin-like oxidized low density lipoprotein receptor-1,LOX-1)是一种Ⅱ型单链跨膜蛋白,属于C型凝集素家族分子,是介导内皮细胞摄取ox-LDL的主要受体。研究表明,LOX-1介导血管内皮细胞摄取ox-LDL后,其脂质成分可通过损伤内皮细胞结构、诱导血管炎症反应、降低血管舒张功能等导致内皮功能损伤(徐雅琴等,2000),促进AS的发生发展,但其作用机制尚未明确。核因子κB(nuclear factor kappa-B,NF-κB)是调控转录多种炎性因子的中心环节和共同通路,参与调控炎症反应、免疫反应、凋亡及细胞增殖与分化。NF-κBp65发生核转位时,可激活下游炎症靶基因表达。半胱氨酸天冬氨酸蛋白酶3(cysteine-dependent aspartatedirected proteases-3,caspase-3)是含半胱氨酸的天冬氨酸蛋白水解酶家族成员介导的蛋白酶级联反应下游最关键的凋亡执行者,是多种凋亡途径的共同下游效应部分(董雅洁 等,2012)。因此,本研究首先以NF-κBp65和Caspase-3探讨ox-LDL、LOX-1对T2DM血管炎症及细胞凋亡的影响。
目前,T2DM的治疗以控制血糖为主,二甲双胍是一种具有胰岛素增敏效应的口服降糖药,在控制血糖和预防糖尿病心血管并发症中具有良好效果,成为众多国家和组织控制T2DM的一线用药。由于T2DM及其血管病变是血糖血脂代谢紊乱的多因素结果,有氧运动具有改善糖脂代谢、减少心血管危险因素、延缓血管损伤等作用,已成为防控糖尿病及其血管并发症的基础疗法。研究报道,有氧运动可提高糖尿病胰岛素敏感性,控制血糖,减轻血清白介素-1β(interleukin-l-beta,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)水平,下调主动脉 NF-κBp65基因及蛋白表达,改善血管内皮功能(李俊等,2019;刘一平等,2007)。那么,作为胰岛素增敏剂的二甲双胍与可改善糖脂代谢紊乱的有氧运动对T2DM血管损伤的保护作用机制是否存在异同呢?本研究以ox-LDL、LOX-1为切入点,在探讨T2DM血管炎症损伤的基础上,进一步比较有氧运动和二甲双胍对T2DM血管保护效应的异同,评价有氧运动和二甲双胍对T2DM血管脂代谢、炎症反应的影响,并探讨其影响的可能途径。
1 研究对象与方法
1.1 实验动物与分组
2周龄清洁级雄性C57BL/6J小鼠69只(吴氏实验动物中心提供),体质量12~15 g,健康状况良好,合格证号:SCXK(沪)2017-0005。饲养房室温:(24±1)℃,湿度:50%~60%,昼夜循环12 h:12 h。所有小鼠普通饲料适应性喂养一周。小鼠随机分为8组,具体如下:正常组(N,n=8)、正常对照组(NC,n=8)、正常跑台运动组(NE,n=8)、T2DM组(D,n=9)、T2DM对照组(DC,n=9)、T2DM跑台运动组(DE,n=9)、T2DM二甲双胍组(DM,n=9)、T2DM跑台运动+二甲双胍组(DEM,n=9)。正常组给予普通饲料喂养,T2DM造模组给予高脂饲料喂养(64.8%基础饲料,15%蔗糖,15%猪油,5%蛋黄粉,0.2%胆酸钠)。
1.2 T2DM小鼠模型制备
采用高脂饮食和多次小剂量腹腔注射链脲佐菌素制备T2DM小鼠模型(冯润等,2017)。高脂饲料自由进食4周,禁食12~14 h,称量小鼠空腹体质量,连续3天以40 mg/kg的剂量腹腔注射链脲佐菌素[STZ溶于0.1 mmol/L冰柠檬酸缓冲液(pH=4.4),现配现用,避光放置,30 min内完成注射],常规饲养的正常组腹腔注射相同剂量的柠檬酸缓冲液。注射后第7、14天,在小鼠尾静脉采血测其血糖,最终随机血糖≥16.7 mmol/L确定为糖尿病模型。依据小鼠腹腔糖耐量实验和血清胰岛素水平判断其是否为T2DM模型。每天观察小鼠的活动状态和饮食情况,造模成功后每周记录小鼠的血糖变化。
1.3 运动干预方案
依据Fernando等(1993)制作的跑速与最大摄氧量(V˙O2max)对应表,运动组小鼠进行 8 周 12 m/min(75%V˙O2max)跑台运动干预。运动组小鼠先进行一周适应性跑台运动,之后以60 min/次、5天/周,进行8周正式运动干预。适应性运动方案:第一天8 m/min,25 min,第二天8 m/min,30 min,第三天8 m/min,40 min,第四天10 m/min,40 min,之后以12 m/min、40 min进行3天的跑台干预。正式运动干预分为4部分:热身期(5 min)、中间期(10 min)、主负荷期(40 min)、恢复期(5 min)。热身期和恢复期的速度均为8 m/min,中间期将速度逐渐增加到12 m/min,在主负荷期以12 m/min运动强度进行40 min的运动干预。
1.4 给药方案
参考陈致瑜等(2017)的研究,二甲双胍给药剂量为200 mg/(kg·天),给药体积为0.05 ml/10 g体质量,每周根据小鼠体质量调整灌胃剂量。
1.5 腹腔糖耐量实验
小鼠空腹12~14 h,尾部静脉采血测其空腹血糖,然后按照1.5 g/kg体质量给予小鼠腹腔注射50%葡萄糖注射液,于注射后15、30、60、120 min尾部静脉取血,测其血糖水平,以近似梯形的计算公式计算其曲线下面积。
1.6 样品制备
按照0.1 ml/10 g体质量剂量腹腔注射10%水合氯醛,待小鼠完全麻醉,摘眼球取血,室温静置20 min,4℃离心机3 000 r/min离心25 min,吸取上层血清,-20℃保存备用。打开小鼠胸腹部,迅速剥离主动脉,放入-80℃冰箱里冷冻,用于Western blot实验。
1.7 血清指标检测
血糖采用罗氏血糖仪和配套血糖试纸进行尾部采血检测;脂质指标采用相应试剂盒检测;NO采用硝酸还原酶法检测;胰岛素、TNF-α、IL-1β、ET-1采用ELISA法检测。
1.8 Western Blot法
用10 mg组织加入100 ul含有蛋白酶抑制剂的RIPA裂解液,提取主动脉总蛋白,采用BCA法测定蛋白浓度。制备凝胶、上样、电泳、转膜、5%脱脂牛奶室温封闭2 h,4℃摇床孵育一抗过夜。次日TBST清洗一抗3次(10 min/次),二抗室温孵育2 h,TBST清洗二抗3次(10 min/次)。之后,进行双色红外激光成像与分析。
1.9 统计学分析
运用SPSS 19.0软件对数据进行统计分析,组间比较采用独立样本t检验或One-way ANOVA,所有数据用平均值±标准差表示。P<0.05表示具有显著差异,P<0.01表示具有极显著差异。
2 实验结果
2.1 T2DM小鼠模型构建
2.1.1 空腹胰岛素水平和腹腔糖耐量实验
与N组相比,D组空腹胰岛素(fasting insulin,FINS)水平和腹腔糖耐量实验的时间-血糖曲线下面积(area under curve,AUC)显著升高(P<0.01;图1)。D组各时间点血糖水平远高于N组。120 min时,N组血糖恢复到0 min时的血糖水平,D组血糖明显高于0 min时的血糖水平。
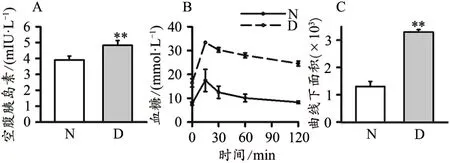
图1 空腹胰岛素水平和腹腔糖耐量实验Figure 1.Fasting Insulin Level and Intraperitoneal Glucose Tolerance Test
2.1.2 N组和D组小鼠主动脉eNOS、ox-LDL、LOX-1、NF-κBp65、VCAM-1、Caspase-3蛋白表达变化
如图2所示,与N组相比,D组ox-LDL、LOX-1及NF-κBp65蛋白表达显著增加(P<0.01,P<0.05),eNOS、血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)和Caspase-3蛋白表达无显著性差异(P>0.05)。
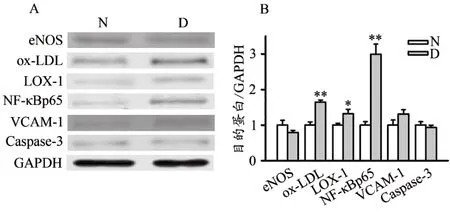
图2 N组和D组主动脉eNOS、ox-LDL、LOX-1、NF-κBp65、VCAM-1、Caspase-3蛋白表达Figure 2.Results of Protein Expression ofAortic ENOS,Ox-LDL,LOX-1,NF-κBp65,VCAM-1,Caspase-3 in N and D Groups
2.2 T2DM建模9周后糖脂代谢、炎症状态、血管功能比较
如表1显示,与N组相比,D组空腹血糖(fasting blood glucose,FBG)、FINS、胰岛素抵抗(HOMA-insulin resistance,HOMA-IR)、胰岛素敏感性指数(insulin sensitivity index,ISI)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)显著升高(P<0.01),高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)显著降低(P<0.05),TNF-α、IL-1β、NO、ET-1、NO/ET-1无显著性差异(P>0.05)。与D组相比,DC组FBG、HOMA-IR、TG、HDL-C、TNF-α、ET-1显著升高(P<0.01),ISI、HDL-C、NO、NO/ET-1显著降低(P<0.01),FINS、TC、LDL-C、IL-1β无显著性差异(P>0.05)。
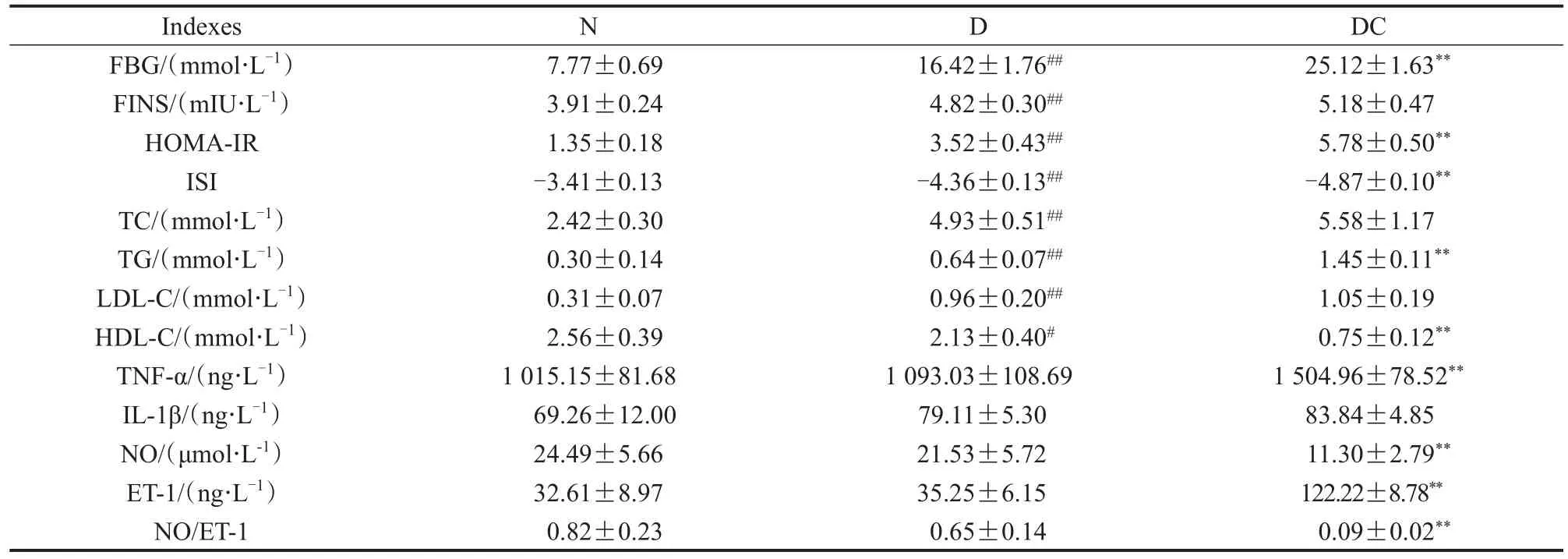
表1 T2DM小鼠建模9周后糖脂代谢、炎症状态与血管功能情况Table 1 Glucolipid Metabolism,Inflammatory Status and Vascular Function in T2DM Mice after 9 Weeks M±SD,n=5~9
2.3 跑台运动和二甲双胍对T2DM小鼠糖脂代谢、炎症状态、血管功能的影响
图3显示,干预周期内,NC组和NE组血糖维持在稳定状态,DC组、DE组、DM组和DEM组血糖明显高于NC组和NE组,DC组血糖呈逐渐升高趋势。干预前5周内,DE组、DM组和DEM组血糖水平维持在稳定状态;5周后,DE组、DM组和DEM组血糖呈逐渐下降趋势,DE组整体血糖高于DM组和DEM组。表2显示,与NC组比,DC组FBG、FINS、HOMA-IR、TC、TG、LDL-C、TNF-α、IL-1β、ET-1显著升高(P<0.01,P<0.05),ISI、HDL-C、NO、NO/ET-1显著降低(P<0.01)。与DC组比,DE组、DM组和DEM组 FBG、FINS、HOMA-IR、TC、TG、LDL-C、TNF-α、IL-1β、ET-1显著降低(P<0.01,P<0.05),ISI、HDL-C显著升高(P<0.01);DE组和DEM组NO、NO/ET-1显著升高(P<0.01,P<0.05),DM组NO、NO/ET-1无显著性差异(P>0.05)。与 DE组比,DM 组 ET-1显著升高(P<0.01);DEM 组 TC、TNF-α、ET-1显著降低(P<0.01,P<0.05),NO/ET-1显著升高(P<0.01)。与DM组比,DEM组FINS、HOMA-IR、TG、LDL-C、ET-1显著降低(P<0.01,P<0.05),ISI、HDL-C、NO/ET-1显著升高(P<0.01,P<0.05)。
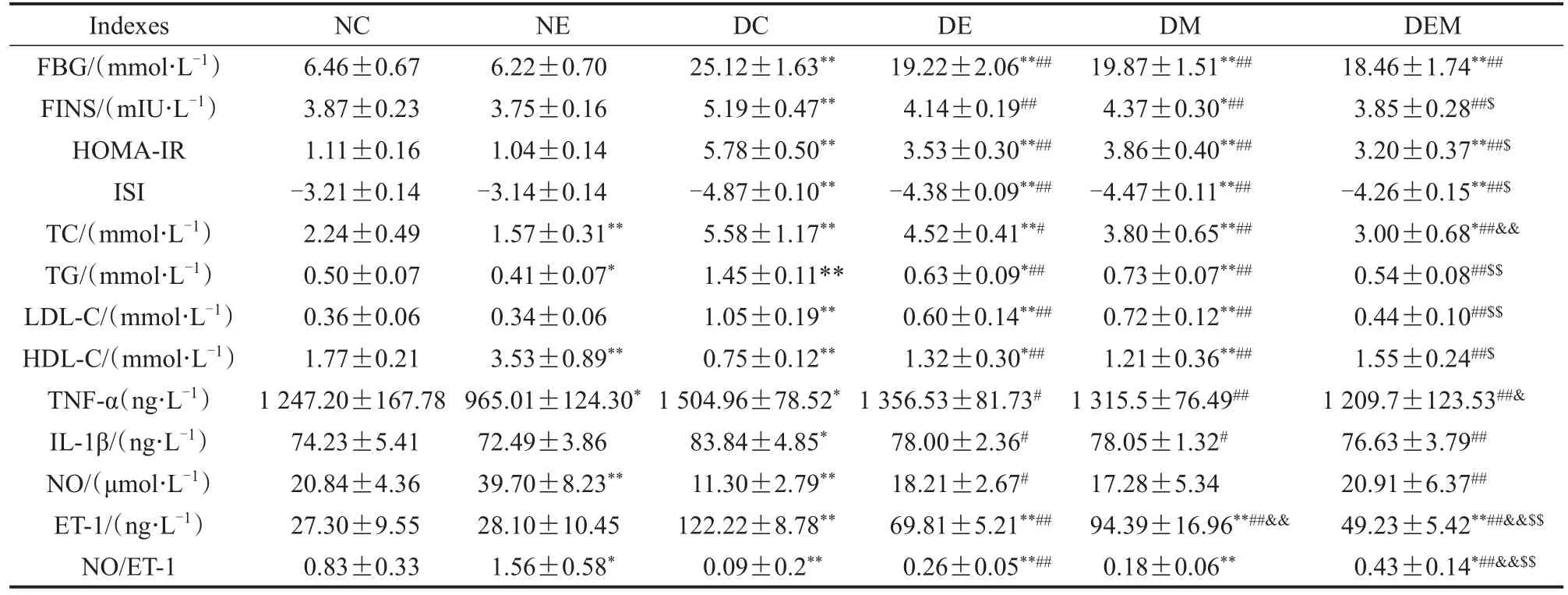
表2 T2DM小鼠糖脂代谢、炎症状态、血管功能Table 2 Glucolipid Metabolism,Inflammatory Status and Vascular Function in T2DM Mice M±SD,n=5~8
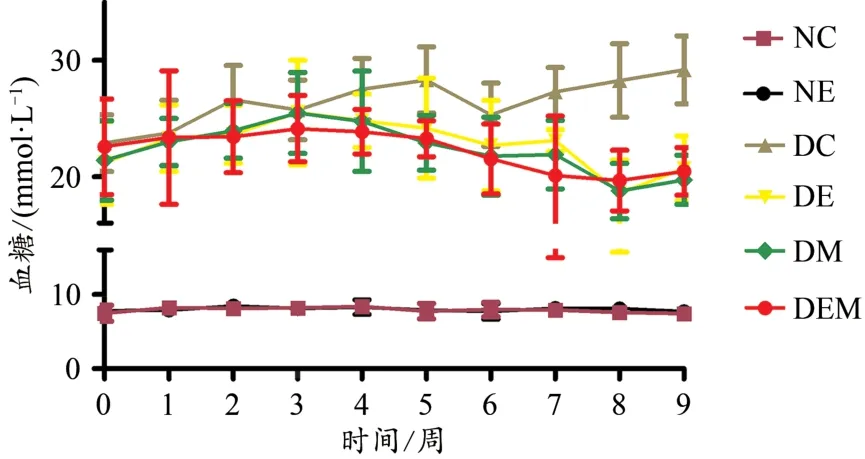
图3 各组小鼠干预周期内血糖水平(M±SD,n=7~9)Figure 3.Blood Glucose Levels of Mice in Each Group during the Intervention Period
2.4 跑台运动和二甲双胍对T2DM小鼠主动脉eNOS、ox-LDL、LOX-1、NF-κBp65、VCAM-1、Caspase-3蛋白的影响
图4显示,与NC组比较,NE组、DEM组eNOS蛋白表达显著升高(P<0.01),DC组eNOS蛋白表达显著降低(P<0.01),DE组、DM组eNOS蛋白表达无显著差异(P>0.05);NE组 ox-LDL、NF-κBp65和 VCAM-1蛋白表达显著降低(P<0.01,P<0.05),LOX-1和Caspase-3蛋白表达无显著性差异(P>0.05);DC组、DE组、DM组和DEM组ox-LDL、LOX-1、NF-κBp65和VCAM-1蛋白表达显著升高;DC组和DM组Caspase-3蛋白表达显著升高(P<0.01,P<0.05),DE组和DEM组无显著性差异(P>0.05)。与DC组比较,DE组、DM组和DEM组eNOS蛋白表达显著升高(P<0.01),ox-LDL、LOX-1、NF-κBp65和Caspase-3蛋白表达均显著降低(P<0.01,P<0.05);DE组和DEM组VCAM-1蛋白表达显著降低(P<0.01),DM组VCAM-1蛋白表达无显著性差异(P>0.05)。DE组和DM组相比,DEM组eNOS蛋白表达显著增加(P<0.01),ox-LDL、LOX-1、NF-κBp65和 Caspase-3蛋白表达显著降低(P<0.01)。与DE组相比,DEM组VCAM-1蛋白表达无显著性差异(P>0.05);与DM组相比,DEM组VCAM-1蛋白表达显著降低(P<0.01)。
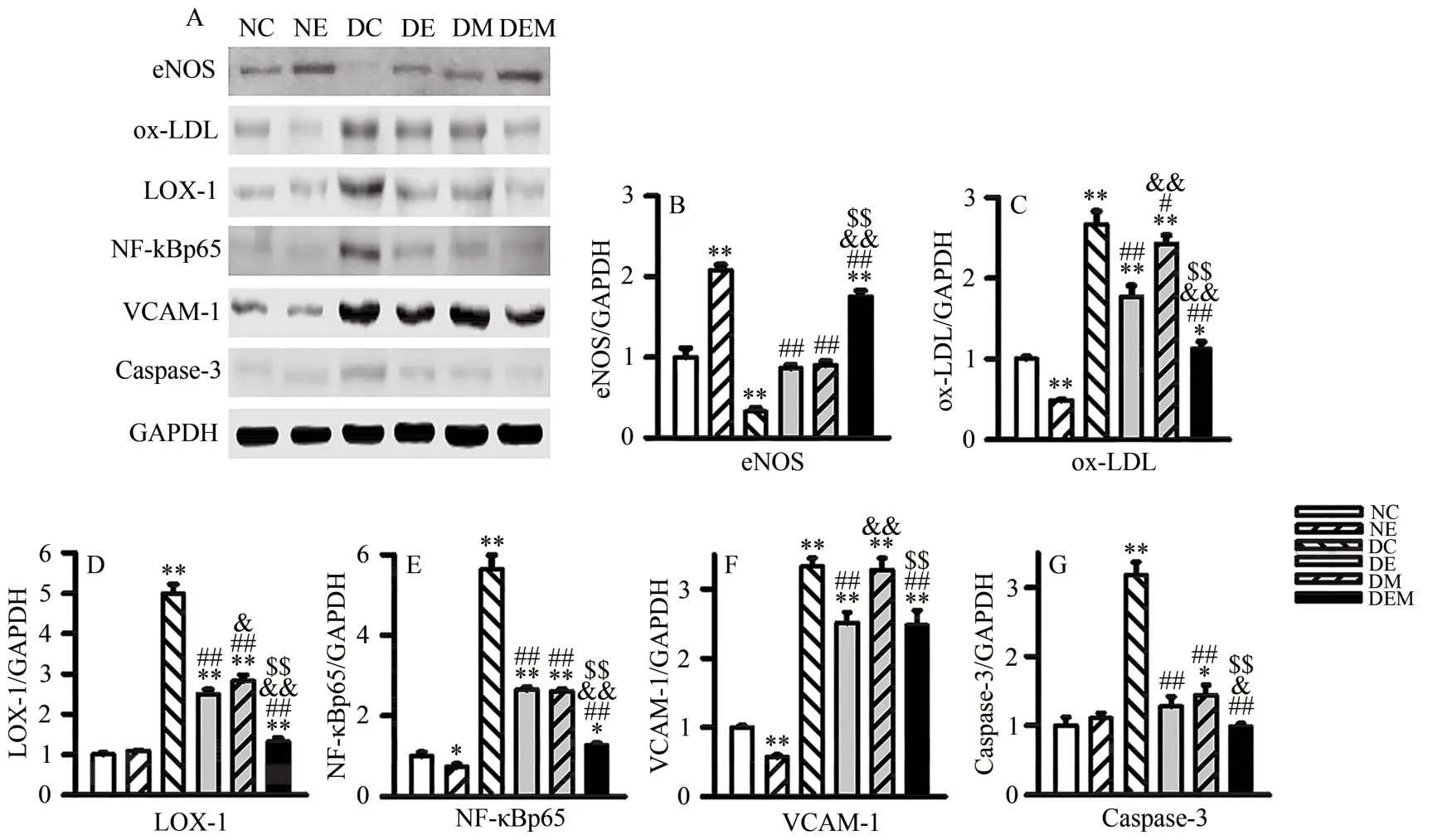
图4 各组小鼠主动脉eNOS、ox-LDL、LOX-1、NF-κBp65、VCAM-1、Caspase-3蛋白表达Figure 4.Protein Expression ofAortic ENOS,Ox-LDL,LOX-1,NF-κBp65,VCAM-1,Caspase-3 among NC NE,DC,DE,DM,and DAM Groups
3 分析与讨论
3.1 高脂联合STZ诱导的T2DM小鼠早期血管发生炎性反应
高脂饮食联合低剂量STZ多次腹腔注射诱导的T2DM小鼠模型与人类T2DM有相似的病理结构和生化特点(曾位森 等,2014)。T2DM通常表现出高TG、高LDL-C、低HDL-C。在机体代谢应激状态下,LDL易被氧化成ox-LDL。ox-LDL对内皮细胞具有毒性作用,可诱导中性粒细胞黏附于内皮细胞(Alouffi et al.,2018),促进巨噬细胞内脂质蓄积,增加活性氧(reactive oxygen species,ROS)和脂质过氧化产物丙二醛(Yao et al.,2013),导致血管功能障碍。LOX-1作为介导内皮细胞摄取ox-LDL的主要受体,ox-LDL/LOX-1/ROS通路的激活可促进各种丝裂原激活蛋白激酶类、NF-κB和黏附分子的表达,促进炎症因子、生长因子和趋化因子的产生(Nègre-Salvayre et al.,2017)。本研究显示,实验诱导的T2DM小鼠早期随机血糖、FINS显著升高;TC、TG、LDL-C显著升高,HDL-C显著降低;主动脉ox-LDL、LOX-1和NF-κBp65蛋白表达显著升高,eNOS、VCAM-1、Caspase-3蛋白表达无显著性差异,说明该模型小鼠糖脂代谢紊乱,胰岛素抵抗,血管处于炎性状态但还未发生明显的炎性损伤。
大量流行病学数据显示,糖尿病是多种心血管疾病的独立危险因素,高血糖会增加心血管疾病的风险,但血糖控制并不能显著降低心血管疾病的发生率(Meigs et al.,2003),说明糖尿病血管并发症的发生还存在血糖之外的因素。本研究中,T2DM小鼠继续高脂饲料喂养9周后,其血清TC、TG、LDL-C显著升高,HDL-C显著降低,脂代谢紊乱进一步加重;TNF-α和IL-1β显著升高,机体处于明显的炎症状态;主动脉ox-LDL、LOX-1、NF-κBp65、VCAM-1蛋白表达显著上调,血管处于炎症状态;ET-1显著升高,NO、NO/ET-1显著降低,eNOS蛋白表达显著下调,血管舒张与收缩功能障碍。LDL的氧化修饰主要发生在动脉管壁,作为ox-LDL主要受体的LOX-1是一种有效的促炎介质。研究证实,ox-LDL可增加ET-1表达,降低内皮细胞活力,抑制内皮细胞迁移能力,降低eNOS蛋白表达,增加内皮黏附分子表达,诱导血管内皮功能障碍(Chen et al.,2019)。糖脂代谢紊乱、氧化应激、胰岛素抵抗均可诱导血管炎症的发生与发展。可见,造模成功后,仍高脂喂养且未进行运动干预的小鼠,将发生T2DM血管炎性损伤。
可见,糖尿病小鼠在早期就存在血管炎性反应,但血管功能正常,提示糖尿病早期就存在血管问题。但在不进行任何干预情况下,血管炎性反应会逐渐增加,并出现血管功能紊乱的现象,说明糖尿病后期若任其自然发展,血管病变将会加重。
3.2 跑台运动和二甲双胍可显著抑制T2DM小鼠血管的炎症反应,减少血管的细胞凋亡
运动锻炼作为慢性病防控的非药物手段,有助于降低代谢应激,减少心血管危险因素,防止糖尿病血管并发症的发生。有氧运动具有血管保护作用,与其提高胰岛素敏感性、抑制炎症反应和改善线粒体功能等密切相关(Zanuso et al.,2017)。其可增加大动脉血管内皮eNOS活性,增加NO基础释放量,改善内皮依赖性血管舒张功能(Silva et al.,2016)。虽然认识到运动能够改善糖尿病血管并发症,但其作用机制并不完全明确。二甲双胍是目前应用最广泛的抗糖尿病药物,可通过抑制肝脏糖异生和肝糖分解,增加肝脏和外周组织对胰岛素的敏感性,有效降低血糖,改善脂质代谢,增加脂肪酸氧化,降低LDLC水平,还具有独立于降糖外的心血管保护作用(DeFronzo,1999)。那么,运动、二甲双胍以及联合干预在防控T2DM血管并发症的发生与发展上又有哪些异同?本研究显示,8周75%V˙O2max跑台运动、二甲双胍及其联合干预后,ox-LDL、LOX-1、NF-κBp65蛋白表达显著下调,血管炎性反应降低;Caspase-3蛋白表达显著下调,血管细胞凋亡减少;主动脉eNOS蛋白表达显著上调,血管功能改善。这更加说明在糖尿病早期进行药物或运动干预的重要性。
研究表明,LOX-1的激活可导致氧化应激和炎症增加(Vincent et al.,2009),ox-LDL(Zhang et al.,2014)和高浓度葡萄糖(5.6~30.0 mmol/L)(Li et al.,2003)均以时间和剂量依赖性增加内皮细胞LOX-1 mRNA及蛋白表达。而胞内ox-LDL积累可诱导NF-κBp65磷酸化,促进线粒体细胞色素C释放到细胞质,激活Caspase-3,导致内皮细胞凋亡(Lin et al.,2018)。血管内皮细胞的过度凋亡是造成血管病变的始动环节。高糖(40 mmol/L葡萄糖)引起人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)炎症因子IL-1β、TNF-α分泌增多,Caspase-3表达增多,使细胞存活率降低(谭其平等,2018)。诱导血管内皮细胞凋亡的信号通路均需激活Caspase-3才能产生细胞凋亡效应(吴云飞等,2013)。因此,推测运动可通过下调主动脉ox-LDL与LOX-1的表达,减轻血管炎症,减少血管细胞凋亡,以改善血管功能。此外,运动和联合干预均可增加NO水平、NO/ET-1,显著下调主动脉VCAM-1蛋白表达;二甲双胍对血清NO、NO/ET-1及VCAM-1蛋白表达未见显著影响,该现象可能与二甲双胍的用药剂量和用药时长有关。本研究还显示,联合干预在改善T2DM小鼠脂质代谢紊乱和血管炎症反应上的效果更显著,说明运动和二甲双胍在改善脂质代谢和血管炎症反应上可能存在协同效应。
4 结论
T2DM小鼠造模成功后未进行运动或药物干预,糖脂代谢紊乱进一步加重,主动脉炎性反应增强,血管细胞凋亡明显增加,血管舒张功能出现障碍;8周跑台运动在降低血管炎症、改善血管舒张功能方面较二甲双胍作用显著,联合干预显示出更有效的血管舒张功能改善效应。推测:8周跑台运动干预可能是通过下调ox-LDL、LOX-1蛋白表达,减轻血管炎症与细胞凋亡,从而改善血管舒张功能的,联合干预则显示出运动与二甲双胍的协同作用。

