MiR-375抑制的人诱导多能干细胞分化为起搏样细胞的研究*
章澜 杨媚 王晞 唐艳红 宋思维 陈玉婷 王腾 黄从新
非编码RNA(miRNA)参与调控基因表达,对心脏的发育、心肌细胞的生长收缩、心律的维持等起重要作用[1]。MiR-375 为高度保守的miRNA 之一,现有研究表明MiR-375靶向负调控Shox2[2-3]。Shox2被认为是窦房结发育和功能维持过程中不可缺少的转录调控因子[4]。近年来,利用Wnt信号通路在心肌细胞分化过程中的双相性作用,人诱导多能干细胞(hiPSCs)已被广泛用于产生具有自发和节律性收缩能力的新生心肌细胞(CMs),但其中窦房结起搏样细胞占比相对较低[5-6]。笔者通过抑制miR-375敲低工作心肌细胞谱系特有的基因,探讨其修饰的hiPSC 在向人诱导多潜能干细胞源性心肌细胞(hiPSC-CMs)分化的过程中能否更高效地向窦房结起搏样细胞转化。
1 材料与方法
1.1 材料
人尿路上皮细胞来源的hiPSCs U1细胞系(北京赛贝生物),Corning Matrigel(Life Sciences),m TeSR 培养基、糖原合成激酶3(GSK-3)抑制剂CHIR99021、β-catenin抑制剂(IWR-1-endo)IWR-1-endo ( 加拿大STEMCELL Technologies),Knock Out-DMEM、RPMI1640 培养基、含胰岛素B27、Versene 消化液、不含葡萄糖DMEM(美国Gibco),L-抗坏血酸2-磷酸倍半镁盐水合物(Sigma),人肾上皮细胞系293T 细胞、携带miR-375 inhibitor和GFP基因的慢病毒、GFP空载慢病毒(上海典君生物科技有限公司),Shox2兔抗、Nkx2.5兔抗、HCN4鼠抗、Isl1兔抗、肌钙蛋白T(c Tn T)抗体(美国Abcam 公司),Carido Easy 人心肌细胞消化液Ⅰ、Ⅱ(北京赛贝生物);Trizol试剂(Invitrogen);倒置荧光显微镜(Olympus),流式细胞仪(BD,FACSCalibur),电泳仪、电泳槽(北京六一仪器厂)。
1.2 方法
1.2.1 hiPSCs培养及向hiPSC-CMs分化 将hiPSCs U1 细胞系接种于包被有胚胎干细胞专用基质胶(Corning Matrigel)的6孔培养板,使用m TeSR培养基在37℃、5%CO2培养箱培养(美国Thermo),每天换液,当细胞汇合至约90%进行传代培养。将U1 细胞系接种于包被有基质胶的12 孔培养板准备分化,使用m TESR 培养基维持培养,当细胞汇合度为90% ~100%时开始分化,分化的前两天在基础分化培养基(RPMI1640+抗坏血酸+不含胰岛素的B27 +青链霉素)中加入10μmol/L GSK-3抑制剂CHIR 激活Wnt信号通路以促进细胞向中胚层分化,分化2 d后更换基础分化培养基维持培养,分化第3 d更换基础分化培养基并加入5 μmol/L IWR 抑制Wnt信号通路以促使中胚层细胞向心肌细胞富集分化,此后隔天更换基础分化培养基[7](图1)。

图1 hiPSCs向心肌细胞分化流程图
1.2.2 U1 细胞系向hiPSC-CMs分化效率的检测
于分化14 d后用CaridoEasy人心肌细胞消化液Ⅰ消化细胞4 min,再用消化液Ⅱ消化10 min,300 g离心10 min,弃上清后加入4%多聚甲醛混匀,室温固定30 min。离心后弃上清,加入适量封闭液重悬,4℃过夜。向封闭液中加入适量偶联荧光素的抗心肌肌钙蛋白T(cardiac troponin T,c Tn T-PE)抗体为CM-c TNT 组,阴性对照组不加c TNT-PE,轻柔均匀吹打,室温避光孵育1 h,离心后用400μL 的4℃预冷的PBS 重悬细胞,上流式细胞仪(BD,FACS Calibur)检测,运用FlowJo软件分析c TNT阳性率判断hiPSC-CMs分化效率。
1.2.3 r LV-ZsGreen-Puro-hsa-mir-375 inhibitor慢病毒的构建及扩增 通过Bam H I和Eco RI双酶切回收慢病毒骨架载体质粒p LVX-sh RNA2-Puro,设计并合成miR-375-inhibitor DNA 片段,将miR-375-inhibitor退火产物与质粒p LVX-sh RNA2-Puro回收大片段连接,得到目的质粒。将该质粒转化JM109感受态菌株,平板挑菌,送阳性克隆菌液去测序验证。将含有目的基因的慢病毒质粒p LVXZsGreen-Puro-has-miR-375 inhibitor导入293T 细胞,产生含目的基因的高滴度的慢病毒[8]。
1.2.4 r LV-ZsGreen-Puro-hsa-mir-375 inhibitor慢病毒转染及转染效率 iPSC 开始分化2 d后,分别以病毒感染复数(MOI)=0,10,20,50,80,100转染携带r LV-ZsGreen-Puro-hsa-mir-375 inhibitor的慢病毒,加入基础分化培养基使总体积为1 ml,混匀后置于37℃、5%CO2培养箱培养,感染24 h后,吸弃含病毒的培养液,继续正常分化过程(基础分化培养基+5μmol/L IWR)。感染后72、96 h通过荧光倒置显微镜(德国Leica)观察。96 h后将各感染细胞消化,用250 ul PBS重悬后于200目滤网过滤送检,应用流式细胞仪分析GFP阳性细胞率。选取引起细胞状态佳、死亡数目较少的最大MOI为最适MOI值。随机将细胞分为miR-375 组、GFP 组和Null组,各组分别以最适MOI转染携带miR-375抑制剂和绿色荧光蛋白(GFP)的慢病毒r LV-Zs-Green-Puro-hsa-mir-375 inhibitor(miR-375 组)和等量带GFP的空载慢病毒(GFP 组),Null组不进行病毒转染。于倒置显微镜下观察记录转染后每组细胞每分钟搏动次数并比较。
1.2.5 MiR-375、起搏细胞发育相关转录因子(Shox2、Nkx2.5、Isl1)、起搏相关离子通道超极化激活环核苷酸门控通道4 型(HCN4)m RNA 的检测
采用实时荧光聚合酶链式反应(qRT-PCR)检测病毒转染12 d 后细胞miR-375、Shox2、Nkx2.5、Isl1、HCN4 m RNA 的表达水平,以GAPDH 为内参。Trizol提取总RNA,分光光度计(TECAN)检测RNA 的纯度和浓度。cDNA 的合成体系:5×Reaction Buffer 4 u L,Oligo d T 1 u L,Enzyme Mix 1 uL,总RNA 1 ug,RNase free water加至20 u L;42℃30 min,85℃5 s;PCR 扩增仪(杭州柏恒)。使用SYBR Green I PCR试剂盒于PCR仪(Life Technologies)进行PCR,引物序列见表1。每个样品均作3个复孔,反应条件:95℃预变性30 s,95℃变性15 s,58℃退火10 s,72℃延伸30 s,共40个循环。

表1 qRT-PCR 各引物名称、序列及产物长度
1.2.6 起搏相关蛋白的检测 病毒转染12 d后,行蛋白质免疫印记(Western blot),加入适量的细胞总蛋白提取试剂裂解,冰浴30 min,1 200 g离心5 min,上清即为各组细胞总蛋白溶液,二喹啉甲酸法(BCA)测定蛋白浓度。十二烷基磺酸钠一聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后将蛋白转至PVDF 膜,5%脱脂奶粉封闭2h。GAPDH(1∶10000)、Shox2(1:1000)、Nkx2.5(1∶1000)、Isl1(1∶1000)、HCN4(1∶1000)一抗4℃孵育过夜,TBST 冲洗,用HRP 标记的二抗孵育1 h,化学发光法显影。各条带扫描后分析平均灰度值,以GAPDH 为内参计算各蛋白的相对表达水平。
1.2.7 GFP组和miR-375组Shox2及c TNT 表达的检测 在细胞转染病毒12 d后,将miR-375组和GFP组分化的心肌细胞消化后再接种于6 孔板制作细胞爬片,2~3 d后室温下用4% 多聚甲醛固定15 min,0.1% Triton X-100 破膜15 min,3%牛血清封闭30 min后分别加入Shox2或c TNT 的一抗(1∶200)4℃过夜,PBS洗涤3次,二抗室温避光孵育1 h,滴加4,6-二脒基-2-苯基吲哚(DAPI)室温核染10 min后,用抗荧光淬灭封片剂封片,于倒置荧光显微镜下观察。
1.3 统计学处理
采用SPSS 23.0 统计软件进行数据处理,计量资料采用均数±标准差(±s表示,两组间均数比较采用两独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异有显著性。
2 结果
2.1 hiPSCs培养及向hiPSC-CMs分化观察
传代培养24 h后镜下可见hiPSCs形成紧密的多细胞集落,具有清晰的边界,细胞间紧密堆积,具有高核质比,且核仁显著;约3~4 d后细胞汇合至约90%,可进行下一次的传代(图2)。hiPSC 成功向心肌细胞分化,在分化第7 ~9 d可在显微镜下观察到细胞微弱的收缩搏动,分化第14 d时可观察到心肌细胞成片稳定且明显的自发收缩搏动(图2E、F)。
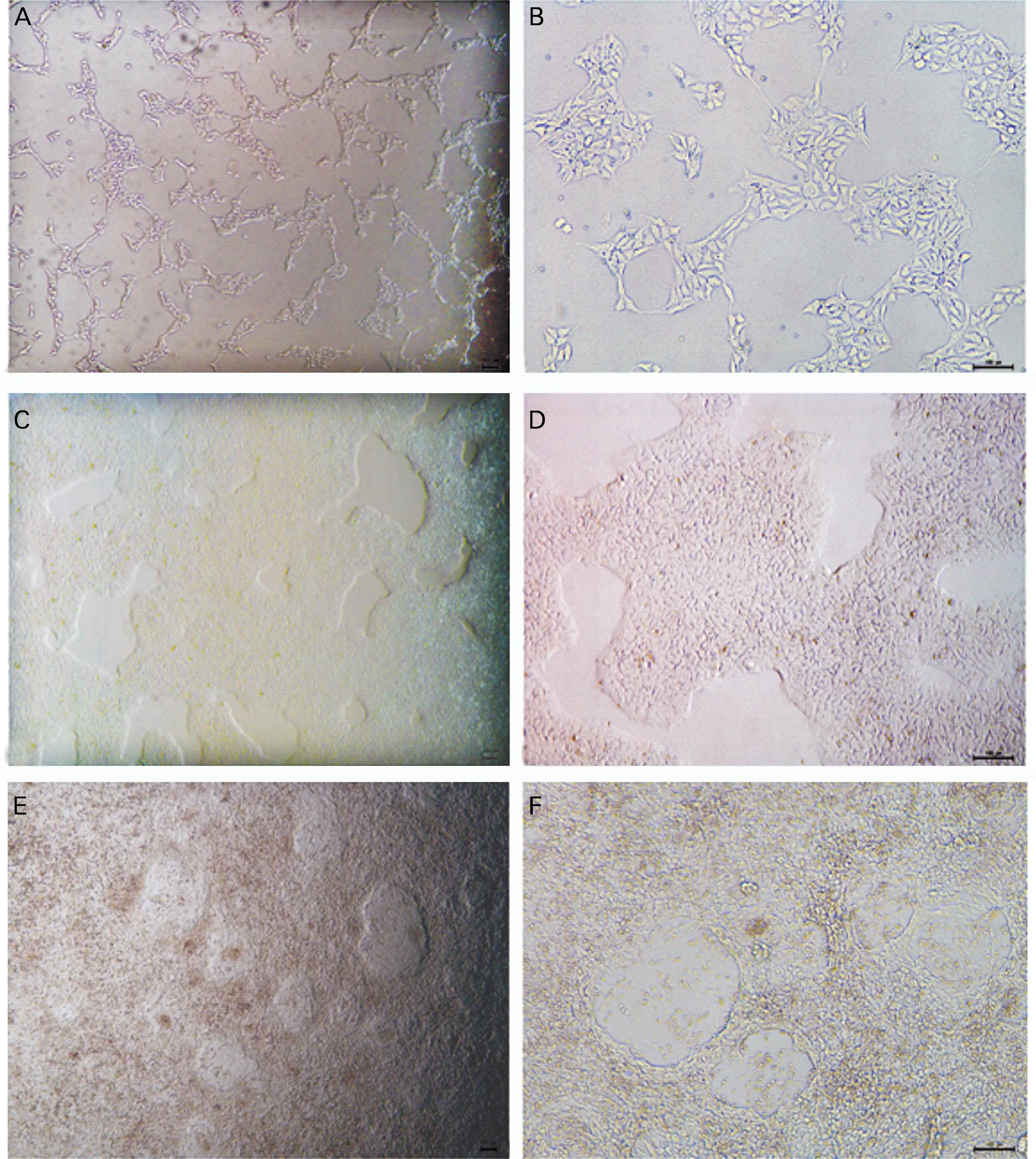
图2 hiPSCs形态及向hiPSC-CMs分化的观察
2.2 hiPSCs-CMs分化效率鉴定
hiPSC-CMs的c Tn T 阳性率为(85.0±4.1)%,即调控Wnt通路所得分化心肌细胞纯度接近90%(图3)。
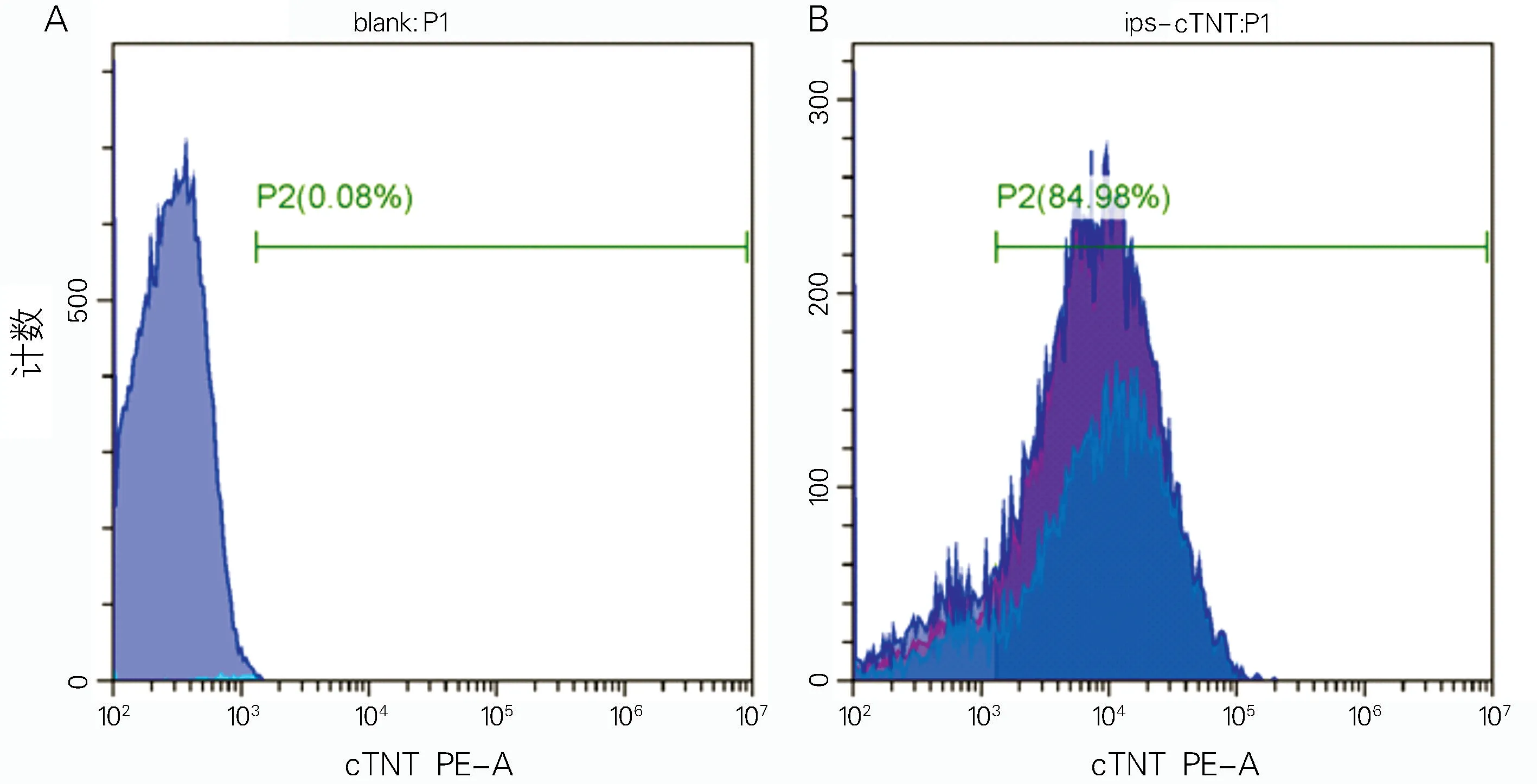
图3 流式细胞术检测hiPSC-CMs分化效率
2.3 病毒转染效率
病毒转染96 h后,在荧光显微镜下观察,MOI=50,80,100 绿色荧光较亮;MOI=10,20 绿色荧光较暗(图4)。当MOI=80时细胞状态较差,分化效率下降;MOI=100时细胞大幅度死亡,难以继续正常分化。结合流式检测病毒转染效率(表2)及病毒转染对细胞状态的影响,最终选用MOI=50为最适感染复数。于倒置显微镜下观察记录转染后细胞每分钟搏动次数,每组细胞记录6例,与GFP 组和Null组比较(P>0.05),miR-375 组搏动频率明显升高[(96±7)次/分vs(63±2)、(67±4)次/分,P均<0.05]。

图4 转染96 h后不同MOI值下绿色荧光蛋白的表达(×100)

表2 不同MOI值下病毒转染效率/%
2.4 三组MiR-375、起搏细胞发育相关转录因子(Shox2、Nkx2.5、Isl1)、起搏相关离子通道HCN4 m RNA 的检测
三组miR-375、起搏相关转录因子(Shox2、Nkx2.5、Isl1)及HCN4 m RNA 表达,GFP 组和Null组无明显差异(P>0.05),miR-375组Shox2、Isl1、HCN4表达水平明显升高,miR-375和Nkx2.5表达明显降低(P均<0.05),见表3。

表3 三组细胞miR-375及起搏相关基因m RNA 表达比较
2.5 三组起搏相关蛋白表达比较
三组起搏相关转录因子(Shox2、Nkx2.5、Isl1)及HCN4蛋白表达,GFP组和Null组无差异(P>0.05),miR-375 组Shox2、Isl1、HCN4 表达水平明显升高,Nkx2.5表达明显降低(P均<0.05),见图5及表4。

表4 三组细胞起搏相关蛋白表达比较

图5 3组起搏相关蛋白表达水平
2.6 GFP组和miR-375组Shox2及c TNT 表达的比较
倒置荧光显微镜下可见miR-375 组Shox2 蛋白发出红色荧光,而GFP组几乎未见表达(图6)。miR-375组及GFP组均可见c TNT 红色荧光表达,约占细胞总数80%以上(图7)。

图6 GFP组和miR-375组Shox2蛋白表达(×400)
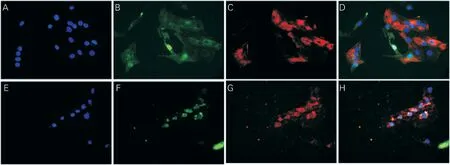
图7 GFP组和miR-375组c TNT 蛋白表达(×400)
3 讨论
iPSCs是由已分化的成体细胞经重编程诱导产生的一种干细胞类型,可以大量获得且能避免伦理学问题。运用疾病特异性iPSCs可以在体外诱导分化成针对自体的治疗细胞,目前已用于心血管疾病的药物筛选、分子基础模型研究、移植治疗等。不少学者研究发现,通过对hiPS细胞进行特定的诱导可以使其分化为各类心肌细胞[9-10]。Wnt信号通路是心脏发育的重要信号通路,在心肌分化中具有典型的双时相,经典通路表现为“先促后抑”,而非经典通路则在分化晚期通过抑制经典通路发挥促心肌分化的作用[11]。笔者通过阶段性调控Wnt信号通路以诱导iPSCs定向分化为hiPSC-CMs细胞,在体外模拟胚胎向心脏的发育过程,于此过程中提高起搏样细胞占比以期望成功构建生物起搏的细胞模型。
MiRNA 是一类非编码小分子RNA,其与特定靶m RNA 结合后通过抑制翻译或促进降解在转录层面进行基因表达的负调节,多种miRNA 已显示在心脏发育调控网络、心肌细胞特性、祖细胞分化迁移增殖和组织修复中发挥重要作用[3]。慢病毒可以整合到宿主细胞的基因中,更稳定的调控其靶点。本研究通过在中胚层时期转染r LV-ZsGreen-Purohsa-mir-375 inhibitor慢病毒,初步探讨了在体外诱导分化过程中通过抑制miR-375表达能增加hiPSCs向起搏样细胞的分化效率,观察到转染miR-375慢病毒后分化细胞搏动频率明显加快,从而为利用hiPS构建生物起搏的方案奠定基础。
Shox2是miR-375的直接靶标,其在心肌细胞中的表达具有较高的特异性,可以激活或参与多种转录因子的表达,从而提高窦房结细胞基因谱的表达。Shox2对窦房结发育的调控涉及Nkx2.5、Isl1、HCN4等多种基因间的多重调控和相互作用。本实验结果表明miR-375组Shox2 m RNA 和蛋白表达明显高于GFP组和Null组,GFP和Null组几乎无Shox2蛋白表达。Nkx2.5是工作心肌细胞相关基因之一,Shox2通过抑制其表达使起搏细胞不向心肌方向分化,从而维持窦房结的正常形态和功能[6]。本实验显示miR-375 组Nkx2.5 m RNA 和蛋白表达明显低于GFP 组和Null组。Isl是窦房结早期发育的标志蛋白之一,HCN4介导的起搏电流是起搏细胞4 期自动去极化的基础[12]。本实验证明miR-375组Isl1 和HCN4 表达明显升高。综上研究结果,起搏细胞在hiPSC 分化的心肌细胞中占比增加。另外笔者根据免疫荧光结果发现GFP 组和miR-375组的心肌细胞特异性标志物c TNT 蛋白的表达没有明显差异,且表达在80%以上,结合流式分析hiPSC-CM 分化效率大于80%及前期转染病毒实验结果,说明在合适的时间及MOI值下,慢病毒干预对iPSC正常分化为心肌细胞无明显影响。
笔者的研究结果初步说明通过抑制miR-375表达能使其修饰的hiPSCs在向hiPSC-CMs分化的过程中更高效地向起搏样细胞转化。但笔者尚未进行相关电生理检测,并且未来还需进一步的动物实验验证其构建生物起搏的有效性及安全性。

