高中化学解题中守恒法的运用研究
陈善佐
(甘肃省白银市景泰县第一中学 730400)
1 高中化学运用守恒法的概述
1.1 守恒法内涵
守恒法主要指依据化学反应当中的某个相应不变的量进行化学问题解答,其是高中化学具体计算过程中常用到的解题方法,以守恒法进行化学题的解答,通常要求学生能够准确的把握化学反应中物质内在的守恒关系.守恒法的优势就是不用对解题当中的相关细枝末节进行探讨,也不用对化学反应当中物质量的起始状态与最终状态进行考虑,通过对化学反应当中内在守恒关系进行直接把握,迅速构建起化学问题的求解公式,以此巧妙的实现对于化学题的求解.对于守恒定律而言,其通常存在于所有的化学反应当中,不论是反应的过程,还是反应物与生成物的质量总和及化合价的变化总数,是电荷总和,还是参与到反应物质的原子总数,都满足守恒规律,因此,需准确地把握化学反应过程的守恒定律,并在解题中形成事半功倍的解题效果.较为常见的守恒法通常有原子守恒、元素守恒、质量守恒、电子守恒、电荷守恒等,其都是在进行化学问题解决时的重要依据,需学生熟练掌握,以实现守恒法的灵活应用.
1.2 守恒法特点
对于守恒法而言,通过对其实施深入研究可知,守恒法通常具有简便性、广泛性、易理解的特征.第一,广泛性.能量、电荷、质量三个守恒定律属于世间万物都具有的规律,而就化学反应而言,不论经历多复杂的物质变化以及化学反应,其生成物和反应物的守恒规律都不能与三种守恒定律相违背,且反应之前与反应之后的能量、质量、电荷总和都不会出现改变,因此,守恒法在高中化学实际解题中得到了广泛应用.第二,简便性.对于高中的化学问题而言,其解答过程通常是极其严谨且复杂的,化学题的各种计算思路所使用的公式也都是不同的,高中化学的解题中应用守恒法,只要准确把控化学反应前后之间的守恒关系,就能促进相关化学问题的有效解决.第三,易理解.守恒法运用于高中化学的试题解决中,与其他的解题方法相对比,其在内容上更加简单,其表达形式也更容易被学生所理解.
1.3 守恒法解题技巧分析
第一,准确掌握质量守恒习题的解题技巧与方法.质量守恒需准确的把握住“生成物总量、反应物总量、原子种类、元素种类、质量、数目”等保持不变的原则,指定反应之后物质的种类即物质构成的分子种类必然是会出现改变的,而生成的分子总数也可能出现较大的改变.第二,准确掌握能量守恒习题的解题技巧与方法.对于能量守恒而言,其本质就是能量的转化性与传递性,其能够从一个物体逐渐转移至另个物体,也能由一种形式转变成另外一种形式,但却不可以凭空消失或者产生.对于能量守恒而言,其实际应用形式是盖斯定律,这通常需化学教师极其注意.第三,准确掌握电荷守恒习题的解题技巧与方法.电荷守恒的解题守恒等式的书写,需全部的找出溶液当中的相关阴阳离子,尤其是电离水解形成的新离子,或是水的电离,正确的判断出阴阳离子数之间的守恒,而并非是电荷守恒.第四,准确掌握电子守恒类习题的解题技巧与方法.根据电子守恒实施解题的时候,需依据化学反应的过程、明确电子数目、陈列等式关系等步骤实施计算,与传统化解题方式相比,不仅能实现解题流程的简化,而且还能实现解题准确率的提高.
2 高中化学解题中守恒法的运用
2.1 质量守恒法的运用
在守恒法中最基本的原理即质量守恒法,立足于宏观层面,指的是参与化学反应的各物质的质量总和与反应后生成的各物质的质量总和是相等的;立足于微观层面,指的是化学反应前后各元素数目、种类保持不变.
例1已知有A、B和C三种物质的混合物,其中,A物质30g,B物质15g,C物质10g,把三种物质的混合物放到封闭容器内加热,化学反应结束后,可知容器内存在A物质15 g,B物质26 g,以及物质D,要求对反应后生成物和反应物间的质量比进行计算.
解析已知题目中物质皆以符号表示,因此进行解题时学生很难结合题意列出对应化学方程式,导致加大解题难度.此时,通过质量守恒法的运用,可以帮助学生找到突破口.结合质量守恒定律,进行解题时只需让学生明白化学反应中的生成物、反应物、以及参加反应的各物质质量及生成的各物质质量分别是什么即可结合题目可知,A、C物质的质量减少,因此二者为反应物,前者参加反应的质量为30g-15g=15g,C质量10g.B、D质量得到增加,因此是化学反应生成物,B的生成质量即26g-15g=11g.结合质量守恒定律mA+mC=mB+mD,可得:15+10=11+mD,解出D质量14g,因此,反应中A、B、C、D的质量比为15∶11∶10∶14.
2.2 电子守恒法的运用
电子守恒即氧化还原过程中得失电子的守恒.电子并不会凭空产生或消失,只能在物质之间转移,因此失去电子的总和应等于得到电子的总和.
例2高温环境中硫酸铵的分解,生成NH3、SO2、N2、H2O,求反应中生成的氧化产物与还原产物的物质的量之比为?
解析该反应中,氧化产物为氮气,还原产物为二氧化硫,也就是说这道题实际上就是在求二氧化硫和氮气的物质的量比.氮气由硫酸铵中的氮变为氮气中的氮,总共失去6个电子,硫酸中的硫原子到二氧化硫中的硫原子,失去2个电子,鉴于得失电子守恒,可得二氧化硫和氮气的物质的量比为1∶3,因此这道题的答案就是1∶3.
在学生解题的过程中,通过电子守恒关系,能够使学生快速列出方程式,无须学生死记硬背,就能对相关题目产生更深刻地理解,同时还有利于学生对题目意思进行精炼提取,以此促进解题效率和准确性的提升.
2.3 原子守恒法的运用
原子守恒即反应前后,原子个数不变.
例3使适量浓硝酸与适量铜进行反应,铜被完全溶解后,得到了22.4mL的气体,在这一整个作用过程中,用到的硝酸物质的量为多少?已知铜的质量为38.4mg,气体存在标准状况下.
解析该题作为典型的运用原子守恒展开计算的试题,结合题目描述,和学生对硝酸与铜反应的掌握,可知整个反应过程中,硝酸与铜是参与反应的物质,生成物质包含硝酸铜和一氧化氮或二氧化氮,其中硝酸发挥着不同作用.
解析硝酸与铜产生反应时,部分硝酸起酸的作用生成硝酸铜,该过程中所用的硝酸物质的量为2n(Cu)=(38.4×10-3)÷64mol×2=1.2×10-3mol;剩余部分的硝酸发挥氧化作用,不论生成怎样的气体成分,都为硝酸的还原产物,因此该部分硝酸的物质的量为(22.4×10-3)÷22.4mol=1×10-3mol.所以,在整个反应过程中,共计消耗的硝酸的物质的量为1.2×10-3mol+1×10-3mol=2.2×10-3mol.
2.4 电荷守恒法的运用
电荷守恒法即电荷处于化学反应中不会发生改变或是被消灭.化学反应出现前后的电荷总量保持不变,在高中化学解题教学的过程中,通过电荷守恒法的应用,有利于帮助学生提高解题的效率,在采取电荷守恒法以后更具显著效果.
例4有硫酸钾、硫酸铝和硫酸所组成的混合溶液,其pH=1,铝离子的浓度为0.4mol/L,硫酸根离子的浓度为0.8mol/L,求钾离子的物质的量浓度为多少?
解析结合硫酸钾、硫酸铝和硫酸的化学式展开研究:将以上三种溶液混合到一起后,便可以对溶液中的硫酸根来源予以明确.确定溶液pH为1后,能够得知溶液中的c(H+)=1×10-1mol/L.然后,引导学生书写溶于溶液中的三种物质电离方程式:
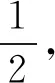
综上所述,在学生解答化学题目的过程中,结合已知条件及所求问题,实现对各种守恒定律的灵活应用,不仅可以帮助学生省去繁杂的化学计算和分析过程,减少计算时长,还可以帮助学生建立清晰的解题思路,引导学生对化学反应过程中参与反应物质的内在关系形成准确地掌握.

