油酸钠浮选体系下STPP对菱锰矿中方解石的抑制机理研究
迪里努尔阿不都卡得 何桂春 李少平 王亚莉 聂善煜 汪劲刚 肖 志
(1.江西理工大学资源与环境工程学院,江西 赣州 341000;2.江西省矿业工程重点实验室,江西 赣州 341000;3.新疆工程学院矿业工程与地质学院,新疆 乌鲁木齐 830000)
在现代工业生产中,锰金属及其化合物广泛应用于化工、农业、环保等众多领域[1-3]。然而随着常年的开采,优质锰矿和富锰矿在我国已经被列为紧缺矿种[4]。在此情况下,对现有难选锰矿的分选技术进行研究对锰行业的可持续发展具有重要意义。菱锰矿(MnCO3)是最主要的锰矿石之一,属碳酸盐类矿物,常与方解石(CaCO3)、菱镁矿(MgCO3)等碳酸盐类矿物共生嵌布[5]。由于菱锰矿及其伴生碳酸盐矿物均含有碳酸根阴离子,所以它们的晶体结构相同,造成表面性质十分接近,共存体系中矿物表面相互转化严重[6]。过去常采用阴离子型表面活性剂脂肪酸类及其衍生物作为捕收剂浮选微细粒级菱锰矿,这类捕收剂虽然具有较好的捕收性能,但是水溶性差、选择性不高、不耐低温、抗硬水能力弱、用量大,再加上常规方解石抑制剂的选择性较差,这些因素导致了菱锰矿与脉石矿物方解石难以实现高效浮选分离[7-9]。
菱锰矿和脉石矿物方解石的分离常采用正浮选工艺,即以脂肪酸及其衍生物或者组合捕收剂浮选菱锰矿,同时添加浮选抑制剂减少方解石的上浮[10]。但由于菱锰矿和方解石表面具有相同的钙离子活性质点,脂肪酸等捕收剂很难实现对菱锰矿的选择性浮选[11]。罗娜等[12]采用油酸钠作为捕收剂、六偏磷酸钠作抑制剂来探究菱锰矿和方解石的浮选分离效果,结果表明,单矿物体系中,菱锰矿和方解石的可浮性差异较大,说明六偏磷酸钠对二者浮选分离有利;人工混合矿浮选试验中,方解石表面向菱锰矿表面转化,使得二者难以分离。因此,寻找一种高效的抑制剂以实现菱锰矿的浮选分离势在必行。
抑制剂分为无机抑制剂和有机抑制剂[13-18],而在菱锰矿的浮选分离中,无机抑制剂的研究是一个重要的研究方向。故国内外研究者对方解石的无机抑制剂开展了大量研究[19-22],筛选出了具有较强选择性的抑制剂,如六偏磷酸钠、水玻璃、焦磷酸钠等,从而为选择性抑制方解石提供了一定的理论基础。
三聚磷酸钠(STPP)是一种无机物,也是金属离子良好的螯合剂,对钙、镁离子具有较好的螯合作用。此外,STPP还具有较好的分散性、浮化性及胶溶性,在对表面活性剂产生增效作用的同时还能调节pH值。尽管STPP在浮选中作为抑制剂的应用已有报道,但其在菱锰矿浮选体系中作为方解石抑制剂的研究却很少[10]。
本研究通过浮选试验、Zeta电位分析、红外光谱(FTIR)分析和X射线光电子能谱(XPS)分析研究了油酸钠体系下STPP作为抑制剂对菱锰矿和方解石浮选行为的影响,并探讨了STPP对两种矿物的作用机理,为菱锰矿与方解石的浮选分离研究提供理论支撑。
1 试验材料和试验方法
1.1 试验材料
试验所用菱锰矿和方解石纯矿物均来自于广东某矿物标本批发商行。经手选除杂后得到纯度较高的矿物,再用铁锤锤碎至-2 mm,经陶瓷球磨机磨细后筛分,粒径为0.074~0.037 mm的样品用于浮选试验,-5 μm的样品用于Zeta电位分析、FTIR及XPS分析。菱锰矿和方解石的XRD图谱分析结果分别如图1及图2所示,与标准卡片进行对比,矿物纯度符合试验要求。

图1 菱锰矿XRD图谱分析Fig.1 XRD diagrams of rhodochrosite
图2 方解石XRD图谱分析Fig.2 XRD diagrams of calcite
试验所用的三聚磷酸钠(STPP)为化学纯,捕收剂油酸钠(NaOL)和pH调整剂碳酸钠(Na2CO3)为分析纯,购自上海精细化工材料研究所和天津市北辰方正试剂厂,未经进一步提纯。所有试验过程中的用水均采用去离子水。
1.2 浮选试验
单矿物浮选试验在XFG-Ⅱ型挂槽浮选机中进行,叶轮转速为1 900 r/min,浮选槽容积为40 mL。称取2.0 g样品置于浮选槽内,加入去离子水30 mL并搅拌1 min,加入碳酸钠调节pH值后再添加抑制剂搅拌2 min,随后加入捕收剂搅拌3 min,刮泡3 min,将获得的泡沫产品和尾矿分别过滤、烘干及称重,计算出浮选回收率。
人工混合矿浮选试验同样在XFG-Ⅱ型挂槽浮选机中进行,叶轮转速为1 900 r/min,称取2.0 g混合矿样(菱锰矿与方解石的质量比为1∶1),加药方式和搅拌时间与单矿物浮选试验流程相同。对获得的泡沫产品和尾矿分别过滤、烘干及称重,通过化学成分分析测得精矿产品中的Mn品位并结合产率计算得到回收率。
增值税是对商品生产、流通、劳务服务中各个环节的新增价值或商品的附加值征收的一种流转税[5],与以商品劳务的全额为计税依据的营业税相比具有避免重复征税的优点。在增值税下,同一种商品劳务只要最终售价相同,不管经过多少流通环节,其总体税负都相同,从而有利于促进社会专业化分工,避免商品劳务在多环节流转中发生价格扭曲,提高服务业的竞争水平。
1.3 Zeta电位测试
使用Zeta-plus型电位测定仪对矿物添加药剂前后的Zeta电位进行测量,具体步骤如下:将-5μm的样品配制成质量分数为0.01%的矿浆溶液,用Na2CO3调节矿浆pH值并搅拌5 min;随后加入浮选药剂再次搅拌5 min后进行Zeta电位测试,每个测量点测3次然后取平均值。
1.4 红外光谱分析
红外光谱分析使用PerkinElmer Spectrum Two红外光谱仪进行测量,具体步骤为:将1 g粒径为-5μm的矿物样品和30 mL去离子水混合,加入药剂后在磁力搅拌器上搅拌1 h,然后过滤,滤渣用去离子水洗涤2~3次,放入真空干燥箱中低温烘干,得到待测样品。将待测样品与光谱纯级别的KBr按质量比1∶100混合,研磨均匀并压片,使用薄片进行FITR分析。
1.5 X射线光电子能谱分析
采用ThermoFisher K-Alpha型X射线光电子能谱仪进行XPS分析,具体步骤为:将-5μm的样品2.0 g和30 mL去离子水混合成均匀矿浆,加入STPP并搅拌2 h使药剂充分吸附在矿物表面。将矿浆过滤后,滤渣用去离子水冲洗2~3次并放入真空烘干箱低温烘干,最后将其用于XPS检测[11]。
2 试验结果与讨论
2.1 浮选试验
研究pH=10及不添加STPP情况下捕收剂NaOL用量对菱锰矿和方解石可浮性的影响,结果如图3所示。
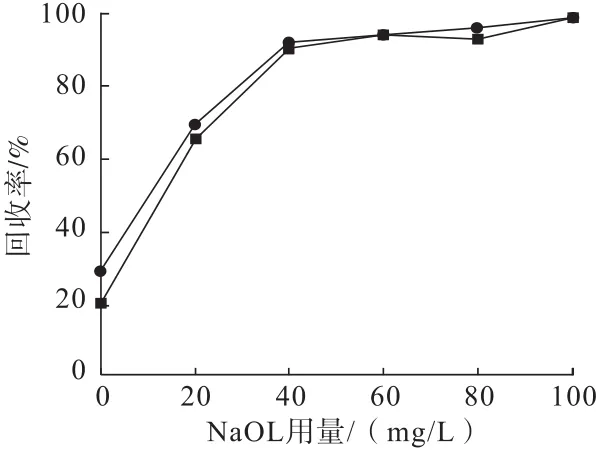
图3 NaOL用量对菱锰矿和方解石可浮性的影响Fig.3 Effect of NaOL dosage on floatability of rhodochrosite and calcite
从图3可以看出:随着NaOL用量的增加,菱锰矿和方解石的回收率均逐渐增加。当NaOL浓度达到40mg/L时,菱锰矿和方解石的回收率均达到相对稳定。此后,增加NaOL浓度对两种矿物浮选回收率的上升影响较小。结果表明,在不添加STPP情况下,菱锰矿和方解石的浮选行为相似,无法实现二者的有效分离。
固定NaOL用量为40 mg/L,STPP用量为40 mg/L,图4为添加及不添加STPP时pH值对菱锰矿和方解石可浮性的影响。

图4 有无STPP作用时pH值对菱锰矿和方解石可浮性的影响Fig.4 Effect of pH value on floatability of rhodochrosite and calcite in presence and absence of STPP
从图4可以看出:不添加STPP时,在pH值为7~11范围内,菱锰矿和方解石的可浮性均较好,此时菱锰矿和方解石之间的可浮性差异小,无法实现两者的分离;添加40 mg/L的STPP后,STPP在pH值为7~11时表现出对方解石明显的抑制作用,方解石很难上浮;而在pH值为8~11范围内对菱锰矿的抑制作用较小。添加STPP且在pH=10时,菱锰矿的浮选回收率依然达到82%左右,而此时方解石的回收率低于30%。因此,STPP可在pH=10时作为方解石的有效抑制剂。
图5所示为在pH=10、NaOL用量为40mg/L的条件下STPP用量对菱锰矿和方解石可浮性的影响。

图5 STPP用量对菱锰矿和方解石可浮性的影响FIg.5 Effect of STPP dosage on floatability of rhodochrosite and calcite
2.2 人工混合矿浮选试验
为了进一步验证STPP在菱锰矿浮选过程中对方解石的选择性抑制作用,进行了菱锰矿和方解石的人工混合矿(1∶1)浮选分离试验,在pH=10、NaOL用量为40 mg/L条件下,STPP用量对浮选精矿指标的影响如图6所示。

图6 STPP用量对人工混合矿浮选精矿指标的影响Fig.6 Effect of STPP dosage on flotation index of artificial mixed ore
从图6可以看出:在不添加STPP的情况下,浮选精矿中Mn的回收率及品位分别为88.76%和19.98%;添加20 mg/L的STPP后,浮选精矿中Mn的回收率及品位分别达到81.30%和36.45%,表明STPP可以在菱锰矿浮选过程中有效抑制方解石。
2.3 Zeta电位测试
在NaOL用量为40 mg/L的条件下,研究了pH值对添加或不添加20 mg/L的STPP时菱锰矿和方解石表面电位的变化,结果如图7所示。
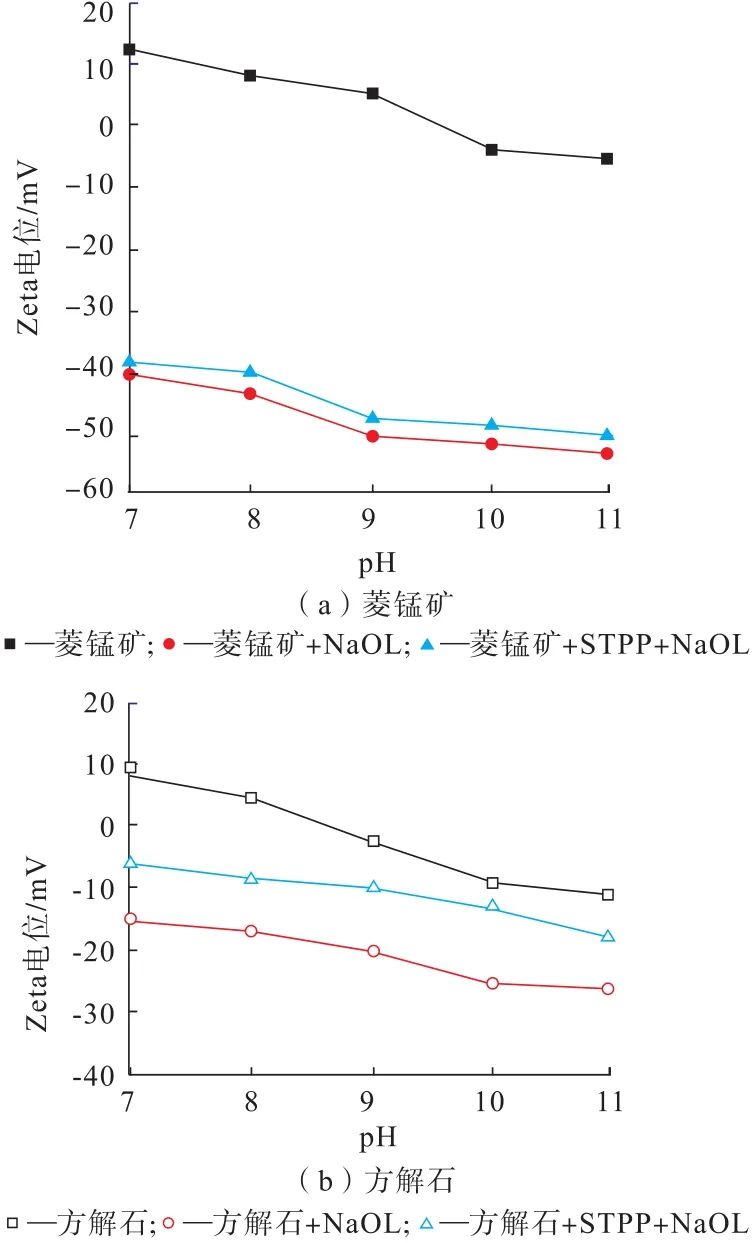
图7 有无STPP作用时pH值对菱锰矿和方解石表面Zeta电位的影响Fig.7 Influence of pH value on Zeta potential of rhodochrosite and calcite with and without STPP
从图7可以看出,菱锰矿和方解石的Zeta电位随pH值的增加而逐渐降低,其等电点(IEP)的pH分别为9.6和8.6,这与文献[10]报道一致。在不添加STPP条件下,随着pH值的增大,菱锰矿和方解石的Zeta电位发生了明显的变化,菱锰矿和方解石与油酸钠作用之后,其表面电位明显负移,动电位均降到零电点以下。研究结果表明,油酸根在菱锰矿和方解石表面发生了吸附,使菱锰矿和方解石表面为负电位。由此可以推断阳离子捕收剂油酸钠在菱锰矿和方解石表面还存在其他的吸附形式,如化学吸附。当添加STPP时,pH=10条件下菱锰矿的表面电位变化较小(从-50mV到-47mV),而方解石的表面电位变化较大(从-25 mV到-12.5 mV),说明STPP的添加进一步影响了NaOL在方解石表面的吸附,对菱锰矿的表面电位影响较小。由此可以推断,添加STPP对NaOL在方解石表面的吸附影响较大,阻碍了Na-OL在方解石表面的吸附。所以,STPP在方解石表面的优先吸附是其能够选择性抑制方解石的主要原因。
2.4 红外光谱分析
为了研究STPP对菱锰矿和方解石的作用机理,通过红外光谱探究了STPP与两种矿物间的吸附行为。如图8所示,2 846 cm-1和2 927 cm-1处分别为NaOL分子中甲基(—CH3)和亚甲基(—CH2—)的伸缩振动峰。1 567 cm-1和1 445 cm-1处为NaOL分子中羧基(—COO—)的伸缩振动峰。对于STPP而言,1 212 cm-1处为P=O基团的伸缩振动吸收峰,897 cm-1处为 P—O—P的对称伸缩振动峰,1 097 cm-1和488 cm-1分别为P—O键的反对称拉伸振动峰和对称拉伸振动峰。

图8 NaOL和STPP的红外光谱Fig.8 Infrared spectra of NaOL and STSP
图9所示为菱锰矿与药剂作用前后的红外光谱图。未经药剂处理的菱锰矿表面在1 414 cm-1处存在明显的非对称伸缩振动峰以及862 cm-1和721 cm-1处的面外和面内弯曲伸缩振动峰。仅添加NaOL时出现了NaOL分子中亚甲基和甲基的伸缩振动峰,原菱锰矿中的特征峰位置几乎没有发生变化,说明NaOL在菱锰矿表面发生了吸附。加入STPP后,5个特征峰的位置或强度均无明显变化。以上结果表明,经STPP处理后的菱锰矿红外光谱,与仅用NaOL单独处理的菱锰矿红外光谱相比,图谱基本一致,STPP对NaOL在菱锰矿表面的吸附干扰不大。

图9 经NaOL和STPP作用后菱锰矿的红外光谱Fig.9 Infrared spectra ofrhodochrosite treated with NaOL and STSP
图10所示为方解石与药剂作用前后的红外光谱图。未经药剂处理的方解石表面特征峰为709 cm-1、879 cm-1和1437 cm-1,分别为CO23-的非对称伸缩振动峰以及面内和面外伸缩振动峰。仅添加NaOL时在方解石表面出现了NaOL分子中甲基和亚甲基的伸缩振动峰,原方解石中的特征峰位置变化不大,说明NaOL在方解石表面发生了吸附。加入STPP后,NaOL分子中2 852 cm-1和2 923 cm-1位置的特征峰在方解石表面消失。此外,方解石表面出现了STPP分子中 488 cm-1、1 008 cm-1、1 058 cm-1和1 158 cm-1位置的特征峰。以上结果表明,STPP的添加阻碍了NaOL在方解石表面的吸附。因此,STPP在方解石表面的优先选择性吸附是抑制方解石可浮性的主要原因。

图10 经NaOL和STPP作用后方解石的红外光谱Fig.10 Infrared spectra of calcite treated with NaOL and STSP
2.5 X射线光电子能谱分析
菱锰矿和方解石表面暴露的金属原子不同,但都是阴离子捕收剂作用的活性位点[23]。所以为探究STPP在两种矿物表面的吸附方式,通过XPS分析揭示STPP在菱锰矿和方解石表面上的竞争吸附机理。图11所示为NaOL体系下添加STPP前后菱锰矿Mn 2p和方解石Ca 2p的XPS光谱图。
从图11(a)可以看出,菱锰矿的Mn 2p峰出现在657.99、653.76、646.19 和 641.99 eV。 仅添加NaOL时(图11(b)),在菱锰矿表面出现了NaOL的3个新峰,同时菱锰矿Mn 2p1和Mn 2p3轨道的Mn离子结合能出现了偏移,表明NaOL在菱锰矿表面发生了明显的吸附。STPP作用后(图11(c))菱锰矿表面的光谱与仅添加NaOL的光谱基本相同。虽然菱锰矿的Mn 2p的结合能的位置发生了偏移,但这个变化小于化学作用所导致的偏移(≥0.20 eV)[24-26],因此STPP在菱锰矿表面的吸附方式属于物理吸附。如图11(d)所示,方解石表面的Ca 2p窄区间扫描图谱出现的峰位结合能350.55和346.99 eV,分别对应的是Ca 2p1和Ca 2p3。当未添加STPP(图11(e))时,方解石Ca 2p1和Ca 2p3轨道的Ca离子结合能均发生了-0.21和-0.22 eV的偏移,表明未添加 STPP时,方解石表面的钙离子发生了化学变化。在随后的添加STPP处理(图11(f))中,峰值的数量没有变化,而Ca 2p的结合能Ca 2p1和Ca 2p3在方解石矿物表面上转移-0.21和-0.24 eV,因此,STPP与方解石之间存在较强的化学相互作用,Ca是STPP与方解石互相作用的活性位点。这与红外光谱和Zeta电位测试的分析结果一致。
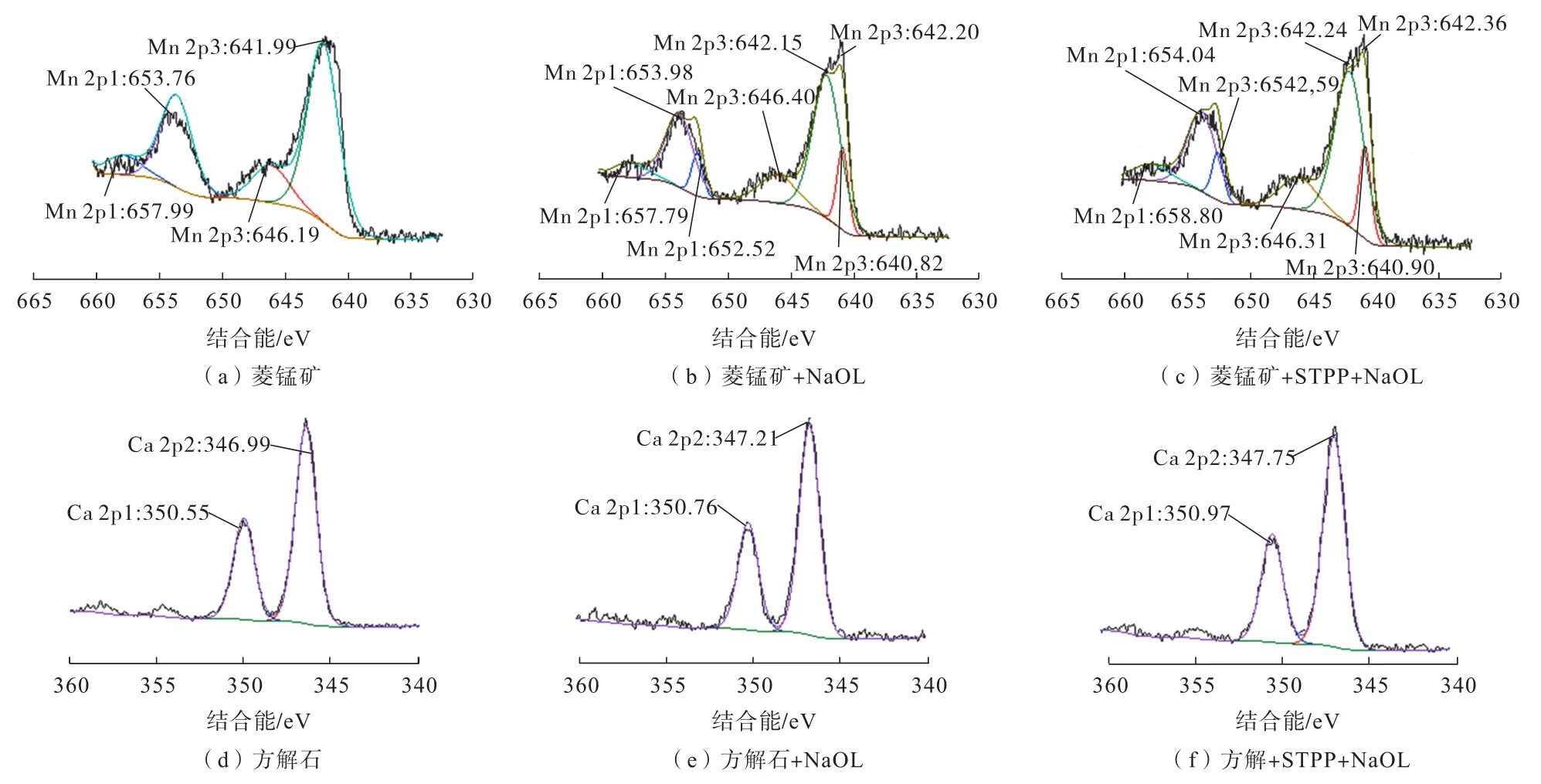
图11 有无添加STPP时菱锰矿和方解石的XPS光谱分析Fig.11 XPS spectra of rhodochrosite and calcite with or without STPP
3 结 论
(1)在pH=10的条件下,使用20 mg/L的STPP作抑制剂可以实现菱锰矿和方解石的浮选分离。
(2)添加抑制剂STPP后,STPP在菱锰矿和方解石表面均发生吸附,但其在方解石表面的吸附能力明显强于在菱锰矿表面的吸附能力。因此,STPP存在对方解石的选择性抑制作用。
(3)Zeta电位、红外光谱和X射线光电子能谱分析表明,STPP在方解石表面上的吸附作用强于Na-OL,其阻碍了NaOL在方解石表面上的进一步吸附,从而实现对方解石的选择性抑制作用。

