抗癫痫药布立西坦制剂研究进展
闫森,张国丽
(1.昆明医科大学,云南昆明650100;2.昆药集团股份有限公司,云南昆明650100)
癫痫是一种慢性脑部疾病,是脑内神经元高度同步化放电而引起的暂时性脑功能失常[1‑2],俗称“羊角风”或“羊癫风”。目前,我国癫痫患病率较前有所增高[3]。癫痫发作会影响患者日常工作和生活,主要表现为运动、感觉、自主神经、意识等精神障碍,记忆力受损、注意力降低、智力下降等认知功能障碍,还有焦虑、抑郁等情绪障碍[4],长期、频繁的发作对患者的身心产生严重影响,亦可使患者遭受意外伤害。
自从1912年出现第1个治疗癫痫的药物苯巴比妥之后,抗癫痫药物发展较快。目前,抗癫痫药物可以分为3 代:①传统抗癫痫药物,包括苯妥英钠、卡马西平和丙戊酸钠等;②现代抗癫痫药物,包括奥卡西平、左乙拉西坦和加巴喷丁等;③新型抗癫痫药物,包括布立西坦、卡拉博沙、瑞替加滨和吡仑帕奈等[5]。临床上常用的治疗药物有苯妥英钠、苯巴比妥、扑米酮、卡马西平、丙戊酸钠等。布立西坦的上市是对部分发作性癫痫的辅助治疗的一种新补充,特别是对于使用一种或多种其他辅助治疗未能充分控制癫痫发作的患者。
1 布立西坦原料药的性质
布立西坦(Brivaracetam),又名布瓦西坦,是左乙拉西坦的衍生物。布立西坦能够与中枢突触囊泡蛋白2A(SV2A)进行较强的选择性、可逆性结合,通过影响突触功能发挥抗癫痫作用;以及抑制电压依赖性钠离子通道,减少痫性放电的持续时间和频率,从而减少癫痫的发作[6]。
与前代药物相比,布立西坦的副作用较轻微,在所有关键试验中耐受性良好,大多数不良反应程度为轻度到中度,常报告的不良反应是嗜睡、头晕、疲劳等,精神认知方面的副作用发生率相对较低[7‑8];具有更好的安全性和耐受性,有效提高患者生活质量[9]。
根据2015年11月19日欧洲药品管理局(European Medicines Agency,EMA)评估报告,布立西坦是一种新的活性物质,外观性状呈白色至灰白色的不吸湿结晶固体,在生理酸碱度范围内极易溶于水介质,也溶于极性有机溶剂,具有高渗透性,因此被标记为BCSⅠ类药物。布立西坦有晶型i和晶型ⅱ2 种晶型,制备之后仅产生所需的晶型i,晶型ⅱ是非极性有机分子的溶剂化物;稳定性研究表明,晶型ⅱ在片剂生产过程中部分形成,且溶解迅速;因此晶型不会影响成品的溶出特性,也不会影响生物利用度。根据ICH指南,原研厂家提供了23个生产批次的布立西坦的稳定性数据:分别考察了这些批次样品在长期条件下(25 ℃/60%相对湿度)储存在商业包装中36 个月,在中间条件下(30 ℃/65%相对湿度)储存12个月,在加速条件下(40 ℃/75%相对湿度)储存6 个月时,产品外观(固体和溶液)、含量、有关物质、水分和微生物含量等指标,还对用于注射/输注溶液的几批布立西坦进行了细菌内毒素检测;结果显示所有检验数据都在合格范围内,表明布立西坦具有稳定性[10]。
2 布立西坦在各国的上市产品
2.1 欧盟
布立西坦原研制剂由比利时优时比(UCB)制药公司开发,于2016 年1 月22 日在欧盟获准上市[11],商标名为Briviact,目前上市的剂型有片剂、口服液和注射剂,各种剂型均以布立西坦为活性物质。布立西坦原研制剂的一般情况详见表1。
布立西坦薄膜衣片的辅料主要有交联羧甲基纤维素钠、一水合乳糖、β‑环糊精、无水乳糖和硬脂酸镁等片芯材料和聚乙烯醇、二氧化钛(E171)、聚乙二醇3350、滑石粉和氧化铁(E172)等包衣材料;口服溶液由琥珀色玻璃瓶(第三类)包装,主要辅料有柠檬酸钠、无水柠檬酸、对羟基苯甲酸甲酯(E218)、羧甲基纤维素钠、三氯蔗糖山梨糖醇液、甘油(E422)、覆盆子香精和纯化水;注射液用硅化溴丁基橡胶塞包装在玻璃瓶(类型1)中,外加铝/聚丙烯可撕密封瓶盖,主要辅料由三水醋酸钠、冰醋酸、氯化钠和注射用水组成;所有的辅料都符合欧洲药典或内部标准[11]。
在欧盟上市的薄膜衣片有5 种规格(10、25、50、75、100 mg),全部为速释剂型[10],各种剂型通过不同的包衣颜色进行区分,具体性状见表1。片剂生产过程包括5 个主要步骤:①将布立西坦和颗粒内赋形剂进行预混;②干法制粒;③加入外加崩解剂和赋形剂进行混合;④压制成片芯;⑤薄膜包衣。该过程被认为是标准制造过程,已经证明该工艺能够生产出预期的成品。根据ICHQ6A 标准,可以使用崩解试验代替溶出度试验,在片剂的各种稳定性研究中,未观察到性状、含量、有关物质、崩解时限等检验标准的明显变化。

表1 布立西坦原研制剂相关信息Table 1 Information of the original formulation of brivaracetam
为了满足吞咽有困难的患者,原研厂家开发了一种非无菌口服溶液,生产过程包括4 个主要步骤:①将活性物质和赋形剂溶解于纯化水;②过滤;③灌装;④封口。通过强制降解研究,布立西坦口服液对热稳定,但在强酸、强碱或强氧化剂条件下不稳定;进行了3周热循环研究,在-20 ℃和40 ℃/75%相对湿度之间,未观察到性状、含量、有关物质、崩解时限等检验标准的明显变化。
原研厂家还开发了一种供注射的无菌无防腐剂溶液,选择赋形剂以产生稳定的缓冲溶液,并加入NaCl调节渗透压。为了提供合适的渗透压特性,对处方组成进行了优化。注射剂制造过程包括6 个主要步骤:①溶解原料药和赋形剂,并调节pH;②过滤;③灌装;④封口;⑤终端灭菌;⑥可见异物检查。通过对制备的样品进行影响因素试验、加速试验、强迫降解研究、热循环研究等稳定性试验,结果表明布立西坦注射液对热稳定,但在酸、碱或强氧化剂存在下不稳定。
2.2 美国
在美国Food and Drug Administration(FDA)的官方网站上显示,2016年2月18日,布立西坦的5种规格的片剂在美国被批准作为处方药用于16 岁及以上患者部分发作性癫痫的辅助治疗。根据FDA 报告显示,用于口服给药的布立西坦片剂的辅料成分与欧洲上市产品相同;用于口服液的非活性成分有柠檬酸钠、无水柠檬酸、对羟基苯甲酸甲酯、羧甲基纤维素钠、三氯蔗糖、山梨糖醇溶液、甘油、覆盆子香精和纯化水;用于注射剂的非活性成分有醋酸钠(三水合物)、冰醋酸(用于调节pH至5.5)、NaCl、注射用水,均与欧盟上市的产品相同。经查FDA 溶出法数据库,推荐布立西坦片的溶出方法为:使用Ⅱ型桨,转速50 r/min,溶出介质pH6.4磷酸盐缓冲液;5种规格都使用900 mL介质;取样时间分别为5、10、15、20、30 min。
2.3 中国
根据国家药品监督管理局(National Medical Produts Adminstration,NMPA)进口药品目录显示UCB布立西坦所有原研制剂未在中国境内上市,目前也没有医药企业获得布立西坦仿制药生产资格。2019 年6月国家卫健委发布《关于第一批鼓励仿制药品目录建议清单的公示》[12],共涉及34 个品种,布立西坦名列其中。
根据药品注册与受理数据库显示,布立西坦国内企业仿制药申请情况见表2,布立西坦中国申请进口情况见表3。根据中国临床试验数据库,布立西坦中国临床试验数据见表4。

表2 布立西坦中国申请仿制药情况Table 2 The application of generic drugs of brivaracetam in China
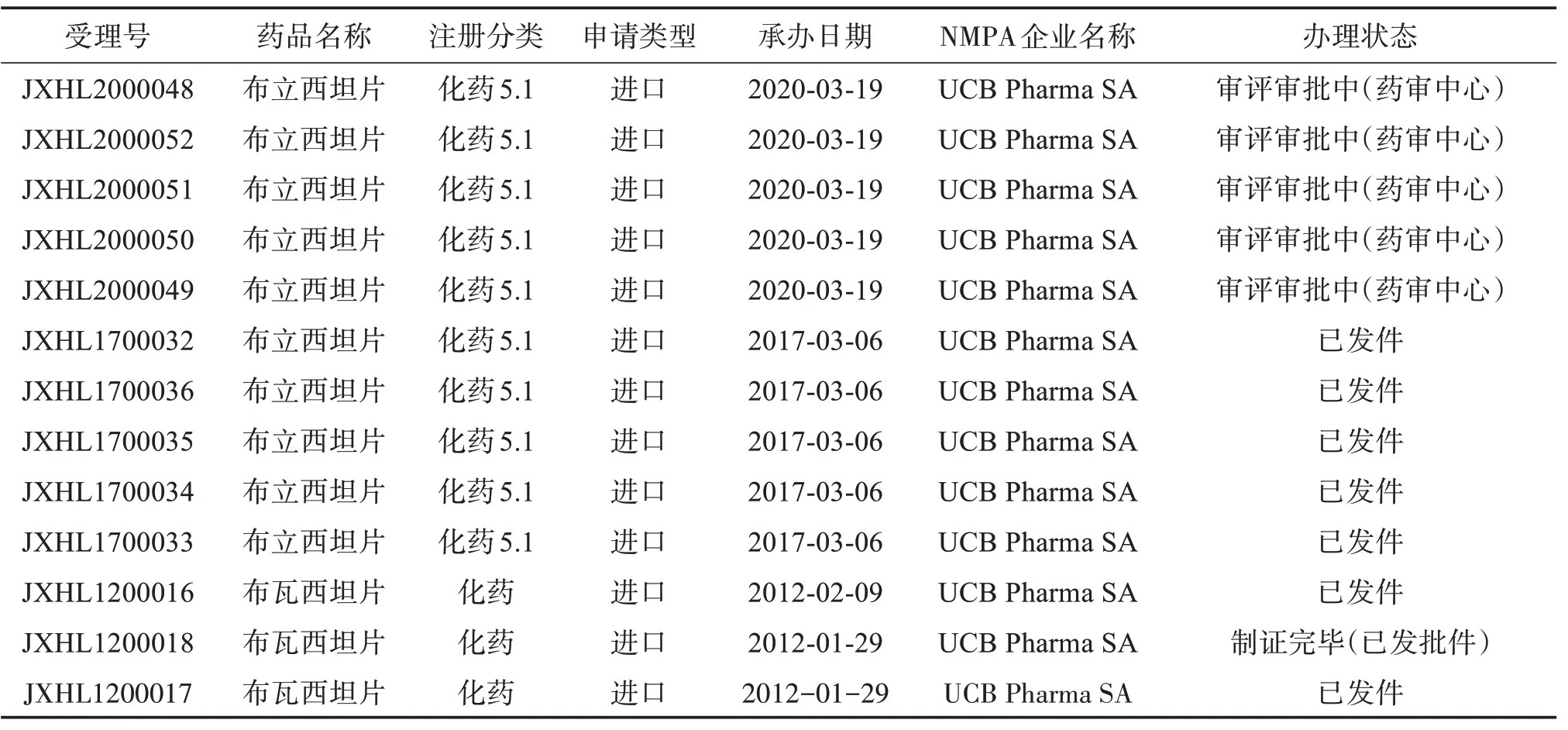
表3 布立西坦中国申请进口情况Table 3 The application for import of brivaracetam in China
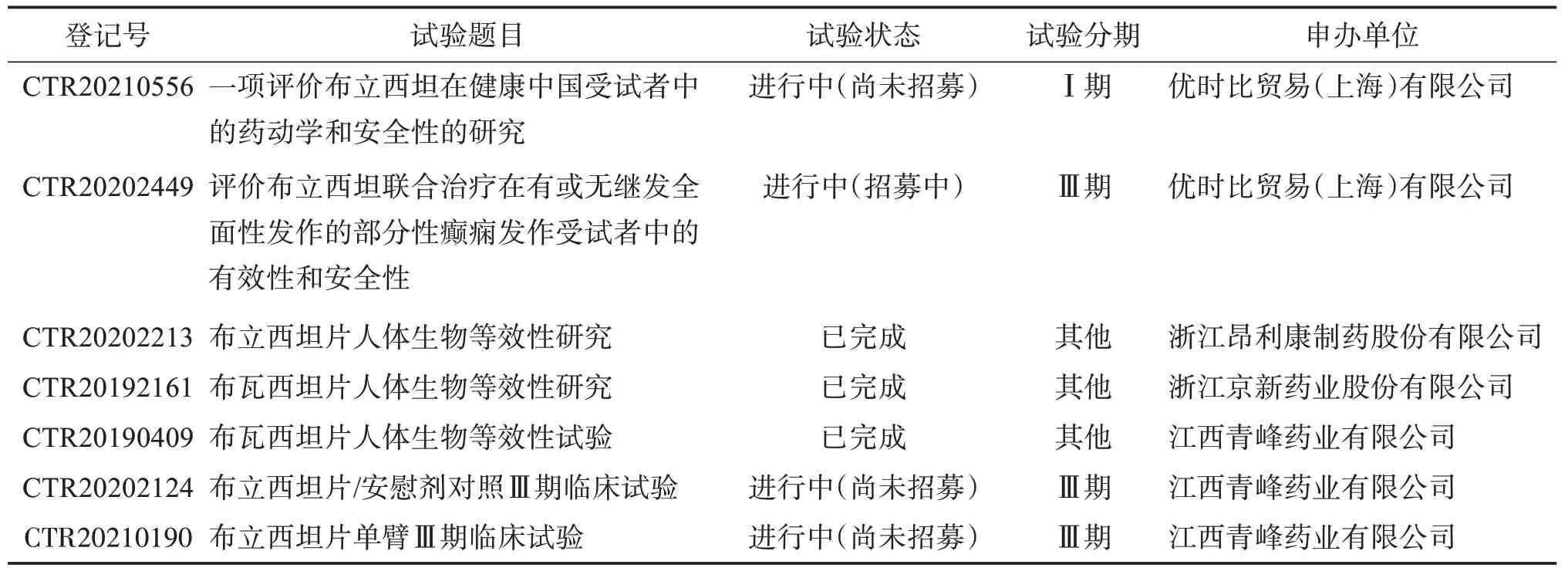
表4 布立西坦中国临床试验数据Table 4 Clinical trial data of brivaracetam in China
2.4 其他
通过查询日本药品和医疗器械评价中心(http://www.nihs.go.jp/pmdec/outline.htm)、俄罗斯公共卫生部(http://www.minzdrav‑rf.ru/)和韩国食品药品管理局(http://www.kfda.go.kr/)网站,以及其他国家相关网站,均没有布立西坦的相关上市信息。
3 布立西坦在研产品
3.1 速释片剂
目前,上市的布立西坦剂型片剂最多,片剂具有剂量准确、容易携带运输、服用方便、稳定性高、生产成本低等特点。原研专利是在活性成分布立西坦中加入处方量的内加辅料干法制粒后,再加入外加辅料混匀后进行压片得到素片,最后用包衣液在盘式包衣锅或者气体混悬包衣锅中进行包衣得薄膜包衣片。布立西坦原研专利中发明了一种含β‑环糊精的布立西坦药物组合物,经干法制粒压片得到布立西坦速释片剂,β‑环糊精的作用是干法制粒赋形剂[13]。安晓霞等[14]提供了一种布立西坦速释制剂组合物,包括布立西坦和药学上可接受的辅料;该组合物的粒径分布为:D10≤100 μm、50 μm≤D50≤250 μm,且200 μm≤D90≤600 μm;该组合物适合直接压片法制备布立西坦速释制剂,可以解决干法制粒过程中粘滚轮和颗粒可压性差的问题,制备的布立西坦片比原研制剂具有更好的稳定性、释放特性和渗透性,适合大规模生产。
3.2 缓控释制剂
将布立西坦制备成缓控释制剂,可避免血药浓度峰谷产生的副作用,并且给药次数减少,提高患者的顺应性。严洁等[15]为了使布立西坦达到和国外制剂接近的溶出效果,对原料布立西坦利用高压气流粉碎进行气流粉碎之后按照普通的制剂工艺制粒压片或者灌胶囊,经过试验对比,和原研制剂最终释放效果最接近,所制备的片剂30 min 的释放度在20%以内,16 h 能达到96%以上。布立西坦在高温条件下是稳定的,但是当高温和高湿同时存在时会降解并吸收水分,因此对于药物组合物的研究是一个热点方向。Fanara等[16]发明了一种以左乙拉西坦、布立西坦或硒代曲坦为活性成分的药物组合物,在微丸丸芯上先包一层含有药物的活性成分层,然后再用水分散体进行控释膜包衣;所制备的包衣控释微丸在1 h 内释放度不超过30%,4 h释放约45%~75%,在16 h 之后释放达到80%以上。UCB 公司的发明专利《包含布立西坦的药物组合物》涉及了一种包括布立西坦的缓释药物组合物,制得的缓释制剂在16 h 溶出达到89%[17]。Kasu 等[18]发明了一种布立西坦或其衍生物的控释药物组合物,该组合物包括片芯和包衣层,其中片芯包括布立西坦或其衍生物,包衣层为疏水释放控释膜;该组合物在使用USP溶出Ⅱ型搅拌桨、50 r/min和37 ℃的900 mL pH 值为6的磷酸盐缓冲液中测量时,在7~24 h 内布立西坦溶出度至少为80%。舒欣等[19]提供了一种压制药物片芯、半透膜包衣液包衣增重和激光打孔释药组成的布立西坦控释片制备方法,目的在于控制药物释放,减少日给药次数,以理想的日推荐剂量给药。
3.3 其他剂型
布立西坦由于新上市,对于其制剂研究屈指可数,除研究相对较多的速释片剂和缓控释制剂之外,其他剂型研究比较少见。兴业股份有限公司发明涉及布立西坦或其药学上可接受的盐、酯、溶剂、衍生物、酰胺、多晶型、对映体、前体、类似物、活性代谢物或其混合物的速释药物组合物;此发明还涉及一种制备固体口服布立西坦组合物的方法,为解决诸如使用环糊精等技术挑战提供了方法;按此发明制备的布立西坦的环糊精组合物具有理想的制剂属性[20]。有文献报道了一种含布立西坦的组合物,以(2S)‑2‑([4R)‑2‑氧代‑4‑丙基四氢‑1H‑吡咯‑1‑基]‑丁酰胺(布立西坦)作为活性成分,组合物中还含有一种或多种含葡萄糖单元的寡糖,该组合物中活性成分在较长期间内保持稳定[21]。UCB 制药有限公司还将布立西坦和乳糖胺组成药物组合物,在治疗癫痫的同时具有协同的抗惊厥作用[22],这也是布立西坦制剂的一种新的研究方向。陈亮等[23]发明一种布立西坦口崩片的制备方法,使用冷冻干燥技术制得的布立西坦颗粒,以此压制而成的布立西坦口崩片具有良好的崩解性能和口感。司俊仁等[24]使用口服液常规工艺,提供一种制备工艺简单、服用方便、起效快、稳定性好、能提高病人服用顺应性的布立西坦口服液,具体工艺为:①保温甘油溶解防腐剂;②纯净水溶解助悬剂及pH调节剂;③溶解矫味剂。
4 总结与展望
布立西坦属于BCSⅠ类药物,在理论上很容易制备口服制剂,但是由于结构中含有在高温和高湿条件下易水解的酰胺结构,导致布立西坦口服制剂发展受到制约。因此,可以试图通过以下的研究方向来实现突破:①修饰布立西坦官能团来改善其易水解特性;②布立西坦不良反应较轻微,因此也可以研发布立西坦缓控释制剂,保持稳定的布立西坦血药浓度,在一定程度上可以阻止患者疾病症状的发作;③制备布立西坦脑靶向制剂,通过修饰药物组合物或者其他物理化学方法增加药物组合物的脂溶性和靶向性,可以使药物的血脑屏障透过能力增加,从而达到降低剂量,并且更精准的控制癫痫;④国内对于布立西坦的黄种人药动学相关研究并不是很详细,利用国内医疗平台尽快开展更多的临床试验也刻不容缓;⑤众所周知,目前西药只能控制癫痫症状,不能根治,研究布立西坦和中药的联合用药也可以更好地控制癫痫[25]。
当前各国对于布立西坦的研究还不充分,包括制剂和临床试验方面,自从2016 年原研制剂在欧盟和美国上市至今没有仿制药能够上市。本文主要对布立西坦各国上市情况以及制剂研究方面进行综述,通过了解布立西坦原研制剂的相关情况,为其仿制药的研究提供参考。

