MicroRNA-138-5p靶向KLF11抑制小鼠海马组织神经炎症
崔媛 宋鸿涛 张培 尹霄 王莹 魏萱
目前,糖尿病(diabetes mellitus,DM)患者的数目逐年递增[1,2]。大量研究证据表明,DM都会引起中枢神经系统病变,即为糖尿病认知功能障碍(diabetes-associated cognitive decline,DACA),严重者甚至会发展成为痴呆,并且认为DM是导致DACA的独立危险因素[3]。DACA的发病机制较为复杂,包括氧化应激、神经炎症、Aβ沉积、神经营养缺乏、血脑屏障破坏等,然其具体机制尚待阐明。因此,明确DACA的病变机制已经成为科研和临床关注的首要任务。研究发现,在T2DM认知障碍患者血清中的炎性因子白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、C-反应蛋白(C-reactive protein,CRP)、白介素-1(interleukin-1β,IL-1β)水平均明显高于不存在认知功能障碍的糖尿病患者[4],并且有实验证实IL-1β、IL-6、TNF-α等炎性因子有促进β淀粉样蛋白(β-amyloid peptide,Aβ)沉积的作用,影响认知功能[5]。亦有报道发现,炎性因子可上调β-分泌酶(β-site APP cleaving enzymes,BACE)的水平,导致淀粉样蛋白前体(amyloid protein precursor,APP)增多,加速Aβ的沉积[6]。在糖尿病合并阿尔茨海默病的大鼠模型中,糖基化终产物的受体(receptor of AGE,RAGE)的上调使中枢血管炎性反应加重,从而损害认知功能[7],可见神经炎性反应在DACA的发生发展过程中发挥重要的作用。microRNAs (miR)是一类小分子非编码RNA,在各种炎性疾病的过程中发挥重要的调节作用[8]。已有证明,人类大脑中富集的miRNAs存在发育阶段特异性、组织特异性和细胞特异性的表达特征,并在神经系统的发育和认知过程中发挥关键作用[9]。最近,多项证据表明miRNAs参与了亨廷顿舞蹈病、神经管缺陷和阿尔茨海默病等多种疾病的发生[10]。基于全基因组转录测序,Gibbons等[11]证明了miRNAs和lncRNAs是精神分裂症发病过程中的重要贡献者。另外,有研究证明miR-155-5p通过正反馈调节激活NF-κB通路诱导小胶质细胞的炎性反应,进而引发神经炎性病变,影响认知功能[12],但是miRNAs在DACA中的作用及分子机制尚不明确。同时,我们前期工作提示,姜黄素具有改善糖尿病小鼠认知障碍的功能[4-6]。本研究拟探讨测序中的候选miR-138-5p作为研究对象,明确其在糖尿病认知功能障碍小鼠神经炎性中的作用。
1 材料与方法
1.1 材料 Curcumin (MCE公 司,HY-N0005); 链脲佐菌素(STZ,美国 Sigma 公司);TNF-α、 IL-1β抗体(Proteintech公司),miR-138-5p mimics,miR-138-5p inhibitor脂质体(上海吉玛公司)。
1.2 DM小鼠模型建立 8周雄性C57BL/6J小鼠40只,体重(20~25) g,随机分为正常对照组(n=10)、模型组(n=15)、Curcumin治疗组(n=15)3组。除正常对照组外,均采用高脂喂养4周,空腹12 h 后,腹腔注射STZ 60 mg/kg,继续高脂喂养2周,定期测小鼠血糖和体重,接连两周检测小鼠血糖>11.1 mmol/L[8]及小鼠出现葡萄糖耐量异常[9]时,证明DM模型建立成功。然后Curcumin治疗组连续给药2周/d。给药期间,全部小鼠常规饲料饲养。
1.3 微阵列分析 提取4~8 μg海马组织的miRNA富集RNA用于miRNA微阵列,应用MiRNA微阵列技术分析不同基因型间的差异表达miRNAs。
1.4 细胞的培养 BV-2细胞在含10%胎牛血清(FBS)的α-MEM完全培养基中,置 37℃、5%CO2的培养箱中生长,每2~3天传代1次,所有实验所用细胞均取处于对数生长期的细胞。
1.5 细胞转染 实验分为以下4组(1)miR-138-5p组,加入miR-138-5p mimics和脂质体。(2) miR-138-5p inhibitor组,加入miR-138-5p inhibitor和脂质体。(3)NC对照组,加入NC 100 nmo1/L和脂质体。(4)空白对照组,无任何转染。以2×105/孔接种于6孔板,37℃、5%CO2培养过夜;转染前2 h,收集六孔板细胞, 加入无血清 1640 培养基;转染步骤:①用 250 μl无血清 opti-MEM 分别稀释 RNA(按照说明书用 DEPC 水配置成 20 μmol/L溶液)。②使用前轻轻混匀LipofectamineTM2000,然后取8 μl的LipofectamineTM2000 稀释在 opti-MEM 中,室温下静置5 min。③室温下静置5 min后,混合 LipofectamineTM 2000 和 RNA 的稀 释液(总体积为 500 μl)。每个培养孔加入混合液 500 μl混匀。
1.6 荧光定量PCR(qRT-PCR)检测 取收集处理后的细胞,加入1 ml TRIzol试剂及200 μl氯仿提取总RNA,Nanodrop 定量仪检测RNA的浓度和纯度。按照Invitrogen qRT-PCR的M-mlV第一链合成系统说明书制备cDNA。以U6为内参在ABI7500 Fast 中进行扩增以检测各组miR-138-5p和TNF-α、 IL-1β mRNA的表达水平。扩增引物由上海生工公司合成。反应条件:50℃预处理2 min,循环1次;95℃预变性10 min,循环1次;95℃变性15 s,循环40次;60℃退火30 s,循环40次;72℃延伸30 s,循环40次。各组均设3个复孔。以2-ΔΔCt法表示各目的基因的相对表达量。见表1。

表1 引物序列
1.7 Western Blot检测 收集细胞,加入RIPA细胞裂解液提取细胞蛋白。BCA法测定细胞总蛋白浓度。各孔取30 μg蛋白上样,于10%聚丙烯酰胺凝胶电泳进行蛋白分离(浓缩胶90 V电压,30 min;分离胶120 V电压,90 min)。将分离后的蛋白电转移(200 mA电流35 min)至PVDF膜。加入5%脱脂奶粉室温封闭2 h。分别加入兔抗人KLF5和鼠抗人β-actin单克隆抗体(体积稀释比例均为1∶1 000)4℃反应过夜。次日先以TBST洗膜5次,每次10 min。后加入HRP标记的鼠抗兔或兔抗鼠IgG(体积稀释比例为1∶20 000),室温反应1 h。再用TBST洗膜5次,每次10 min。按ECL试剂盒说明进行显影。
1.8 双荧光素酶报告实验 在24孔培养板中接种细胞,将重组的野生型或突变型载体和miRNA共转染细胞,放置在CO2培养箱中培养24 h后,检测荧光素信号。
1.9 统计学分析 应用GraphPad 8.0软件进行单因素方差分析比较各组差异。
2 结果
2.1 DACA和正常对照组小鼠海马组织中miRNA芯片表达 差异表达谱的比较结果显示DACA和正常对照组小鼠海马组织中18个miRNA显著变化,其中13个miRNAs显著上调(P<0.05),5个miRNAs显著下调(P<0.05),其中miR-138-5p降低最为显著(Fold change值=-1.28)。见表2。
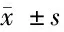
表2 对照组和模型组小鼠海马中的 miRNAs差异表达分析
2.2 DACA和正常对照组小鼠海马组织中miRNA和TNF-α和IL-1β的表达 为了验证芯片分析的准确性,挑选变化最显著的7个miRNAs,进行qRT-PCR分别进行结果验证。qRT-PCR的结果显示,表达水平miR-355-3p、miR-200b-5p、miR-31a-3p和miR-146a-3p在DACA模型组中表达上调,miR-138-5p、miR-181b-5p和miR-653-3p表达下调,表明验证的miRNAs的变化与芯片结果一致。同时检测到TNF-α和IL-1β在DACA组中的mRNA表达水平显著高于正常对照组(t=6.102,3.648,P<0.05),考虑到miR-138-5p的表达在DACA模型组小鼠海马组织中表达明显减少,接下来,我们选择miR-138-5p作为靶定miRNA,研究其在DACA中的作用及分子机制。见表3、4。
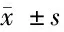
表3 小鼠海马miRNA表达谱的变化
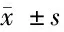
表4 对照组和模型组小鼠海马TNF-α和IL-1β的mRNA的表达变化
2.3 miR-138-5p的作用靶点 使用miRNA靶点预测网站TargetScan网站预测miR-138-5p的作用靶点,结果显示KLF11与miR-138-5p之间存在潜在的相互作用。KLF11 mRNA (pMir-KLF11 3’UTR-WT)和突变KLF11 3’UTR的mRNA (pMir- KLF11 3’UTR-MUT),采用荧光素酶报告基因方法检测。将pMir-KLF11 3’UTR-WT和pMir-KLF11 3’UTR-MUT与miR-138-5p mimic或NC mimic(模拟阴性对照)共转染到293T细胞中。双荧光素酶素报告基因结果显示miR-138-5p mimic和pMir-KLF11 3’UTR-WT共转染组荧光素酶活性显著低于NC mimic和pMir-KLF11 3’UTR-WT的荧光素酶活性(t=5.00,P<0.01)。然而,miR-138-5p mimic和pMir- KLF11 3’UTR-MUT共转染组没有显著性差异荧光素酶活性的变化(t=0.50,P=0.64)。说明miR-138-5p 可以通过结合其3’UTR直接调控KLF11的表达。见图1,表5。

图1 miR-138-5p与KLF11 3’UTR中的结合位点
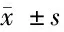
表5 荧光酶素报告基因检测miR-138-5p与KLF11的作用
2.4 转染miR-138-5p mimic后BV-2细胞中LPS诱导的促炎TNF-α、IL-1β因子的mRNA和蛋白水平变化情况 转染miR-138-5p mimic抑制了BV-2细胞中LPS诱导的促炎TNF-α、IL-1β因子的mRNA和蛋白水平。qRT-PCR结果显示,与对照组LPS+NC相比,LPS+miR-138-5p mimic组中TNF-α、IL-1β因子的mRNA显著降低(P<0.01),western blot结果显示与对照组LPS+NC相比,LPS+miR-138-5p mimic组中上述促炎因子蛋白水平也显著降低(P<0.05),说明miR-138-5p mimic可以抑制LPS诱导的促炎因子的表达。见表6,图2。
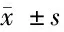
表6 荧光定量PCR技术检测miR-138-5p mimic转染后TNF-α和IL-1β的mRNA的表达变化

图2 Western blot技术检测miR-138-5p mimic/inhibitor转染后TNF-α和IL-1β的蛋白的表达变化
2.5 转染miR-138-5p inhibitor后BV-2细胞中LPS诱导的促炎TNF-α、IL-1β因子的mRNA和蛋白水平变化情况 转染miR-138-5p inhibtor促进了BV-2细胞中LPS诱导的促炎TNF-α、IL-1β因子的mRNA和蛋白水平。qRT-PCR结果显示,与对照组LPS+NC相比,miR-138-5p inhibtor组中TNF-α、IL-1β因子的mRNA显著增加(P<0.001),western blot结果显示与对照组LPS+NC相比,miR-138-5p inhibtor组中上述促炎因子蛋白水平也显著升高(P<0.01),说明miR-138-5p inhibtor可以促进LPS诱导的促炎因子的表达。见表7。
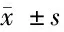
表7 荧光定量PCR技术检测miR-138-5p inhibitor转染后TNF-α和IL-1β的mRNA的表达变化
3 讨论
本研究评估了miR-138-5p在糖尿病小鼠海马神经炎症和认知损伤中的作用,证实了miR-138-5p在小鼠海马中的表达显著降低,首次证明了miR-138-5p在神经炎症和认知功能损伤中的作用。
研究证明神经炎症与认知障碍有关,在糖尿病合认知障碍中尤为重要。临床前调查显示,海马神经炎症导致记忆功能障碍的原因如下:(1)海马区与记忆任务[13]有关;(2)海马神经炎症水平高低与海马神经记忆功能障碍严重程度相关[14,15];(3)海马神经炎症导致长期的脑电位中断[16,17]。近年来,有研究证明肿瘤坏死因子-α在海马体中炎症和认知能力下降的过程中发挥重要作用。例如,TNF-α介导的信号通路在神经炎症中的作用会导致老年大鼠认知功能障碍,并伴有促炎细胞因子,包括TNF-α, IL-1β, IL-6的显著升高,而在脑内R-7050,TNF-α受体拮抗剂,其通过抑制下游NF-κB和MAPK信号通路的激活途径,以导致上述促炎细胞因子的减少,进而改善老年大鼠认知功能下降[18]。此外,TNF-α也发挥神经调节作用功能,特别是在调节小胶质细胞和星形胶质细胞大脑的激活[19]。例如,TNF-α通过诱导IL-6的释放,促进BV-2小胶质细胞的活化[20]。Terrando等[21]证明TNF-α作用于上游IL-1β,并启动外周细胞因子级联反应导致认知能力下降。
MiRNA是微小RNA分子,约由19~25个核苷酸组成,属于非编码RNA,miRNA主要与转录后的mRNA相结合来调控细胞代谢活动。一个miRNA可以与数百个mRNA结合,使mRNA降解或抑制其翻译过程,来影响基因的表达和代谢通路作用。miRNA结合的mRNA一般通过以下步骤被沉默:(1)结合后使mRNA链断裂;(2)破坏其多聚A尾端结构使mRNA稳定性下降,易被降解;(3)使mRNA翻译的效率降低[22,23]。miRNA已被发现参与了多种疾病的病理生理机制,包括肿瘤、过敏性疾病、心血管疾病、神经退行性疾病等。例如,在阿尔茨海默病(AD)中,在AD患者的海马和额叶内侧回中发现miR-125b表达显著上调[24]。 此外,在人类原代星形胶质细胞中,miR-125b也被证明能抑制表达干扰素调节因子4(IRF4)与补体因子-H蛋白(CFH),参与促炎症反应的因子反应[25]。此外miR-146a也被报道可以通过负反馈调节人星形胶质细胞介导的炎症反应[26]。现如今miRNA已成为新的潜在的生物标记物的研究方向。一个理想的生物标记物必须是特异性的,高度敏感的,并且可以定量,以非侵入性检查最佳,还要求成本低并且操作简单。然而,miRNAs在糖尿病诱导海马神经炎症中的作用和认知能力的作用还未明确,为了进一步明确miR-138-5p在DACA中的作用及分子机制,使用miRNA靶点预测网站TargetScan网站预测miR-138-5p的作用靶点,结果显示miR-138-5p可以结合KLF11的3’UTR。
细胞生长抑制蛋白Kruppel样因子11(KLF11),也称为转化生长因子-β-诱导型早期基因2(TIEG2),是Sp1/KLF锌指转录因子家族的成员之一,参与调控葡萄糖的摄取与代谢、脂质代谢、胰岛素分泌等一系列代谢相关基因的表达。体外实验学结果显示KLF11蛋白在额叶皮质和海马中的表达显著增加,但在纹状体和下丘脑中未检测到KLF11表达的显著变化,表明KLF11蛋白表达受慢性应激的选择性影响,而糖尿病诱发的认知功能障碍正是高血糖的慢性刺激对海马组织诱导的炎性病变[27]。除此之外,有研究者发现 KLF11 同样参与了神经细胞分化过程,并在高度分化的人星形胶质细胞中与P300 相互作用,上调多巴胺 D2 受体活性,影响到精神分裂症、帕金森氏病等疾病的发生发展过程[28],并且研究表明KLF11还是A型单胺氧化酶的转录激活因子,KLF11可以通过SP1结合位点增加脑A型单胺氧化酶的表达,KLF11过表达进而增加A型单胺氧化酶基因表达和酶活性;而由si-RNA介导的KLF11敲除能降低A型单胺氧化酶基因表达和酶活性,并在与应激相关的抑郁障碍中发挥重要作用[29]。综上,KLF11 作为一个广泛表达的转录因子,其下游靶分子众多,在不同的组织器官中发挥着不同的生物学功能。
本研究的局限性在于,明确了miR-138-5p在糖尿病诱导海马神经炎症中的作用和认知能力的作用,以及对KLF11的结合作用,对于KLF11是否有直接的调控作用是下一步的研究重点,目前的研究是一个试点研究,另外将包括miR-138-5p对糖尿病认知功能障碍小鼠的治疗的应用以及对小鼠海马神经炎症与认知行为改变的体内研究部分也是需要进一步研究的内容。

