氧固醇结合蛋白OSBPL3调节胃癌细胞的自噬和迁移
屈雅萍,林 琼
0 引 言
自噬是一种高度保守的、溶酶体介导的对细胞内自噬底物进行降解的过程,对于调节细胞代谢和能量的更新有重要作用[1]。而自噬水平的异常则会破坏细胞内稳态,导致包括肿瘤在内多种疾病的发生[2]。自噬既能抑制早期肿瘤发生又可促进肿瘤发展,其中自噬与肿瘤迁移的关系十分密切[3]。微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3, MAP1LC3,简称LC3)家族参与了自噬体的生物发生和运输,作用于自噬体双层膜的延伸和招募自噬蛋白到自噬体,在自噬过程中具有非常重要的作用[4]。
氧固醇结合蛋白样蛋白3(Oxysterol-binding protein like protein 3,OSBPL3)是氧固醇结合蛋白(Oxysterol-binding proteins,OSBPs)家族中的一员,该家族由12个成员组成,多数成员定位于内质网膜与其他细胞器膜紧密相连的膜接触位点(Membrane contact sites,MCSs)[5]。有证据表明OSBPs与细胞迁移和癌变有关,肿瘤或癌细胞中各种OSBPs的水平在mRNA或蛋白水平上发生改变,表明这些蛋白在肿瘤发生过程中发挥作用,并且有报道称OSBPL3在某些白血病和胰腺癌等恶性肿瘤中高表达[6]。OSBPL3作为一种脂质感受器和脂质转运蛋白(lipid transfer protein,LTP),主要功能除了调节脂质代谢、囊泡运输之外还在细胞信号通路传导、细胞骨架结构调节方面起作用[7-9]。本研究以OSBPL3蛋白为研究对象,旨在探讨其对胃癌细胞自噬和迁移的影响,为胃癌尤其是转移性胃癌的临床治疗提供新的分子靶点。
1 材料与方法
1.1 材料
1.1.1 细胞和细胞培养人肾上皮细胞(HEK293),人胃癌细胞(AGS),HEK293细胞和AGS细胞在37 ℃,5% CO2培养箱中用含10%胎牛血清的DMEM高糖培养液培养。
1.1.2抗体和试剂抗体:myc抗体购于镇江新津生物有限公司;HA抗体购于美国圣克鲁斯公司;mTOR抗体、P-mTOR抗体、p70S6K、P-p70S6K均购买于美国Thermo公司;辣根过氧化物酶标记的羊抗鼠二抗购于上海生工生物有限公司。试剂:pCDNA3-myc-OSBPL3 质粒、表达 LC3 与谷胱苷肽巯基转移酶(glutathione-S-transferase,GST)融合蛋白(GST-LC3)的菌液、 pGEX-4T1(GST)和pGEX-LC3(GST-LC3)质粒与protein A beads均为本实验室长期保存。质粒DNA小量抽提试剂盒、PCR产物纯化试剂盒、胶回收试剂盒均购于上海生工生物有限公司;转染试剂、异丙基硫代半乳糖苷(IPTG)购于镇江新津生物有限公司;限制性核酸内切酶购于日本TaKaRa公司; GSH琼脂凝珠购于美国Sigma公司;SDS购于南京生兴生物有限公司;30%丙烯酰胺、Tris-HCL购于上海Sangon公司;TEMED、蛋白marker、β-巯基乙醇均购于美国Thermo公司;PVDF膜购于美国Millipore公司;ECL曝光液购于上海碧云天公司;胎牛血清、DMEM高糖培养液购于美国HyClone公司。
1.2方法
1.2.1 质谱分析AGS胃癌细胞中的LC3结合蛋白首先将GST(对照)和GST-LC3细菌融合蛋白分别纯化。将表达 GST 与 GST-LC3 融合蛋白的菌液分别扩增 12~16 h,加入0.25 mmol/L IPTG继续培养3~5 h诱导蛋白表达。超声裂解细菌后,在4 ℃离心机中以离心半径15 cm、离心速度12 000 r/min 离心 15 min,获得融合蛋白上清。将GSH标记的琼脂凝珠分别与GST和GST-LC3融合蛋白上清液共同孵育3~5 h,制备成GST和GST-LC3琼脂凝珠。将 GST-LC3 融合蛋白亲和固化在 GSH 标记的琼脂凝珠上,获得 GST-LC3 琼脂凝珠。实验设置3个对照:GSH 琼脂凝珠与AGS细胞裂解液为空载对照, GST-LC3琼脂凝珠与哺乳动物细胞裂解液为缓冲液对照,GST琼脂凝珠与 AGS细胞裂解液为融合蛋白对照;GST-LC3 琼脂凝珠与AGS细胞裂解液作为实验组。孵育 3~5 h后用哺乳动物细胞裂解液清洗3~4次,加入适当比例的SDS samplebuffer,100 ℃煮沸 10 min,离心后取上清液用SDS-PAGE 分离,考马斯亮蓝染色后获得特异性目的条带,由北京博奥晶典有限公司进行质谱分析。
1.2.2GSTpull-down实验检测OSBPL3与LC3间的相互作用在HEK293T细胞中转染pCDNA3-myc-OSBPL3质粒,48 h以后进行细胞蛋白提取;将纯化后的GST和GST-LC3琼脂凝珠分别与转染了myc-OSBPL3的细胞蛋白共同孵3~5 h,用细胞裂解液清洗3~4次去除未结合的细胞蛋白。琼脂凝珠按比例加入SDSsample buffer混匀,100 ℃煮沸10 min使蛋白变性,制成样本。通过SDS-PAGE分离,湿转法将聚丙烯酰胺凝胶上的蛋白转移至PVDF膜,GST 与GST-LC3 融合蛋白部分的凝胶用考马斯亮蓝染色10~20 min。PVDF膜用1% 牛血清白蛋白溶液 37 ℃封闭 1 h。加鼠抗人myc抗体(1∶3000稀释)4 ℃摇床孵育过夜; TBST 洗膜 3 次; 加HRP标记的羊抗鼠二抗(1∶10 000稀释),37 ℃孵育 1 h; TBST 洗膜 3 次; ECL化学光显色,经凝胶成像系统拍照,记录结果并分析。
1.2.3免疫共沉淀实验检测OSBPL3与LC3的相互作用在HEK293T细胞中共同转染pCDNA3-myc-OSBPL3和pCDNA3-HA-LC3,转染48 h后提取细胞蛋白。在2个的预冷EP管中加入20 μL 50% proteinA beads悬液,分别加入HA抗体和myc抗体,然后加入已裂解的细胞蛋白,混匀后放置4 ℃摇床旋转孵育3~5 h。孵育结束后在4 ℃离心机中以离心半径15 cm、离心速度12 000 r/min 离心 15 min,弃上清,用细胞裂解液洗proteinA 珠子4次,与5×SDS samplebuffer按比例混匀后煮沸10 min。样本经过Western blot和转膜,使用化学发光仪显影拍照,用于后续结果分析。
1.2.4采用分子克隆与慢病毒感染技术构建OSBPL3过表达胃癌细胞株构建稳定过表达质粒Fuw-myc-OSBPL3,模板质粒pcDNA-myc-OSBPL3以及对照质粒Fuw-m2rtTA已由江苏大学医学院2507实验室前期构建并长期保存。使用已构建的质粒进行慢病毒包装,将收取的Fuw-myc-OSBPL3及Fuw-m2rtTA慢病毒颗粒感染AGS胃癌细胞,得到OSBPL3过表达胃癌细胞株及对照细胞株。
1.2.5Western blot检测OSBPL3过表达胃癌细胞自噬水平的变化及对mTOR信号通路的调节收取构建好的OSBPL3过表达胃癌细胞蛋白,同时将表达Fuw-m2rtTA的细胞作为对照。收取的蛋白经SDS凝胶电泳分离,分别用myc抗体、LC3抗体、mTOR抗体、P-mTOR抗体、p70S6K抗体、P-p70S6K抗体及actin抗体blot,显影后用于后续分析。
1.2.6小室迁移实验检测OSBPL3过表达胃癌细胞株的迁移能力取 OSBPL3 过表达胃癌细胞株及对照细胞株,胰酶消化后,室温37 ℃ 1000×g离心 5 min 弃去培养液,用 500 μL PBS 洗细胞 1~2 次,以完全去除血清的影响。用无血清 DMEM 培养基重悬细胞,并将细胞密度调整为 2×105个/mL。在 24 孔板中加入 500 μL 含 FBS 的 DMEM 完全培养基,同时实验组加入 EGF 处理。用镊子将小室放进 24 孔板,取 200 μL细胞悬液加入小室的上层。37 ℃、5%CO2培养 24 h后取出transwell小室,用棉签小心擦去小室内部未迁移的细胞,PBS 洗 2 遍,用棉签轻轻擦掉上层未迁移细胞,甲醛固定 30 min,小室自然风干后用 0.1% 结晶紫染色 30 min,用 PBS 洗 3 遍。用棉签轻轻擦掉上室水分,风干后,在显微镜下观察并计数迁移的细胞,用成像系统拍照。

2 结 果
2.1 质谱鉴定胃癌 AGS 细胞中的 LC3 相互作用蛋白研究发现GST-LC3的共沉淀蛋白中含有OSBPL3,见表1。表明OSBPL3可能是LC3结合蛋白。
2.2OSBPL3与LC3相互作用GST-LC3 pulldown结果显示,与 GST 对照组比较,GST-LC3 实验组从细胞裂解液中沉淀出OSBPL3蛋白。考马斯亮蓝染色显示,GST 与 GST-LC3 融合蛋白表达水平基本一致。我们在 HEK293T 细胞中共表达myc-OSBPL3和 HA-LC3 进行免疫共沉淀实验,使用标签抗体myc和HA 作为捕获抗体,分别沉淀LC3以及OSBPL3。蛋白免疫印迹结果显示,OSBPL3 和myc-LC3 均能被互相沉淀下来,但在空载对照中没有观察到特异性的条带。见图1。

表 1 质谱鉴定的GST-LC3 部分共沉淀蛋白
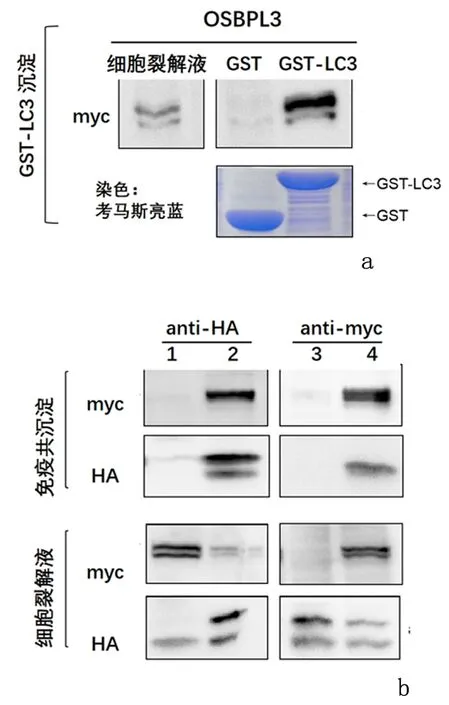
1:myc-OSBPL3; 2:HA-LC3+myc-OSBPL3; 3:HA-LC3;4:myc-OSBPL3+HA-LC3
2.3OSBPL3通过抑制p70S6K的活性激活胃癌细胞的自噬我们利用慢病毒表达系统成功构建 OSBPL3 过表达 AGS 胃癌细胞株,在OSBPL3过表达的AGS细胞中,LC3的表达明显上调,同时我们发现核糖体蛋白激酶p70S6K的磷酸化明显下调,而mTOR作为p70S6K的上游分子,其磷酸化水平并没有明显变化,见图2。
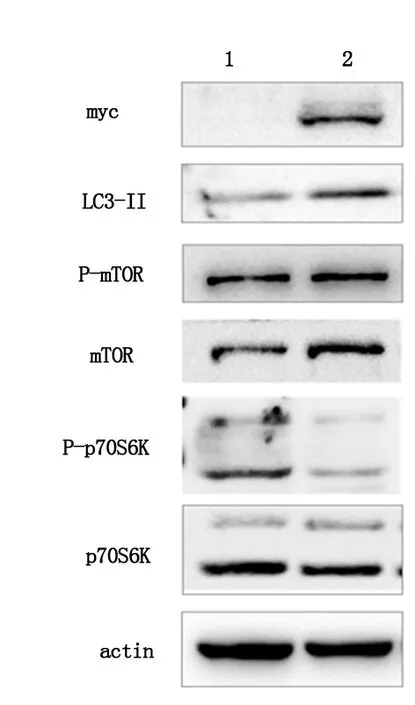
1:未过表达OSBPL3的胃癌细胞株; 2:过表达OSBPL3的胃癌细胞株
2.4OSBPL3促进胃癌细胞的迁移结果显示,在过表达 OSBPL3 后,无 EGF 处理的 AGS 细胞迁移至小室另一侧的细胞数显著增多[(252.333±28.386)vs(86.333±3.480),P<0.01];在 EGF 处理下,OSBPL3 过表达细胞株的迁移能力相比对照细胞株也有所增强[(281.000±16.643)vs(358.667±43.781),P<0.05],见图3。以上结果表明,过表达 OSBPL3 促进了AGS胃癌细胞的迁移。
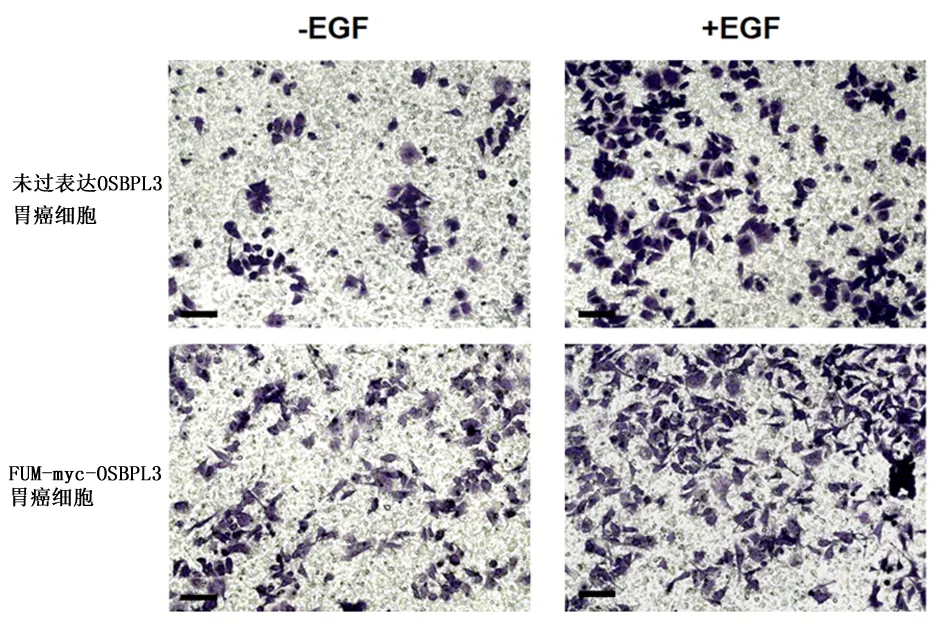
图 3 OSBPL3过表达促进胃癌细胞迁移
3 讨 论
胃癌在全球范围内都有着高发病率、高死亡率的特点,胃癌的转移一直以来是胃癌患者死亡和复发的重要原因[10-11],肿瘤的转移实际上是由代谢和肿瘤微环境改变所引起的应激反应,肿瘤细胞恶性增殖过程中所出现的缺氧和营养缺乏等情况促进了转移的发生[12]。
自噬在肿瘤的发生和发展过程中发挥着十分重要的作用[13-14],而LC3则是自噬过程中的关键分子[15],其中LC3B(以下简称LC3)是研究最广泛、最常检测到的亚型,LC3B在大多数细胞中表达为全长胞质蛋白,在诱导自噬后,被水解切割形成胞质可溶性 LC3-I,并暴露其C端甘氨酸基团,经ATG复合物协同激活后,通过C端的甘氨酸基团与 PE共价结合生成 LC3-II,也被称为膜结合型LC3-II。LC3-Ⅱ能附着于自噬体的双层膜结构上,介导自噬体与溶酶体的融合[16]。 LC3-II的量反映了自噬的水平,故被广泛用作自噬体生物标志物[17]。与LC3相互结合的蛋白也通常被视为自噬相关蛋白,如已经被广泛研究的SQSTM1(又称p62)、NEDD4等均被证实以不同方式参与了自噬的调节过程[18]。本研究通过GST-LC3pulldown实验和质谱分析在AGS细胞中检测到了可能与LC3相互作用的蛋白之一(OSBPL3),GST-LC3 pulldown实验及免疫共沉淀实验验证了OSBPL3的确是一个LC3结合蛋白,提示OSBPL3可能参与自噬的调节。
有证据表明OSBPL3的同源蛋白OSBP、ORP4L等调节自噬的机制均与mTOR通路相关[19],因此我们推测OSBPL3是否同样通过mTOR信号通路参与自噬过程。于是我们用构建的OSBPL3过表达胃癌细胞株检测了其自噬水平和mTOR信号通路中关键分子mTOR和p70S6K的表达,结果发现,OSBPL3过表达上调了LC3的表达水平,且核糖体蛋白激酶p70S6K的磷酸化水平被抑制。核糖体蛋白激酶p70S6K作为mTOR的下游分子,受其磷酸化的调节控制细胞内蛋白的翻译、细胞的生长、繁殖、能量代谢和自噬,这表明OSBPL3可能通过抑制p70S6K的磷酸化上调胃癌细胞的自噬水平。
另外我们通过小室迁移实验发现OSBPL3过表达促进了胃癌细胞的迁移,自噬与肿瘤转移的密切关系已经得到了广泛的研究,自噬可以通过调节肿瘤细胞运动和侵袭能力、肿瘤干细胞存活和分化、抵抗失巢凋亡、肿瘤细胞休眠和逃避免疫监视能等方式促进肿瘤转移[20],但本研究中OSBPL3是否通过其介导的自噬来调控胃癌的细胞迁移能力及其具体机制仍不明确。
综上所述,OSBPL3作为一个自噬调节蛋白对胃癌细胞的迁移具有促进作用,但其具体的机制还有待进一步探索。