终末期肾病肾性贫血患者甲状旁腺激素水平及临床意义
张东伟,于 源,邓启磊
终末期肾病(end-stage renal disease,ESRD)是各种原发和继发性慢性肾脏疾病发展的终末阶段[1]。ESRD患者不仅遭受着肾病本身的折磨还同时承受着并发症对机体带来的不利影响,严重的并发症甚至造成患者死亡[2]。肾性贫血作为ESRD较常见的并发症之一,目前认为主要与肾功能损伤和全段甲状旁腺激素(iPTH)的异常有关[3]。因疾病进一步发展,患者血肌酐(Scr)和血尿素(BUN)水平出现不同程度的升高[4],导致ESRD患者肾小球滤过率严重下降,促进甲状旁腺激素(PTH)分泌增加,出现钙磷代谢障碍,同时iPTH在调节血钙的同时可以升高红细胞内钙离子浓度,使红细胞内钙离子超载,进一步导致红细胞的细胞膜渗透脆性增加而导致贫血;且随肾功能损伤的加剧,肾脏1-α羟化酶的活性受到抑制同时拮抗1,25-二羟基维生素D3对PTH的抑制作用减弱,进一步促进iPTH的释放[5];另外骨外组织在iPTH作用下可以释放肿瘤坏死因子并增强血小板源性生长因子的作用,导致骨髓纤维化抑制红细胞的生成,iPTH还可抑制骨髓内红系祖细胞进而导致红细胞数量减少[6]。目前临床对于ESRD肾性贫血的进展多通过临床贫血症状和监测患者血液相关指标进行判断,但在ESRD的早期肾性贫血症状并不明显,常会延误时机,导致病情进展,造成不良预后[7]。因此对ESRD肾性贫血进行及时诊断能够延缓疾病进展,避免贫血进一步加重对患者预后造成不利影响。本研究分析ESRD肾性贫血患者PTH的表达及与贫血程度的关系,旨在为临床早期诊断识别提供依据。现报告如下。
1 资料与方法
1.1临床资料 选择2019年6月—2021年1月我院收治的ESRD肾性贫血102例作为观察组。诊断标准:经临床症状和实验室检查确诊为ESRD肾性贫血患者[8]。纳入标准:符合上述诊断标准;无其他严重并发症;无导致贫血的其他系统疾病;未接受其他激素治疗。排除标准:严重感染或代谢性疾病;近半年内有出血史或输血史。选择同期收治的慢性肾病贫血100例作为对照组。2组性别、年龄等方面比较差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1酶联免疫吸附试验测定血清iPTH含量:采集患者晨起空腹静脉血3 ml,将血标本置于自动血液离心机[翊诺科技(上海)有限公司,TD4X]以3000 r/min离心处理15 min分离血清,使用人PTH酶联免疫吸附试验试剂盒(深圳子科生物科技有限公司,型号96T)测定血清iPTH含量。
1.2.2化学发光分析法测定血红蛋白(Hb)、血清钙、Scr和BUN的含量:采集患者血液经过离心处理取血清后使用奥森多全自动生化分析仪(上海三崴医疗设备有限公司,国械注进20173406577)测定患者Hb、血清钙、Scr和BUN的含量。

2 结果
2.1血清iPTH、钙、Hb、Scr、BUN含量 观察组血清iPTH、钙、Scr、BUN较对照组升高,Hb较对照组降低(P<0.01)。见表1。
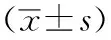
表1 2组血清学相关指标水平比较
2.2不同程度ESRD肾性贫血患者血清iPTH、钙、Hb、Scr、BUN的含量 重度组血清iPTH、钙、Scr、BUN较轻、中度组升高,且Hb较轻、中度组降低(P<0.01)。见表2。
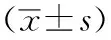
表2 不同程度ESRD肾性贫血患者血清iPTH、钙、Hb、Scr、BUN含量比较
2.3血清iPTH含量与Scr、BUN及Hb的关系 Speraman等级相关性分析结果显示,血清iPTH与Scr、BUN呈正相关(r=0.591、0.643,P<0.01),与Hb呈负相关(r=-0.482,P<0.01)。
2.4血清iPTH预测ESRD肾性贫血程度的ROC曲线分析 ROC曲线分析显示,iPTH指导ESRD肾性贫血不同程度鉴别诊断时,约登指数为0.776,对应最佳截断值为327.18 pmol/L,曲线下面积(AUC)为0.842,敏感度、特异度分别为93.85%、83.78%。
3 讨论
慢性肾脏疾病患者贫血的发病率高达60%,且随着肾功能损伤进一步发展,ESRD患者贫血的发生率也越来越高[9-11]。Scr含量明显升高说明肾小球滤过率下降,研究表明用Scr含量推断肾小球滤过功能具有较高的特异度和敏感度[12]。BUN与肾小球滤过功能有一定关联,但会受到多方面因素影响,因此并不能单独作为直接判定肾小球滤过功能的指标,故而同时监测Scr和BUN能够反映肾小球滤过功能和肾功能损伤情况[13]。随着肾功能损伤的加剧,肾小球滤过功能进一步下降,甲状旁腺对机体钙磷失衡产生应激反应进一步促进iPTH分泌的释放;此外,肾小球滤过功能下降使体内酸性物质蓄积可以拮抗1,25-二羟基维生素D3在信使核糖核酸中对iPTH的抑制作用,使iPTH含量进一步增加[14];另外iPTH可以通过刺激钙离子通路进而影响钙分布,导致肾小管对钙离子的重吸收,影响磷酸的排泄,使血清钙含量增加[15]。随着疾病进展和iPTH释放增多,肿瘤坏死因子分泌增加,促进骨髓纤维化影响红细胞功能,使患者出现贫血[16]。
本研究结果显示,观察组血清iPTH、钙、Scr、BUN较对照组升高,且Hb较对照组降低,且重度贫血ESRD患者血清iPTH、钙、Scr、BUN较轻、中度组升高,Hb较其降低,提示ESRD患者出现肾性贫血与血清iPTH、钙、Scr、BUN含量的变化有关。分析原因为随着疾病进展,肾损伤加剧导致Scr和BUN水平进一步升高,PTH分泌增加,异常分泌的iPTH可以影响钙离子分布,而钙在细胞膜外的移动受电压依赖性钙离子通道的调控,iPTH通过刺激上述通道影响钙的正常分布使细胞内钙离子增加,高浓度钙使膜骨架蛋白降解,使得膜结构重排,磷脂酰丝氨酸外翻,使薄膜的稳定性和完整性受到影响,缩短红细胞的寿命加重患者贫血症状,导致Hb下降[17]。
另外,本研究结果还表明,iPTH与Scr和BUN呈正相关,与Hb呈负相关,且经ROC曲线分析iPTH指导ESRD患者有无肾性贫血及贫血严重程度分级拥有较高的效能,说明随着肾损伤加剧,患者iPTH进一步升高,Hb呈现下降趋势,患者贫血严重程度加剧,提示iPTH不仅可以用作鉴别ESRD有无肾性贫血的指标,还能够作为区分轻、中度与重度贫血的指标。分析原因为Hb是目前临床用于诊断贫血程度的重要指标[18],但在ESRD早期,Hb可能没有明显的变化故而对于患者是否出现贫血缺乏准确判断,随着肾损伤加剧,肾小球滤过率明显下降而引起钙磷排泄不良、酸性代谢物质潴留可以抑制肾脏1-α羟化酶的生物活性,同时拮抗了1,25-二羟基维生素D3在信使核糖核酸水平对iPTH的抑制作用,因此iPTH在ESRD早期即可快速升高,故可以用iPTH用来鉴别诊断ESRD患者有无肾性贫血。iPTH导致患者出现贫血的原因:一方面,iPTH通过增加胞内钙促使红细胞凋亡,加重贫血,另外,其还可以通过分子途径促使骨髓出现纤维化,改变造血微环境的同时阻碍造血干细胞正常的活化程序,在iPTH刺激下,人类骨髓红细胞集落形成受到抑制,其通过激活细胞表面的电压依赖通道增加阳离子内流,进一步提高红细胞膜渗透脆性,产生溶血而加重患者贫血反应;另一方面,红细胞表面存在一种骨化三醇受体,当iPTH浓度增加时可以抑制此受体的活性,同时活性维生素D缺乏表现为促红细胞生成素减少[19],因此iPTH也可以造成促红细胞生成素的减少,导致贫血加重。因此iPTH可以用来指导肾性贫血的严重程度。
综上所述,随着肾功能减退,iPTH含量明显增高使血清钙增加导致Hb含量降低,进而加重ESRD肾性贫血程度,且iPTH在肾性贫血严重程度方面具有较高诊断效能。

