外源茉莉酸甲酯对镉胁迫下高羊茅生长及生理指标的影响
马志强, 史 毅, 种培芳
(甘肃农业大学林学院, 甘肃 兰州 730070)
当前,土壤重金属污染问题已成为我国最突出的环境污染问题之一[1]。2014年公布的《全国土壤污染调查公报》显示,全国重金属总超标率达16.1%,其中镉的点位超标率为7%[2]。1990年,我国土壤中的镉含量的算术平均值为0.097 mg·kg-1[3],至2014年上升至点位超标(0.3 mg·kg-1),表明有大量镉进入土壤。估算每年进入农田的镉高达1417 t,但经由不同渠道输送的镉仅占13%,剩余的87%则滞留在土壤中[4]。Lei[5]等人研究认为,以耕层20 cm,土壤容重为1.15 g·cm-3进行计算,到2040年所有耕地土壤中的镉含量都将超过现有标准(0.3 mg·kg-1)。以上数据不仅表明了土壤污染的现状,同时反映了近10年以来的确有大量Cd进入土壤,而大量Cd进入土壤后,将会在植物体内进行富集,通过食物链进入人体,进而直接危害人类安全。当前,解决Cd污染已成为一个迫在眉睫的问题。
为有效应对镉胁迫,前人提出许多治理方法,如中国林科院在重镉污染区,通过种植甜高粱(Sorghumbicolor)来提取酒精,从而降低镉污染程度,但效果甚微[6];天津市农业环保局通过在镉污染土壤中施加石灰或镁钙磷肥化学改良剂,使其与土壤中的镉结合形成难溶性化合物,将镉固定于土壤中,减少镉对植物的损害[7],但这些手段无疑为短期行为,一旦土壤理化性质改变,土壤中的Cd将被重新释放,继续对土壤造成污染。目前,生态修复因具有污染低、持续时间长等特点已成为治理镉污染的新兴手段之一,植物修复是生态修复的措施之一,一些植物可以有效应对镉胁迫[8]。其中大部分草坪草对Cd有富集作用,草坪草吸附Cd的过程中,Cd大多富集于根系中,植株地上部分的Cd含量较少,草坪草通过其发达的根系将大量Cd固定在体内[9],达到逐年去除土壤中的Cd2+,改良土壤的目的,且因为草坪草具有生长速度快、可反复修剪、兼具景观效应等特点,其在修复镉污染土壤中已占据重要地位。目前,已有部分关于镉污染下草坪草抗性及其修复效果的研究,如Luo[10]等人对镉胁迫下黑麦草中一些生理指标的变化进行了分析;杨卓[11]研究了高羊茅及黑麦草中一些品种对镉的富集性,均发现草坪草对镉污染的治理具有一定效果。高羊茅(Festucaelata)作为草坪草的一种,因具有较好的成坪绿度、耐践踏性与耐热性的性状被广泛应用于草坪建植[12-14]。将高羊茅作为镉污染防治植物的报道中,前人研究[15-17]已发现高羊茅对镉具有较强的抗性,在镉污染土壤的修复方面具有一定的研究意义。但单一通过草坪草对镉污染土壤进行修复其效果较低[18],当镉积累到一定程度后,植物生长速度减缓、植株矮小,产量进一步下降[19],植物对镉的抗性降低。为增强草坪草对镉的抗性,施加外源缓解剂已成为当前的解决途径之一,当前,已研究有将DMTU[20]、柠檬酸和EDTA[21]等作为缓解剂来增强高羊茅对镉的抗性,进一步提升高羊茅对镉污染的治理效果,但是以茉莉酸甲酯(jasmonic acid methyl ester,MeJA)作为缓解剂,研究其对草坪草治理镉污染土壤影响的报道较少。
茉莉酸甲酯是从素馨花(Jasminumgrandiflorum) 精油中分离出来的一种挥发性物质[22],在植物胁迫防御中起重要作用[23]。重金属胁迫会使得植物体内源茉莉酸(JA)含量上升,而JA的生物合成及信号转导对植物在应对非生物胁迫时起调控作用,防御机制中多种表达基因表现为上调趋势[24],而加入外源MeJA后,相对于受单一Cd2+处理的植物,植物体内JA含量进一步增加,信号传导被强化,植物抗性进一步提升,使得以MeJA作为缓解剂具有了实践意义。当前以MeJA作为缓解剂研究镉胁迫对植物的影响[25-26]中,大多为单一地分析植物生理指标,而植物-土壤作为一个共同体,对于外源缓解剂或镉胁迫的反应是相互关联的。目前,将生理指标和土壤指标结合起来分析茉莉酸甲酯对高羊茅修复镉污染土壤的影响的研究鲜有报道。
本文以外源MeJA作为缓解剂,高羊茅作为修复植物,通过对植物的生理活性、土壤酸碱度、植物和土壤中的镉含量等进行分析,主要解决以下问题:(1)MeJA对Cd污染下高羊茅幼苗生长是否具有缓解作用?(2)如果有,其缓解剂的施用浓度是多少?(3)MeJA是否能调控高羊茅对Cd污染土壤的修复作用?
1 材料与方法
1.1 高羊茅种子
供试高羊茅品种为‘交战Ⅱ’(Cross Fire Ⅱ),选种依据为前人研究[15]中筛选出的耐Cd草种,购于兰州市金惠种子经营部。
1.2 幼苗的培养实验
选取大小一致的花盆(直径23 cm,高14 cm)若干,每个花盆内用蛭石填满,将高羊茅种子均匀播撒在花盆中并用薄土覆盖,之后每天用少量蒸馏水对种子进行1次浇灌,培养温度设定为室温,幼苗发芽至地上部分生长长度约1 cm时间苗,剔除生长过高或过低的草株,选取生长状况良好,叶片卷曲少的草株,控制密度为每盆20株幼苗,分布状况为不集中地均匀分布。预实验中,镉胁迫设置为Cd2+浓度100~150 μmol·L-1时,高羊茅生长状况受明显影响,低于此浓度时高羊茅生长被促进,高于此浓度时高羊茅生长受严重抑制,遂选定Cd2+浓度为100 μmol·L-1。选定Cd2+浓度为100 μmol·L-1后,MeJA溶液浓度梯度设置为0,10,25,50,75,100 μmol·L-1后,高羊茅在镉胁迫下的生长被缓解且呈梯度变化,高于100 μmol·L-1后,高羊茅生长被抑制,而低于10 μmol·L-1的MeJA溶液对镉胁迫下高羊茅生长的缓解效果不明显,遂选定此浓度间的梯度范围作为本实验的MeJA的施用区间。镉离子溶液配置方法为CdCl2·1/2H2O进行溶解,CK全过程施用1/2 Hoagland溶液进行培养,共7个处理,每个处理设3个重复,如表1所列。

表1 镉处理浓度及外源MeJA施用浓度
间苗前不施加胁迫;间苗后,每天采用叶面喷施法在高羊茅幼苗叶片上均匀喷施MeJA与Cd2+溶液,喷施至叶面滴水。喷施时间:Cd2+为清晨,MeJA为傍晚。CK的培养过程中,每天在其叶片表面均匀喷施1/2 Hoagland溶液,喷施至叶面滴水。经过15 d的处理后,采集样本,在采集时注意剪掉叶尖及根部,选取其相同部分作为试验材料。
1.3 指标与方法
1.3.1生理指标测定 采用丙酮提取法[27]测定叶片叶绿素含量。叶片中干物质的含量选取烘干法进行测定,采用NBT光还原法[28]对SOD活性进行测定,采用愈创木酚法[28]测定POD活性,采用过氧化氢还原法测定CAT[29]活性,参考《植物生理生化实验原理和技术》中的测定方法对APX活性、超氧阴离子自由基和过氧化氢含量进行测定[28],采用TBA显色法[28]测定丙二醛的含量,采用酸性茚三酮[28]显色法测定游离脯氨酸含量。
1.3.2Cd富集指标测定 叶片及根中镉含量测定参照黄美玉报道的方法[30],土壤中镉含量采用石墨炉原子吸收光谱法(GFAAS)[31]进行测定,对高羊茅的根叶部分的鲜重和干重分开称量并记录,用尺子对地上部分的生物量进行测定,本实验中只选取地上部分处理前后的高度差作为生物量,其余生物量不测定,生物量测定时在处理前对高羊茅统一修剪并记录长度,处理14 d后测量并记录地上部分高度。
转运系数、富集系数及地上部分生物量的计算公式如下:
转运系数=叶中的Cd浓度/根中镉浓度
富集系数=高羊茅体内Cd浓度/土壤中Cd浓度
生物量=处理后高羊茅地上部分高度-处理前高羊茅地上部分高度
1.4 数据处理
采用SPSS 26.0分析数据并用“平均值±标准误差”表示测定结果,分别对镉胁迫下施用不同浓度的MeJA处理的实验结果进行单因素方差分析;采用Origin 2018作图。
2 结果与分析
2.1 外源茉莉酸甲酯对镉污染下高羊茅生长指标的影响
由图1A和图1B可知,镉胁迫下,施用外源MeJA后高羊茅根系及叶片鲜重及干重的变化趋势。发现除CK外,T3处理时根系及叶片鲜重最大,相较于T0处理分别提升了136.79%及205.56%,差异显著(P<0.05),但与CK差异均不显著(P>0.05);干重也在T3处理时升至最高,根系及叶片干重较T0处理分别提升150.27%和187.83%,差异显著(P<0.05),但与CK差异均不显著(P>0.05)。
由图1C可知,镉胁迫下,T3处理时高羊茅地上部生物量(处理后地上部高度—处理前高度)至最高点,较T0处理高羊茅的生物量显著提升272.43%(P<0.05),T2和T4处理时2组间差异不显著(P>0.05),但较T0处理提升153.47%和184.45%,均差异显著(P<0.05)。图1D为镉胁迫下施用MeJA后高羊茅根系及叶片长度的变化,除CK外,植株根系在T3和T4处理下长度最长,2组数据在镉浓度下的长度差异不显著(P>0.05),相较于T0处理分别提升了58.18%和58.43%,差异显著(P<0.05);T3处理下高羊茅叶片长度相较于T0处理时根系长度提升了231.47%,差异显著(P<0.05)。

图1 外源茉莉酸甲酯对镉污染下高羊茅鲜重、长度及生物量的影响
2.2 外源茉莉酸甲酯对高羊茅体内镉含量的影响
由表2可知,镉胁迫下,施用MeJA后高羊茅叶片及根系镉含量的变化趋势。由表可知,随着施用MeJA浓度的增大,高羊茅根系与叶片中的镉含量呈上升趋势,分别T3和T2处理时升至最高,较T0处理显著提升了59.58%和38.64%(P<0.05)。转运系数在低浓度MeJA处理时高于高浓度的MeJA处理,T1和T4处理间差异不显著(P>0.05)。
表2 外源茉莉酸甲酯对镉胁迫下高羊茅幼苗根系及叶片镉含量的影响
2.3 外源茉莉酸甲酯对土壤pH、富集系数及土壤镉含量的影响
由图2A可知,只添加Cd2+时,土壤pH最高,T2和T3处理下pH下降,2个梯度间差异不显著(P>0.05),相较于T0处理分别下降6.03%和5.56%,差异显著(P<0.05);图2B显示了施用MeJA土壤富集系数与土壤中镉含量的变化趋势,从富集系数来看,施用MeJA后,富集系数呈上升趋势,T3处理时升至最高点,相较于T0处理提升了88.44%,差异显著(P<0.05),超过此浓度后富集系数呈下降趋势;土壤镉含量观察可得,T0处理时土壤镉含量最高,施用MeJA后土壤中镉含量均显著下降(P<0.05),T3处理下土壤镉含量最低,较T0处理下降了27.49%,差异显著(P<0.05)。
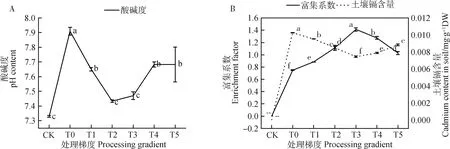
图2 外源茉莉酸甲酯对高羊茅修复镉污染土壤的影响
2.4 外源茉莉酸甲酯对镉胁迫下高羊茅幼苗生理特性的影响
2.4.1茉莉酸甲酯对镉胁迫下高羊茅叶片叶绿素含量的影响 由表3可知,不同浓度的MeJA对镉胁迫下叶片中叶绿素a、叶绿素b及类胡萝卜素含量的影响。施用MeJA后,高羊茅叶绿素a、叶绿素b及类胡萝卜素含量在T3处理时达到最高,相较于T0处理分别提升了86.78%,139.13%和154.00%,差异显著(P<0.05),与CK相比差异不显著(P>0.05),当MeJA浓度继续升高时,叶绿素a、叶绿素b、类胡萝卜素含量,以及叶绿素a/叶绿素b的数值明显下降,相较于T3处理,叶绿素含量差异显著(P<0.05);超过T3处理浓度时叶绿素a、叶绿素b及类胡萝卜素含量均呈下降趋势。

表3 镉胁迫下不同MeJA浓度高羊茅叶片叶绿素的影响


图3 外源茉莉酸甲酯对高羊茅过氧化氢及超氧自由基含量的影响
2.4.3外源茉莉酸甲酯对镉胁迫下高羊茅幼苗抗氧化酶活性、丙二醛和游离脯氨酸的影响 由图4A和图4B可知,了外源MeJA对镉胁迫下高羊茅幼苗抗氧化酶活性的影响,发现施用MeJA后,抗氧化物酶活性均呈先减后增的趋势。图4A中,POD活性于T3处理时升至最高,相较于T0处理提升了307.23%,差异显著(P<0.05);T3和T4处理下,SOD活性相较处理分别提升53.87%和86.90%,差异显著(P<0.05)。图4B中,除CK外,CAT活性在T3处理时达到最高,与CK差异不显著(P>0.05),相较T0处理提升769.07%,差异极显著(P<0.01);T2处理相较于T0处理,APX活性分别提升61.97%,差异显著(P<0.05)。
图4C为镉胁迫下施用外源MeJA后高羊茅幼苗MDA和游离脯氨酸的变化趋势。图4C中,T0处理下,MDA和游离脯氨酸含量最高。T2处理下,MDA含量相较于T0处理下降了53.48%,差异显著(P<0.05),相较于T1和T4处理,差异不显著(P>0.05),在T3处理时MDA含量最低,较T0处理下降61.20%,差异显著(P<0.05);除CK外,在T2处理时游离脯氨酸含量最低,相较于T0处理下降87.81%,差异显著(P<0.05)。

图4 外源茉莉酸甲酯对镉胁迫下高羊茅幼苗抗氧化酶活性、丙二醛和游离脯氨酸的影响
3 讨论
3.1 MeJA对镉胁迫下高羊茅生理特性的影响
叶绿素含量是对植物生长发育过程中光合作用强度的反映,镉胁迫可影响植物叶片叶绿素的形成,进一步影响植物的光合作用[32],其中叶绿素a在光合作用中起转换光能的作用,叶绿素b在光合作用中作为天线色素之一,起吸收并传递光能的作用,类胡萝卜素存在于叶绿体中的作用则是淬灭过剩的光能。本研究中,当Cd2+浓度为100 μmol·L-1时,高羊茅幼苗的叶绿素a、叶绿素b及类胡萝卜素含量明显降低,T3处理下,高羊茅叶绿素a、叶绿素b及类胡萝卜素含量较T0处理明显增加。原因可能是在该浓度的镉胁迫下,叶绿素酶活性增强,分解速率被加快,导致叶片叶绿素含量下降[33],初步揭示了高羊茅幼苗在镉胁迫下的中毒机制,而施用MeJA后,缓解了镉胁迫对高羊茅光合作用的影响,提升了光能转换效率,幼苗对镉胁迫的抗性提升。Per等[34]的研究结果表明,外源MeJA在提升类囊体蛋白稳定性的同时对其组装起到促进作用,从而使得叶绿素a、叶绿素b及类胡萝卜素含量相对于T0处理呈上升趋势。
抗氧化酶系统作为植物遭受环境胁迫时的重要防御体系,多项研究[35-36]表明,植物对胁迫的抗性与过氧化酶活性的高低关系密切,另外Mittler[37]研究发现,抗氧化酶的循环可以在植物体内作为清除活性氧与自由基的通路。本研究中,T1~T4处理下,高羊茅幼苗体内的抗氧化酶活性较T0处理明显升高,而高羊茅体内的超氧自由基与可以产生活性氧的过氧化氢含量明显降低,原因为MeJA直接参与了活性氧与自由基的清除,使得植物酶活性升高,表明施用适当浓度的MeJA可以提升植物对镉胁迫的抗性[25-26]。但当处理梯度大于T3时,高羊茅体内抗氧化酶含量下降,H2O2与超氧自由基含量上升,推测是高浓度的MeJA作为信号分子的同时,过度诱导植物体内活性氧的积累,堵塞了抗氧化酶的循环道路,降低了植物的抗氧化酶活性。
MDA含量的提高意味着植物酶和膜系统遭到破坏[38],而Pro在植物体内起调节氧化还原反应的作用[39]。本研究中高羊茅受T0处理时,MDA和Pro含量增加,在T2及T3处理下,MDA和Pro含量相较其他处理浓度较低,说明Cd2+会破坏植物体内的酶和膜系统[40],而大量MDA和Pro产生表明高羊茅应对镉胁迫时有较强的抗逆性。MeJA则直接参与了清除植物体内ROS的过程[41],使得高羊茅中MDA和Pro含量降低。
综合上述分析,Cd污染下生长的高羊茅在施用MeJA后,叶绿素含量上升、作为植物胁迫防线的抗氧化酶含量上升、清除了一部分植物体内超氧自由基与产生活性氧的过氧化氢、降低了MDA和Pro的含量,表明MeJA对Cd污染下高羊茅幼苗的生长确实有缓解作用,并且发现处理梯度为T2~T4时,其对镉污染下高羊茅幼苗的生长缓解作用较大,与前人[25]研究结果不同,这可能是选用草种不同而产生的差异。
3.2 不同浓度的MeJA对高羊茅修复镉污染土壤的影响
植物根系作为土壤中重金属污染物进入的首要关卡,在重金属胁迫及吸收过程中起重要作用[42]。本研究发现,高羊茅吸收Cd的过程中,Cd大多富集于其根系中,根系中Cd含量明显高于所对应的叶片中的镉含量[43]。其毒害机理为酶活性中心或蛋白质中的生长细胞与Cd2+相结合,取代金属蛋白中的必需元素,进一步使得根系中生物大分子的构象改变、酶活性丧失[44],使得根系中镉含量升高。
本研究中,施用Cd2+溶液后高羊茅根系长度下降、质量减轻,原因是Cd2+会抑制根系细胞的生长和分裂,造成根系的损伤,阻止根系伸长。施用MeJA后,高羊茅根系长度增长,质量增加,根系镉含量上升,原因为高羊茅体内中贮藏蛋白VSPs和mRNA的表达被诱导[45],促进了高羊茅对Cd的吸收。T3处理下,根系的重量、长度及镉含量最高,但施用过高浓度MeJA后,根系鲜重及镉含量下降,推测该浓度的Cd胁迫下,过高浓度施用MeJA后植物防御体系被过分诱导,反而对植物生长造成损害,减缓了根系对Cd的吸附。
铁梅[43]等在研究中指出,在选择Cd治理草种时应选择根系发达且具有较强富集能力的草种,本研究中,通过对高羊茅根系长度及重量的分析,表明高羊茅具有作为Cd污染土壤修复植物的潜力,MeJA强化了高羊茅治理镉污染土壤的能力。叶片中的镉含量也是在T3处理时时最高,超过此浓度后叶片中镉含量下降、叶片缩短,原因可能为茉莉素促进了叶片的衰老[46],而叶片衰老常伴随着SOD、POD、CAT活性的下降,MDA含量的上升[47-48],同生理活性讨论的结果一致,过多施用MeJA后高羊茅抗氧化酶下降、MDA含量上升,进一步表明是叶片衰老后使得高羊茅叶片对镉的吸附力下降。
转运系数是用来评价植物将重金属从地下向地上运输与富集能力的指标,与植物的生理、生化等因素相关[49]。转运系数越高,重金属从根系向地上部器官转运的能力越强。本研究结果显示,高羊茅对Cd2+虽然没有同超积累植物那样的吸附力,但T0处理下高羊茅依旧有着较高的转运系数,可能有以下原因:植株体内对镉的吸收和积累受较多生理过程的影响,包括根系吸收、地上部各器官对Cd的再分配及抗氧化酶系统的变化[50];或是Cd进入植物体内后,一部分通过区域化把重金属累积于液泡或细胞壁中,或者通过络合作用缓解重金属在细胞中的存在浓度[51]。T3和T4处理下,高羊茅转运系数明显高于T0处理,表明适宜浓度的施用外源MeJA确实能够提升高羊茅镉转移能力,原因是MeJA作为茉莉酸(JAs)的种类之一,能够调控植物对重金属胁迫的反应。
土壤中的pH可以反映高羊茅吸附土壤中Cd的能力,而调节土壤pH可以缓解镉对土壤的污染[52]。本研究中,镉污染土壤中生长的高羊茅,施用MeJA后,土壤pH较T0处理明显下降,对应的土壤镉含量也呈下降趋势,呈正相关[53]。原因可能是MeJA加强了高羊茅对Cd2+的吸收效率,促进了Cd2+与高羊茅根系中非生长细胞的结合,使得土壤中镉含量下降,土壤pH下降。
富集系数是评价植物对Cd富集能力的重要指标之一,富集系数高,则植物对Cd的吸收积累能力强,对Cd污染土壤的治理效果越好[54]。本文研究发现,T2~T4处理下,高羊茅的富集系数大于1,表明高羊茅在施用适当浓度的MeJA后对Cd的富集能力加强,同时对转运系数进行分析,得出施用此浓度的MeJA使得高羊茅能够有效富集土壤中的Cd同时,其体内对Cd的转运能力也被提升。
土壤镉含量直观反映了土壤中Cd2+的含量,T2~T4处理下,土壤中的镉含量明显降低。结合本文中对土壤pH的分析,进一步证明了本研究的合理性。但本文只设定了100 μmol·L-1的Cd胁迫,其余浓度下的Cd胁迫草种的选择还需今后进一步讨论研究。
综合上节中对高羊茅生理指标的分析来看,100 μmol·L-1的Cd胁迫下,MeJA的最佳施用区间为25~75 μmol·L-1(T2~T4处理下),此时高羊茅体内镉含量上升,叶绿素含量、抗氧化酶活性等也呈上升趋势,可能有两个原因:一是MeJA促进高羊茅吸收Cd的同时,该浓度的Cd与MeJA同时使得高羊茅体内酶活性增强,对高羊茅生长起促进作用,表现为低浓度促进,高浓度抑制[55],即该浓度的Cd胁迫不仅没有对高羊茅的生长造成损害,反而促进了高羊茅的生长;二是MeJA提升了高羊茅对Cd吸收的同时,阻止了Cd2+与植物生长细胞的结合,减轻了Cd对高羊茅幼苗的伤害,促使高羊茅更好地治理Cd污染土壤。
4 结论
本研究中,MeJA的加入增加了植物体内源JA的含量,加强了高羊茅体内的信号转导,防御基因被激活,植物应对Cd胁迫的抗性提升,从而促进高羊茅生长。而施用浓度25~75 μmol·L-1的MeJA后,随着高羊茅体内镉含量的上升,土壤pH及土壤中镉含量下降,表明该浓度的MeJA对用高羊茅治理镉污染土壤起促进作用。

