VCAM1 基因rs2392221 单核苷酸多态性与肾移植术后急性排异发生的相关性
刘小华,魏继福
1南京医科大学第一附属医院药学部,江苏 南京 210029;2南京医科大学附属肿瘤医院药学部,江苏 南京 210000
肾移植被认为是终末期肾脏病患者最有效的肾脏替代治疗方式之一[1]。与透析相比,肾移植患者的生活质量更高[2]。但一些肾移植相关的并发症,如急性排异、慢性移植物功能障碍、免疫抑制剂相关的肾毒性,增加了慢性肾脏病患者对移植的担忧[3-4]。此外,肾移植后发生严重并发症如急性排异会进一步导致移植物失功,慢性移植物功能障碍风险增加[5]。因此,了解急性排异的病理生理机制对肾移植患者短期及长期预后至关重要。
血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM1)是定位于细胞膜上,属免疫球蛋白超家族的黏附分子,其分子量为110 kDa。它特异地与白细胞(除中性粒细胞外)所产生的属Integrin家族的黏附分子VLA-4结合,介导细胞黏附和信号转导,在细胞分化、炎症反应、动脉粥样硬化等多种病理过程中发挥作用[6]。较多研究显示,VCAM1与移植排异相关[7]。本研究旨在探讨VCAM1 rs2392221 基因多态性与肾移植术后急性排异发生之间的关系。
1 对象和方法
1.1 对象
入选2011 年2 月—2015 年12 月在南京医科大学第一附属医院肾移植的200 例患者为研究对象。纳入标准:①年龄18~60岁;②肾移植术后至少3个月内肌酐稳定[肌酐<120 μmol/L,3 个月内未发生急性排异、肾功能延迟恢复(delayed graft function,DGF)或者机会性感染];③肾移植术后随访6 个月以上。排除标准:①慢性病毒感染如乙型肝炎、丙型肝炎、艾滋病患者;②妊娠患者。本研究经南京医科大学第一附属医院伦理委员会批准(2016-SR-029),所有患者均签署知情同意书。
1.2 方法
根据Banff 15标准诊断急性排异的患者。根据间质浸润和动脉内膜炎的程度对AR 进行评分[8]。随访期间发生急性排异的患者纳入AR 组,未发生急性排异的患者纳入非AR组。收集患者的临床资料,包括年龄、性别、身高、急性排异发生的情况、移植DGF的情况以及肾移植患者的免疫用药方案。
1.2.1 基因检测
检测步骤:①收集患者的外周血样本2 mL。提取DNA 后,利用琼脂糖凝胶电泳定量分析基因组DNA(gDNA)的浓度和纯度,并对基因完整性进行评估;②gDNA 被添加到含上游和下游特异性的目标区域的寡核苷酸混合物中。应用非接触式超声波破碎仪(Diagenode,比利时)裂解gDNA。裂解后进行末端修饰,添加接头,PCR 扩增;③扩增后按照制造商说明书将DNA 加载到Illumina cBot 仪器中,再基于人类参考基因组hg19 数据使用Genome Analysis Tool Kit、Picard软件和dbSNP 132进行分析。
1.2.2 免疫抑制治疗
所有移植受者的免疫诱导方案为巴利昔单抗。免疫维持方案为3 种或4 种免疫抑制药物:环孢素或他克莫司联合霉酚酸酯和泼尼松,加或不加西罗莫司。免疫抑制药物的剂量根据患者血肌酐水平及血药浓度调整。当患者出现急性排异时,糖皮质激素方案为甲强龙200 mg/d,冲击治疗3~5 d。
1.3 统计学方法
用SPSS24.0 软件进行统计分析。计量资料以均值±标准差()表示。计数资料用率表示。采用Logistic 回归分析基因型分布与急性排异的关联性,并计算各模型相关的比值比(odds ratio,OR)及95%可信区间(confident interval,CI)。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
研究共纳入200 例肾移植患者,男124 例,女76 例。200 例中有69 例(男42 例,女27 例)发生至少1次急性排异。2组患者的一般资料比较,差异无统计学意义(P>0.05,表1)。

表1 2组患者的一般资料比较Table 1 Comparison of baseline characteristics between AR and non⁃AR subjects
2.2 VCAM1 rs2392221基因多态性与AR的相关性
对VCAM1 rs2392221 与AR 发生之间的关系进行分析发现,VCAM1 rs2392221基因多态性与AR的发生显著相关。共显性模型CCvs.CT:OR=3.71,95%CI:1.82~7.58;CCvs.TT:OR=5.41,95%CI:1.14~25.75,P<0.001;显性模型OR=3.90,95%CI:1.97~7.72,P<0.001;隐性模型OR=3.57,95%CI:0.77~16.54,P=0.357;超显性模型OR=3.31,95%CI:1.65~6.65,P=0.002;加性模型OR=3.04,95%CI:1.70~5.43,P=0.034(表2)。
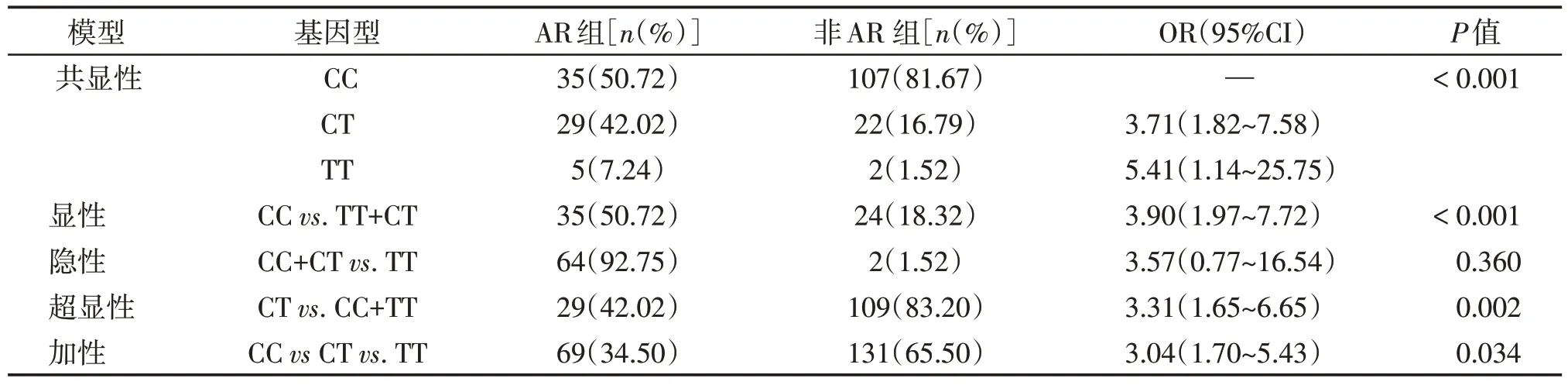
表2 rs2392221基因多态性与急性排异发生相关性分析Table 2 Results of multiple inheritance analysis of rs2392221 with the occurrence of acute rejection in five models
3 讨论
细胞黏附分子与白细胞向炎症部位的转运和聚集密切相关,如巨噬细胞和T 细胞。近年来研究显示,VCAM1 可能与免疫相关疾病的进展显著相关,如移植排异。由于器官移植供者或受者不匹配,所以移植后会发生移植排斥反应。移植排斥反应是由白细胞向炎症部位浸润引起的。淋巴细胞和单核细胞在排斥反应中起核心作用,并最终导致移植物损伤[9-12]。移植排斥反应是受者白细胞和供者内皮细胞之间复杂的相互作用。在过去几十年里,许多关于移植排斥的研究显示VCAM1 在移植器官的内皮细胞表达上调,包括肝、肾、肺和心脏。Lautenschlager 等[13]研究显示,肝移植患者发生急性排异时,VCAM1 在血管内皮表达显著增加。Hill等[14]研究显示在肾移植排斥反应中,VCAM1 在肾小管周毛细血管内皮表达上调,且主要表达于小管基底外侧表面。心脏移植患者发生急性排异时心肌内膜活检也显示VCAM1表达增加[15]。此外,Hart等[16]研究显示VCAM1 在造血干细胞移植也起到重要作用。因此,VCAM1的表达可能在移植排斥反应中发挥重要作用,并可能成为移植排斥反应的生物标志物。但目前缺乏VCAM1 基因多态性与移植排异相关性的研究。
VCAM1 rs2392221突变首次发现与肾移植急性排异相关。根据本研究结果,常规开展VCAM1 rs2392221 基因检测是优化肾移植患者维持免疫治疗方案的直接方法。通过基因分析,提前对潜在肾移植AR 患者进行鉴别,可以帮助早期诊断急性排异,及时调整肾移植患者免疫抑制方案,改善肾移植患者预后。当然,本研究也存在较多不足,首先本研究未对VCAM1 基因其他已报道过的突变位点进行检测和分析[17],其次本研究未分析肾脏病理与VCAM1 rs2392221的相关性。未来需要更大更多的临床研究以及体外功能试验来证实我们的观点。
综上,本研究显示VCAM1 rs2392221 基因多态性与肾移植患者急性排异的发生显著相关,VCAM1 rs2392221的基因检测可能有助于移植排异的早期诊断及治疗。

